水相合成1,2-二氢萘并呋喃*
2014-08-06潘金芸徐东成谢建武
潘金芸, 徐东成, 谢建武
(浙江师范大学 化学与生命科学学院,浙江 金华 321004)
呋喃类化合物因其为天然产物中的重要骨架及其广泛的药理活性而引起人们的广泛关注[1].尤其是环并呋喃,近年来对于这类化合物的合成方法进行了深入的研究,已取得了一些重要成果[2-3].广泛的科学研究及分子力学、分子动力学模型研究发现,萘并呋喃和呋喃并香豆素类化合物在生物医药等方面具有相似的性质,有着广泛的应用[4].如:治疗白癜风、牛皮癣的光敏药物[5]、农药杀虫剂及生物学核酸结构研究探针[6].此外,由于萘并呋喃衍生物的大共轭结构,可以用在染料、荧光物质[7]等方面.但是到目前为止,关于萘并呋喃衍生物合成的报道不是很多.而以水为溶剂的合成能在源头上减少和消除污染[8],水相反应具有经济性、环境友好性和纯天然性等优势[9].
本研究小组在2011年报道了一种苯并呋喃的合成方法,用4-羟基香豆素与溴代硝基烯烃在相转移催化剂四丁基溴化铵(TBAB)和醋酸钠(NaOAc)的作用下,用水做溶剂合成了一系列的2,3-二氢呋喃衍生物[10-11](见图1:前期工作).在已有研究的基础上,为了进一步拓展该合成方法中底物的广谱性,本文以2-萘酚与溴代硝基烯烃进行反应,以碳酸钾(K2CO3)作为催化剂,在水相中成功地合成了一种1,2-二氢萘并呋喃化合物(见图1:目前工作).该反应操作简单、高效,反应时间短且对环境污染小,产率均在80%以上.
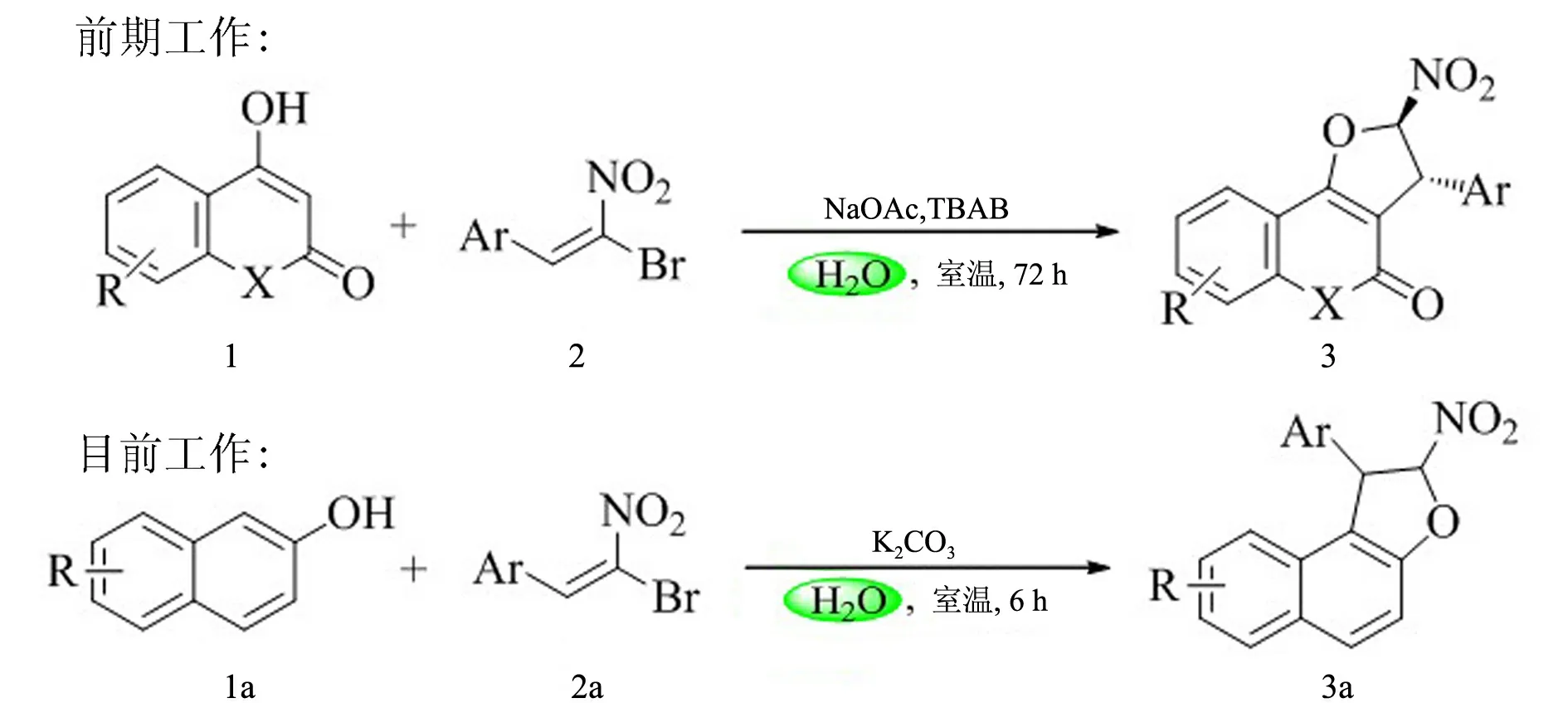
图1 研究内容
1 实验部分
1.1 试剂与仪器
1H NMR和13C NMR由Bruker Avance 400型核磁共振波谱仪(CDCl3为溶剂,四甲基硅烷(TMS)为基准物质)测试;熔点由WRS-1B数字熔点仪测定,温度计未校正;红外光谱(IR)使用Perkin-Elmer 1600傅里叶变换红外光谱测定仪测定,KBr压片法;单晶X-射线衍射用德国Bruker公司APEX ⅡCCD单晶衍射仪测定.所用试剂均为市售AR级.
1.2 1,2-二氢萘并呋喃衍生物的合成
反应方程式见图1:目前工作.
方法1:反应试管中依次加入β-萘酚(1a,0.12 mmol)、溴代硝基烯烃(2a,0.10 mmol)及K2CO3(6.91 mg,0.05 mmol),再加入H2O(1.0 mL),室温搅拌,薄层色谱硅胶板检测反应.反应结束后,用3×5 mL乙酸乙酯萃取,合并有机相,再用2×5 mL水洗,无水Na2SO4干燥,减压蒸除溶剂,硅胶柱色谱(洗脱剂V(乙酸乙酯)/V(石油醚)=1/50)分离得目标产物.
方法2:反应试管中依次加入β-萘酚(1a,0.12 mmol)、溴代硝基烯烃(2a,0.10 mmol)及K2CO3(6.91 mg,0.05 mmol),再加入无水乙醇(1.0 mL),室温搅拌,薄层色谱硅胶板检测反应.反应结束后,硅胶柱色谱(洗脱剂V(乙酸乙酯)/V(石油醚)=1/50)分离得目标产物.
2 结果与讨论
2.1 反应条件优化
2.1.1 溶剂对反应的影响
以β-萘酚(1a)和无取代的溴代硝基烯烃(2a)作为模板在不同溶剂中进行反应,结果见表 1.室温下,以二氯甲烷(DCM)为溶剂、三乙胺(Et3N)为催化剂,反应能顺利进行,同时产率适中(见表1:编号1).当不加额外的添加剂时,无论在有机溶剂或水中,反应都能进行,但非常微弱(见表1:编号2~7);而在水中,将温度升高到60 ℃或80 ℃反应24或30 h,反应仍很微弱(见表1:编号8~9).考虑到各种溶剂对反应的影响均较小,而水为溶剂相对而言较为经济绿色,最终确定以水作为反应的溶剂.

表1 溶剂对反应的影响
注:1)加入Et3N 0.01 mmol;2)反应温度为60 ℃;3)反应温度为80 ℃.
2.1.2 添加剂对反应的影响
添加剂碱的强弱对该反应有着重要的影响.以水为溶剂,对不同的碱进行了考察,碱与溴代硝基烯烃的摩尔比为0.5∶1,结果见表2.表2表明:该反应在有机碱(编号1~4)或无机碱(编号5~7)催化下都能顺利地进行;由于以水为溶剂,无机碱在水中的溶解性较好,故无机碱的催化效果明显比有机碱好.从表2还可以看出:以K2CO3作为反应用碱时(编号2),1,2-二氢萘并呋喃的产率较高,达到了92%;强碱和弱碱都显著降低了反应的产率;相比较于K2CO3,碳酸铯(Cs2CO3)的催化作用稍逊(编号3);当加入与溴代硝基烯烃摩尔比为100%的K2CO3时,反应时间缩短到4 h,产率并没有显著增加(编号8);相比较于其他的有机溶剂,乙醇(EtOH)也属于绿色溶剂之一,当以乙醇为溶剂、加入摩尔比为50%的K2CO3进行反应时,反应时间缩短到0.5 h,产率达到了95%(编号9).
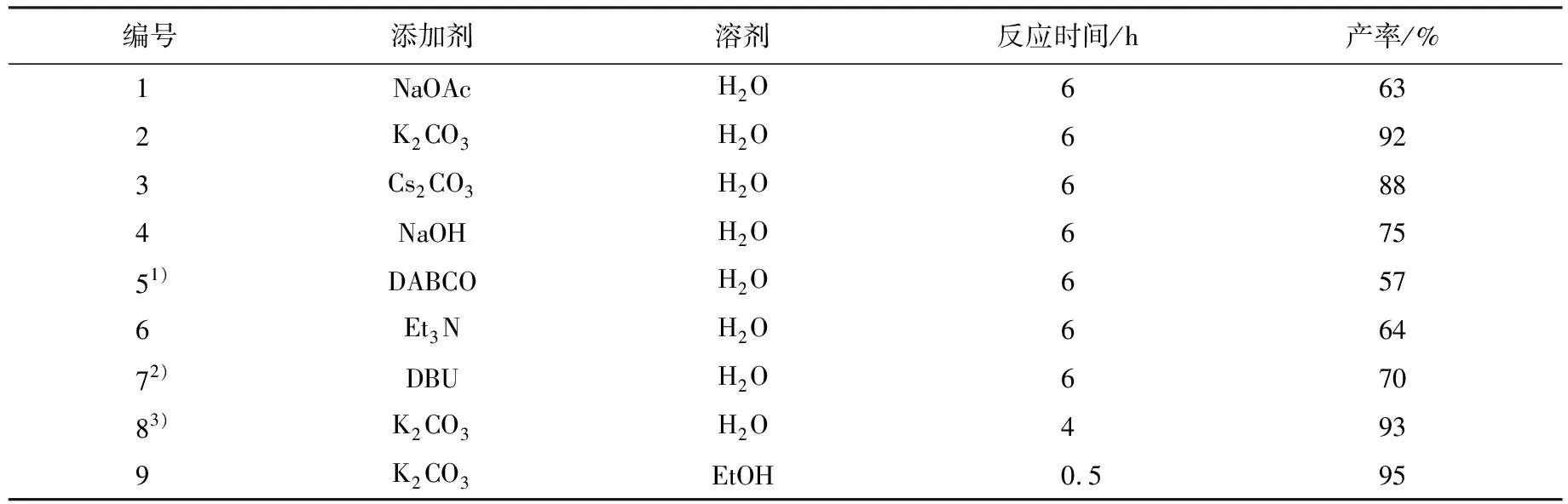
表2 添加剂对反应的影响
注:1)DABCO为三乙烯二胺;2)DBU为1,8-二氮杂双环[5,4,0]十一碳-7-烯;3)K2CO3加入量为0.10 mmol.
通过对各种条件的考察,得到优化后的反应条件为:以水为溶剂,摩尔比为100%的K2CO3为催化剂,室温下反应.
2.2 底物的适用范围
在优化的反应条件下,对反应底物的适用范围进行了研究,结果见图2和表3.首先,对溴代硝基烯烃上不同取代基的影响进行了考察,发现苯环上不论有吸电子基团还是给电子基团,都取得了较好的产率(见表3:编号1~12).接着,考察了β-萘酚上取代基的影响.萘环上不同位置的取代基,不论是吸电子基团还是给电子基团,也都取得了较好的产率(见表3:编号13~17).最后,考察了将底物1换成其他酚类化合物(如1-萘酚、苯酚)与溴代硝基烯烃在水相中进行Michael-Friedel-Crafts/alkylation串联反应,没有得到预期的目标产物.
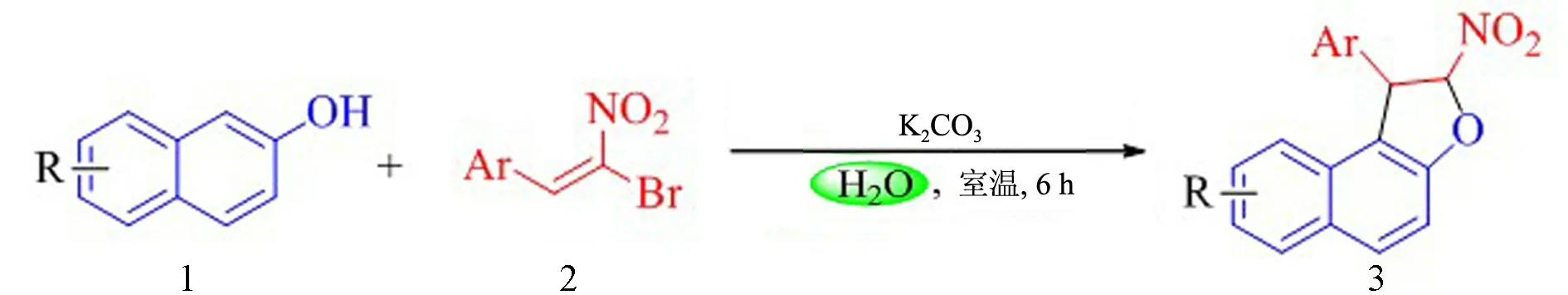
图2 优化条件下的反应
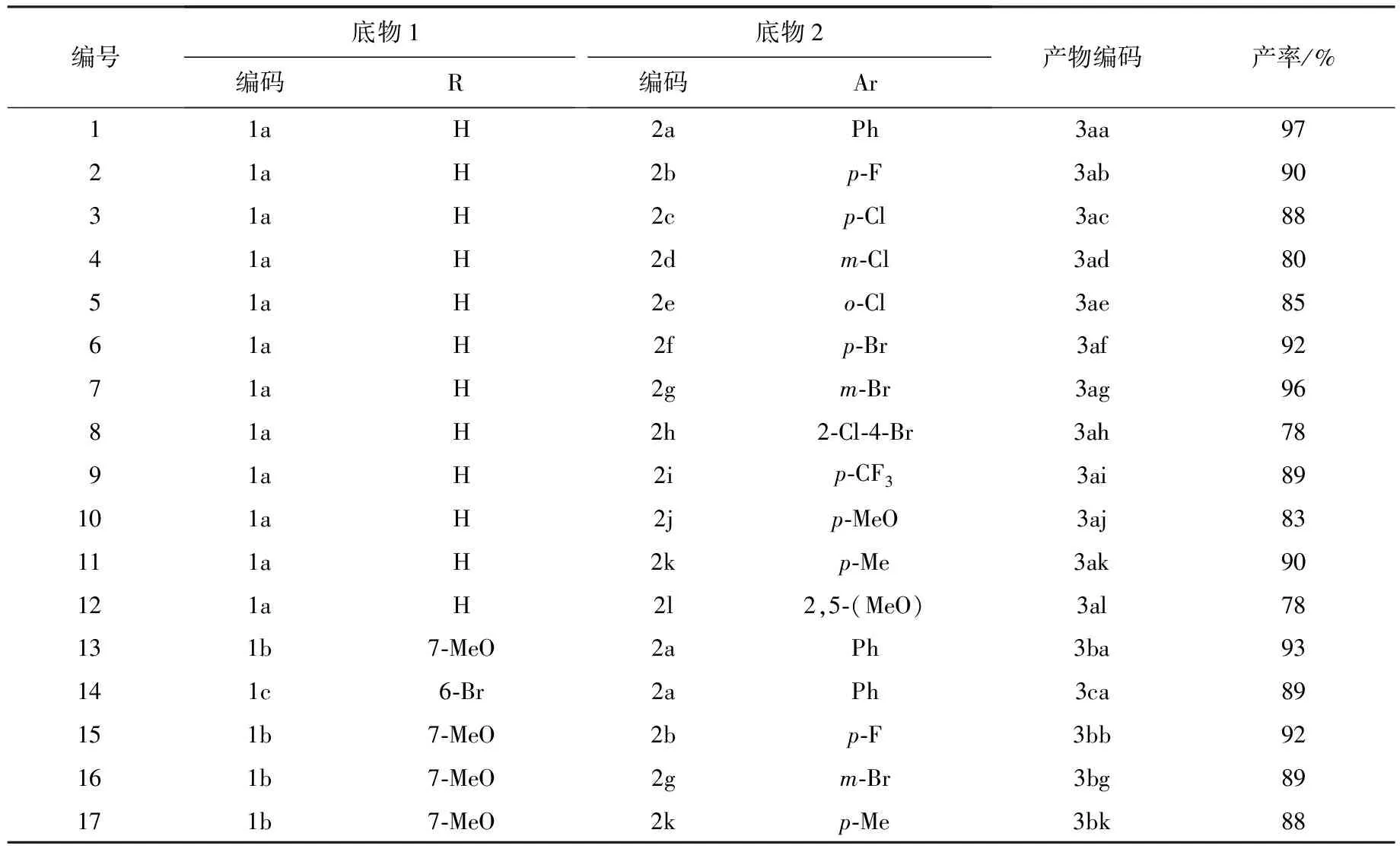
表3 优化条件下反应底物的扩展
2.3 产物的结构表征
1)3aa 红色固体,产率97%;熔点108~110 ℃(文献[12]:135.5 ℃);1H NMR(400 MHz,CDCl3)δ:7.92~7.86(m,2H),7.45(d,J=8.9 Hz,1H),7.36~7.28(m,6H),7.20~7.18(dd,J=7.4 Hz,J=1.9 Hz,2H),6.10(d,J=1.7 Hz,1H),5.32(s,1H);13C NMR(100 MHz,CDCl3)δ:156.3,138.0,131.5,130.9,129.7,129.5,129.1,128.5,127.7,127.6,124.6,123.1,118.4,112.6,111.9,55.4;高分辨质谱:计算值C18H13NO3+Na为314.078 8,测量值为314.077 5;IR(KBr)σ/cm-1:3 067,1 566,1 368,1 092,775,745,701.
2)3ab 红色固体,产率90%;熔点138~140 ℃(文献[12]:127 ℃);1H NMR(400 MHz,CDCl3)δ:7.94~7.89(m,2H),7.46~7.34(m,4H),7.18~7.15(m,2H),7.03(t,J=8.3 Hz,2H),6.07(s,1H),5.31(s,1H);13C NMR(100 MHz,CDCl3)δ:164.2,161.4,156.2,133.7,131.7,131.0,129.5,129.4,129.3,129.2,127.8,124.7,122.9,118.1,116.5,116.3,112.4,111.9,54.7;高分辨质谱:计算值C18H12FNO3+Na为332.069 3,测量值为332.068 6;IR(KBr)σ/cm-1:2 922,1 566,1 364,1 225,1 083,817,771.
3)3ac 红色固体,产率88%;熔点118~120 ℃;1H NMR(400 MHz,CDCl3)δ:7.94~7.88(m,2H),7.45(d,J=8.9 Hz,1H),7.39~7.37(m,2H),7.32~7.30(m,3H),7.14~7.12(m,2H),6.05(d,J=1.7 Hz,1H),5.29(s,1H);13C NMR(100 MHz,CDCl3)δ:156.4,136.5,134.3,131.8,130.9,129.7,129.5,129.3,129.0,127.9,124.8,122.9,117.6,112.2,112.0,54.8;高分辨质谱:计算值C18H12ClNO3+Na为348.039 8,测量值为348.039 8;IR(KBr)σ/cm-1:2 996,1 563,1 367,1 091,804,768,742.
4)3ad 红色固体,产率80%;熔点126~129 ℃;1H NMR(400 MHz,CDCl3)δ:7.96~7.89(m,2H),7.46(d,J=8.9 Hz,1H),7.43~7.39(m,2H),7.36~7.33(m,1H),7.31~7.29(m,2H),7.20(s,1H),7.10~7.08(m,1H),6.08(d,J=1.7 Hz,1H),5.29(s,1H);13C NMR(100 MHz,CDCl3)δ:139.9,135.3,131.9,131.0,130.8,129.5,129.3,128.9,128.0,127.8,125.9,124.8,122.9,117.6,112.1,112.0,55.0.
5)3ae 红色固体,产率85%;熔点116~118 ℃;1H NMR(400 MHz,CDCl3)δ:7.93~7.87(m,2H),7.53(d,J=8.0 Hz,1H),7.45~7.33(m,4H),7.26~7.22(m,1H),7.06(t,J=7.6 Hz,1H),6.63(d,J=7.5 Hz,1H),6.11(s,1H),5.87(s,1H);13C NMR(100 MHz,CDCl3)δ:156.6,135.1,133.7,131.7,131.0,130.3,129.8,129.5,129.2,128.0,127.8,124.6,123.0,118.3,111.9,51.1.
6)3af 红色固体,产率92%;熔点126~128 ℃;1H NMR(400 MHz,CDCl3)δ:7.94~7.92(m,2H),7.46(t,J=7.8 Hz,3H),7.40~7.38(m,2H),7.32~7.30(m,1H),7.07(d,J=8.1 Hz,2H),6.05(s,1H),5.28(s,1H);13C NMR(100 MHz,CDCl3)δ:156.3,136.9,132.6,131.8,131.0,129.4,129.4,129.2,127.9,124.8,122.9,122.6,117.7,112.1,111.9,54.8.
7)3ag 黑色固体,产率96%;熔点134~136 ℃;1H NMR(400 MHz,CDCl3)δ:7.94~7.87(dd,J=19.0 Hz,J=8.2 Hz,2H),7.72(d,J=7.8 Hz,1H),7.46~7.34(m,4H),7.18~7.08(m,2H),6.61(s,1H),6.10(s,1H),5.89(s,1H);13C NMR(100 MHz,CDCl3)δ:156.6,136.9,133.6,131.7,131.0,130.1,129.4,129.1,128.5,128.0,124.8,124.0,123.1,112.0,111.9,53.7.
8)3ah 黑色油状物,产率78%;1H NMR(400 MHz,CDCl3)δ:7.95~7.88(m,2H),7.72(d,J=1.9 Hz,1H),7.46~7.39(m,3H),7.31~7.29(m,1H),7.19(dd,J=8.4 Hz,J=1.9 Hz,1H),6.47(d,J=8.1 Hz,1H),6.07(d,J=1.3 Hz,1H),5.79(s,1H);13C NMR(100 MHz,CDCl3)δ:156.7,134.6,134.2,132.9,132.0,131.1,131.0,130.4,129.3,129.3,128.2,124.9,122.9,122.8,117.7,111.9,111.4,110.0,50.8.
9)3ai 红色固体,产率89%;熔点142~144 ℃;1H NMR(400 MHz,CDCl3)δ:7.99~7.89(m,2H),7.61(d,J=7.9 Hz,2H),7.47(d,J=8.9 Hz,1H),7.41~7.39(m,2H),7.34~7.29(m,3H),6.07(s,1H),5.38(s,1H);13C NMR(100 MHz,CDCl3)δ:156.5,132.1,131.0,129.5,129.3,128.2,128.1,126.6,126.5,124.9,122.8,117.5,112.0,111.9,55.0.
10)3aj 黄色固体,产率83%;熔点108~110 ℃;1H NMR(400 MHz,CDCl3)δ:7.90(d,J=8.9 Hz,2H),7.43(d,J=8.9 Hz,1H),7.36~7.35(m,3H),7.10~7.08(m,2H),6.90~6.75(m,2H),6.06(d,J=1.7 Hz,1H),5.26(s,1H),3.76(s,3H);13C NMR(100 MHz,CDCl3)δ:159.7,156.2,131.4,130.9,130.1,129.7,129.1,128.8,127.7,124.6,123.1,118.6,114.8,112.8,111.9,55.4,54.9.
11)3ak 红色固体,产率90%;熔点104~106 ℃;1H NMR(400 MHz,CDCl3)δ:7.92~7.86(m,2H),7.44(d,J=8.9 Hz,1H),7.37(d,J=1.6 Hz,3H),7.13(d,J=7.8 Hz,2H),7.07(d,J=7.9 Hz,2H),6.08(s,1H),5.28(s,1H),2.32(s,3H);13C NMR(100 MHz,CDCl3)δ:156.1,138.4,135.0,131.4,130.9,130.1,129.7,129.1,127.7,127.5,124.5,123.1,118.5,112.7,111.9,55.2,21.2.
12)3al 白色固体,产率78%;熔点108~110 ℃;1H NMR(400 MHz,CDCl3)δ:7.88~7.84(m,2H),7.43~7.33(m,4H),6.91(d,J=8.9 Hz,1H),6.79~6.76(m,1H),6.22(d,J=2.9 Hz,1H),6.14(d,J=1.8 Hz,1H),5.69(s,1H),3.92(s,3H),3.53(s,3H);13C NMR(100 MHz,CDCl3)δ:156.5,153.8,151.0,131.2,130.8,129.9,129.0,127.6,127.0,124.4,123.2,118.2,115.3,113.2,112.8,111.8,111.8,56.2,55.6,48.7.
13)3ba 红色固体,产率93%;熔点124~126 ℃(文献[12]:123 ℃);1H NMR(400 MHz,CDCl3)δ:7.83~7.75(m,2H),7.36~7.28(m,4H),7.22~7.20(m,2H),7.01(d,J=9.0 Hz,1H),6.58(s,1H),6.11(d,J=1.7 Hz,1H),5.25(s,1H),3.69(s,3H);13C NMR(100 MHz,CDCl3)δ:158.9,156.9,137.8,131.2,131.1,130.7,129.5,128.5,127.6,126.3,117.5,117.1,112.6,109.2,101.6,55.5,55.3.
14)3ca 红色固体,产率89%;熔点104~106 ℃(文献[12]:128 ℃);1H NMR(400 MHz,CDCl3)δ:8.03(d,J=1.6 Hz,1H),7.82(d,J=8.9 Hz,1H),7.47~7.41(m,2H),7.34~7.32(m,3H),7.25~7.21(m,1H),7.17~7.14(m,2H),6.10(d,J=1.6 Hz,1H),5.29(s,1H);13C NMR(100 MHz,CDCl3)δ:156.5,137.7,132.0,131.1,131.1,130.7,129.6,128.7,128.1,127.6,124.7,118.7,118.4,113.1,112.4,55.3.
15)3bb 棕色固体,产率92%;熔点132~134 ℃;1H NMR(400 MHz,CDCl3)δ:7.85~7.77(m,2H),7.30~7.26(m,1H),7.20~7.17(m,2H),7.06~7.01(m,3H),6.54(s,1H),6.06(s,1H),5.25(s,1H),3.70(s,3H);13C NMR(100 MHz,CDCl3)δ:158.7,156.5,131.4,131.0,130.8,129.4,129.3,126.3,117.1,116.6,116.4,112.4,109.3,101.6,55.3,54.7.
16)3bg 黑色固体,产率89%;熔点158~160 ℃;1H NMR(400 MHz,CDCl3)δ:7.82(d,J=8.8 Hz,1H),7.76~7.70(m,2H),7.28(d,J=8.8 Hz,1H),7.17~7.15(m,2H),7.02~7.00(m,1H),6.73~6.67(m,2H),6.12(s,1H),5.85(s,1H),3.75(s,3H);13C NMR(100 MHz,CDCl3)δ:159.2,156.8,137.1,133.4,131.3,130.8,130.6,130.0,129.3,128.7,126.3,123.8,117.4,112.0,110.1,109.2,101.5,77.4,77.1,76.8,55.4,53.5.
17)3bk 白色固体,产率88%;熔点116~120 ℃;1H NMR(400 MHz,CDCl3)δ:7.82~7.74(m,2H),7.28~7.25(m,1H),7.17~7.05(m,4H),7.01~6.99(m,1H),6.60(d,J=2.4 Hz,1H),6.08(d,J=1.7 Hz,1H),5.21(s,1H),3.70(s,3H),2.32(s,3H);13C NMR(100 MHz,CDCl3)δ:158.9,156.7,138.3,134.8,131.1,130.7,130.1,127.5,126.3,117.7,117.0,112.8,109.2,101.7,55.3,55.2,21.2.
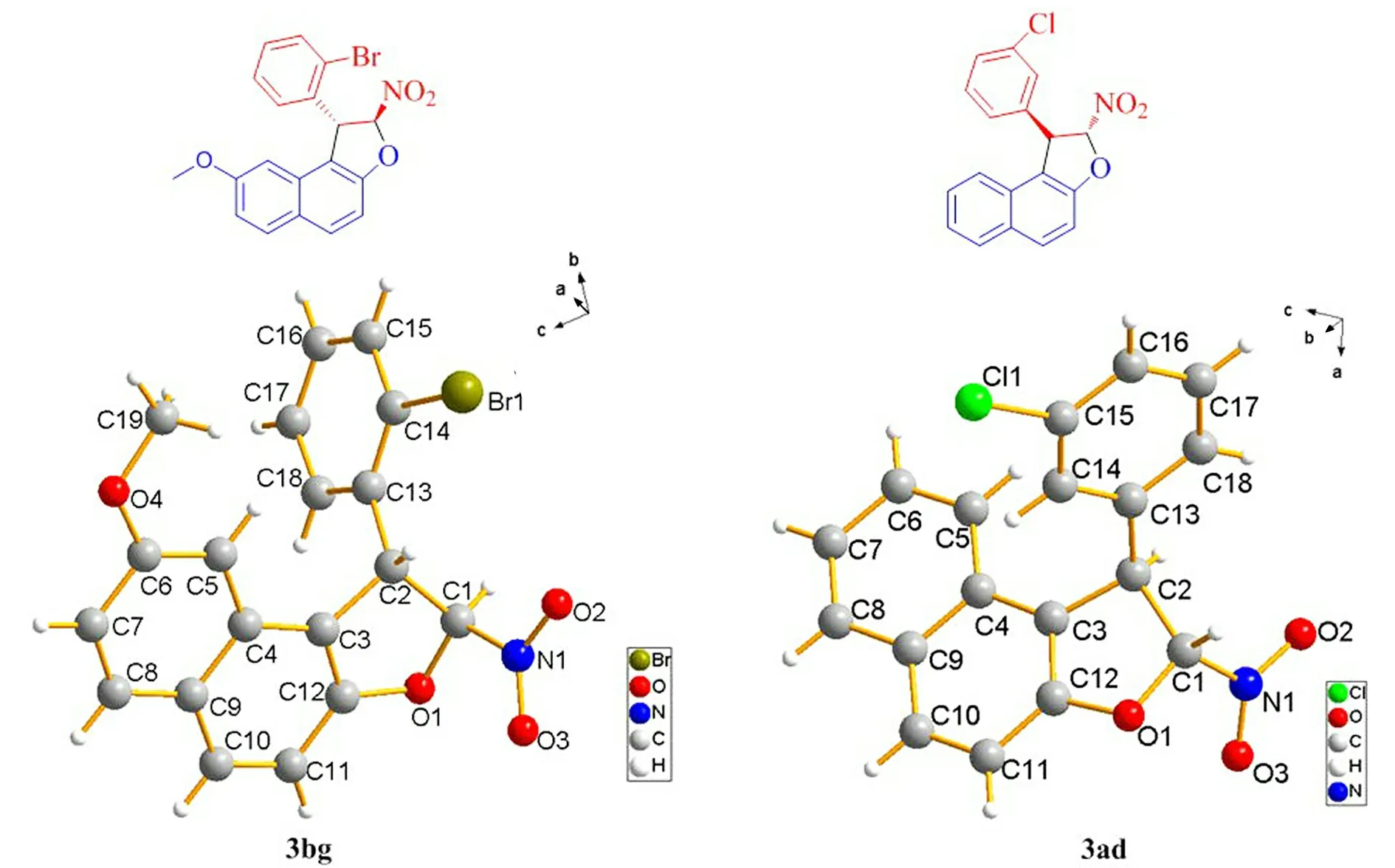
图3 3ad,3bg的分子结构
2.4 构型的确定
通过对化合物3ad和3bg单晶的培养,根据X射线衍射数据确定了这两个化合物的相对构型(见图3),相关的晶体学数据列于表4.
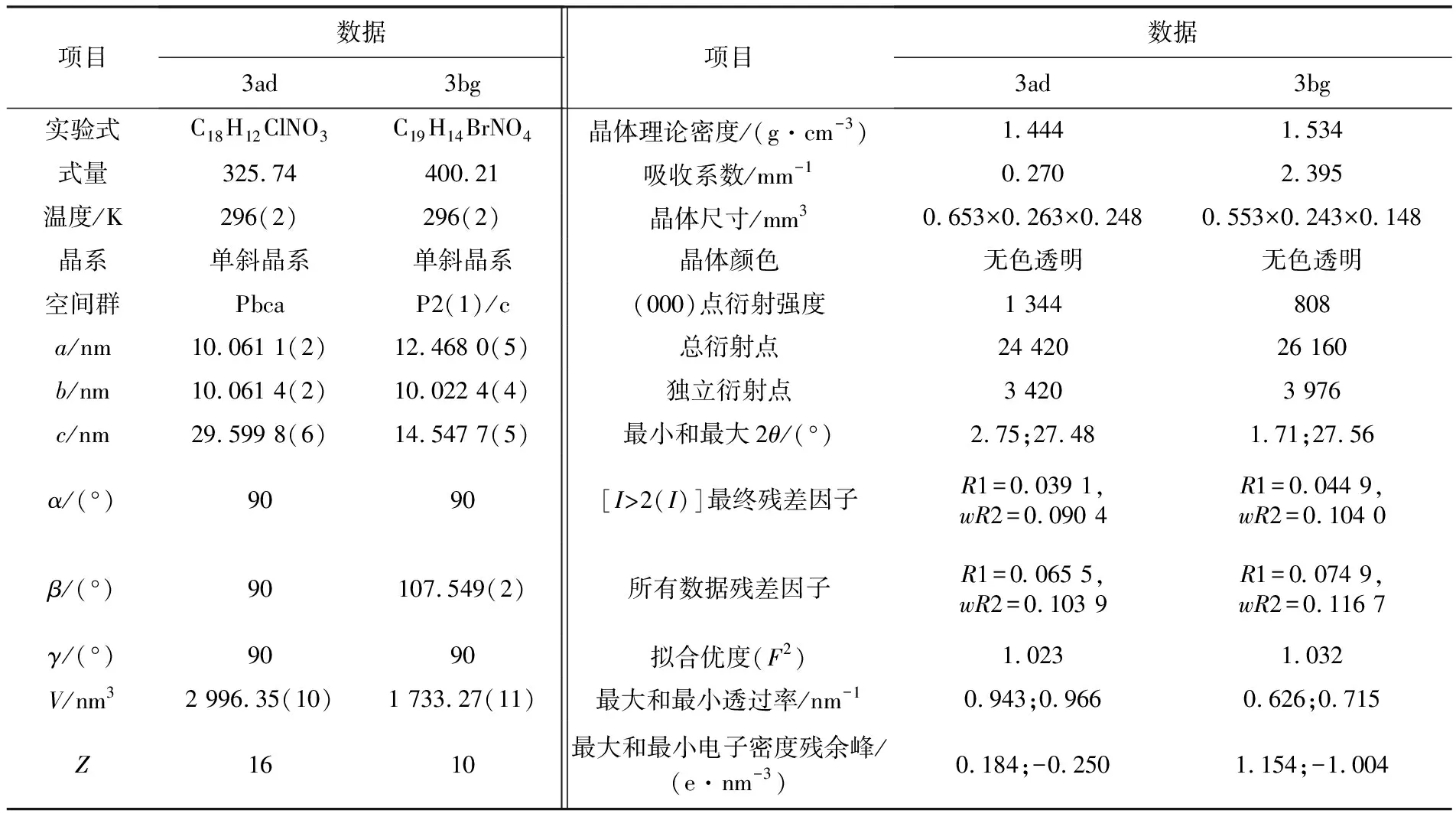
表4 化合物3ad和3bg的晶体学数据
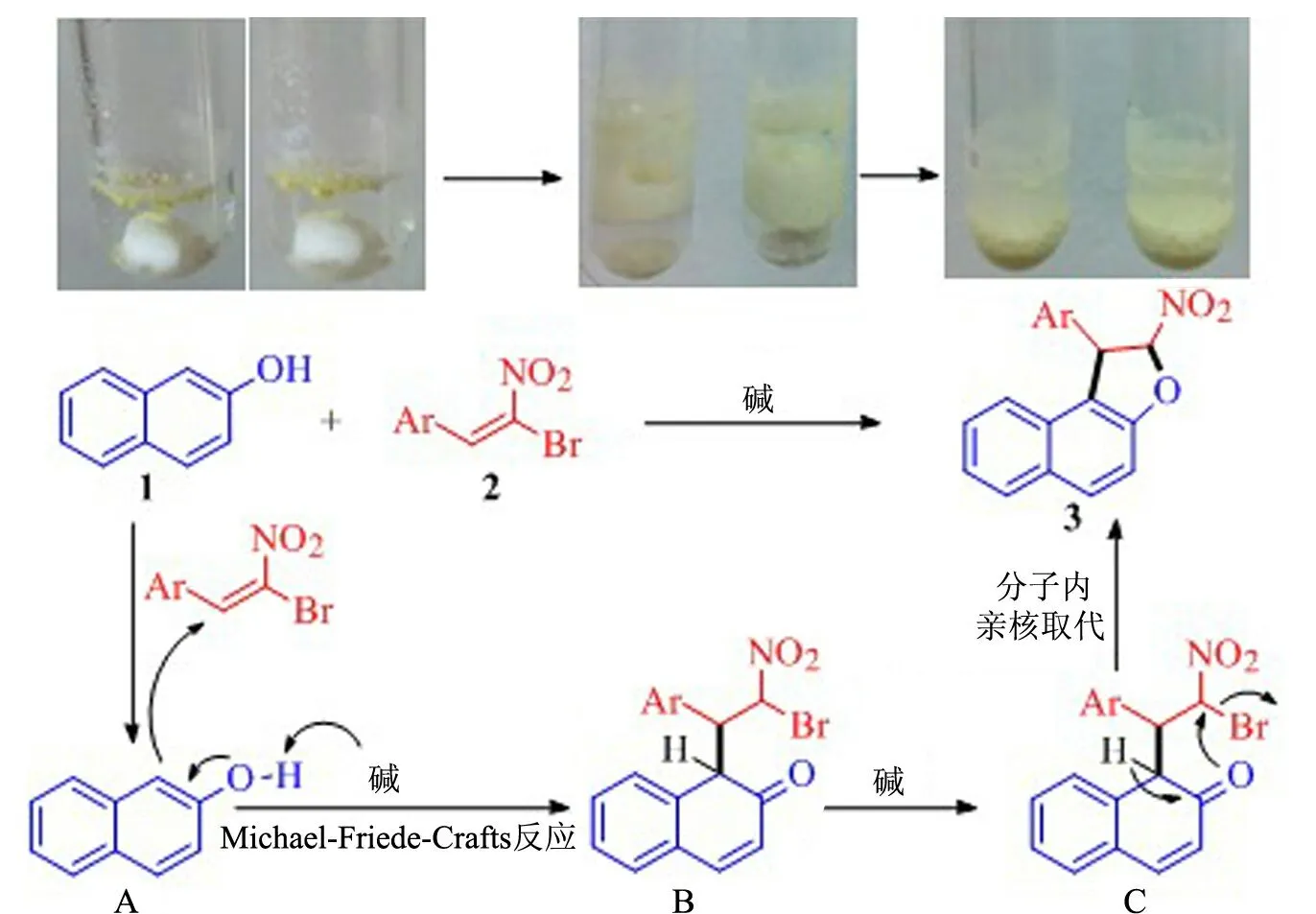
图4 反应历程
2.5 可能的机理
如图4所示:首先,K2CO3溶解在水里,在碱性水相条件下,亲核试剂β-萘酚在相界面处脱去质子与亲电试剂溴代硝基烯烃发生Michael-Friedel-Crafts反应,得到第一步的加成产物;然后,中间体烯醇的氧原子分子内亲核进攻溴取代的碳原子,环合生成取代的1,2-二氢呋喃化合物,并脱去1分子HBr.
3 结 论
本实验以水或乙醇为反应介质,不使用相转移催化剂,仅在促进剂K2CO3的催化下,通过2-萘酚与溴代硝基烯烃的Michael-Friedel-Crafts/alkylation串联反应,高收率地合成了一系列的1,2-二氢萘并呋喃衍生物.该方法操作简单,反应条件温和,对环境污染小,原料成本低,对萘并呋喃衍生物的合成具有较好的应用前景.
参考文献:
[1]Danheiser R L,Stoner E J,Kojama H,et al.A new synthesis of substituted furans[J].J Am Chem Soc,1989,111(12):4407-4413.
[2]丁敏.生物活性苯并呋喃类和8-5′新木脂素类化合物的合成方法研究[D].长沙:湖南大学化学化工学院,2007.
[3]Li Qubo,Zhou Feiting,Liu Zhenggeng,et al.K2CO3-promoted domino reactions:construction of functionalized 2,3-dihydrobenzofurans and clofibrate analogues[J].J Org Chem,2011,76(17):7222-7228.
[4]廖开胜.一锅法合成以S—S键结合的氮杂环丁烷及萘并呋喃衍生物的方法学研究[D].芜湖:安徽师范大学化学与材料科学学院,2011.
[5]陶志福,钱旭红,宋恭华.一种新型呋喃香豆素类似物——呋喃并萘并吡喃酮的合成及DNA嵌入活性[J].有机化学,1997,17(5):428-432.
[6]Cimino G D,Gamper H B,Isaacs S T.Psoralens as photoactive probes of nucleic acid structure and function:organic chemistry,photochemistry,and biochemistry[J].Annu Rev Biochem,1985,54(1):1151-1193.
[7]Piloto A M,Costa S P G,Goncalves M S T.A naphtho[2,1-b]furan as a new fluorescent label:synthesis and spectral characterisation[J].Tetrahedron Lett,2005,46(28):4757-4760.
[8]赵喜芝,李晓.水——有机化学中的绿色介质[J].化学工程师,2004,17(2):37-38.
[9]隋岩,朱敏,付雯,等.水相不对称氢化及转移氢化反应研究进展[J].化学通报,2008,71(8):609-615.
[10]Li Ping,Wang Ting,Xie Jianwu,et al.Efficient and mild synthesis of functionalized 2,3-dihydrofuran derivatives via domino reaction in water[J].Tetrahedron Letters,2011,52(18):2379-2382.
[11]Fan Liping,Li Ping,Li Xinsheng,et al.Facile domino access to chiral mono-,bi-,and tricyclic 2,3-dihydrofurans[J].J Org Chem,2010,75(24):8716-8719.
[12]Carlos J B,Francisco E,Carmen N R,et al.Asymmetric synthesis oftrans-dihydroarylfurans in a Friedel-Crafts/substitution domino reaction under squaramide catalysis[J].Chem Commun,2013,49(20):2001-2003.
