双酚A暴露对成年小鼠焦虑行为的影响*
2014-08-06徐晓虹董芳妮
徐晓虹, 王 喻, 董芳妮
(浙江师范大学 化学与生命科学学院,浙江 金华 321004)
双酚A(bisphenol-A,BPA)是一种广泛应用于环氧树脂、聚碳酸酯、酚醛树脂等工业生产和饮料容器、食品包装等日常生活塑料制品的典型的环境内分泌干扰物,具有弱雌激素和抗雄激素活性.由于性激素在神经发育及其性别分化中的重要作用,近年来关于BPA对脑和行为发育的影响受到人们的关注,发现发育期BPA暴露可影响动物成年后的焦虑和抑郁、学习记忆等多种神经行为[1-3].前期研究发现,妊娠期、哺乳期、青春期BPA暴露均可影响仔鼠成年后的焦虑和抑郁样行为,但不同发育阶段BPA暴露对焦虑和抑郁行为的影响有性别差异[4-5].另外,性激素也参与调节成年动物的脑功能活动,且成年动物暴露于BPA环境的时间更长.因此,BPA对成年动物脑和行为的影响已引起人们的重视.Kim等[6]发现青年雄性小鼠BPA暴露2周后空间记忆受损;文献[7]报道BPA在损伤雄性成年大鼠物体识别和空间位置视觉记忆的同时降低海马树突棘密度.文献[8]研究发现,BPA慢性暴露选择性损伤成年雄鼠的记忆行为,同时降低海马突触密度.焦虑行为是对脑内性激素改变极为敏感的情感行为[9].有研究表明,女性患焦虑症的几率是男性的2倍,尤其女性到了绝经期之后,由于雌激素水平下降焦虑情绪会加重,而雌激素补充可以减缓老年雌性小鼠的焦虑样状态[10].因此,推测长期暴露于环境内分泌干扰物BPA可能影响成年小鼠的焦虑行为.本文对此进行了研究.
1 材料和方法
1.1 实验动物及分组
清洁级ICR小鼠,雌雄各半,体质量25~35 g,由浙江省金华市药品检验所提供.实验前饲养1周以适应环境,自由进食饮水,饲养环境昼夜12 h交替,室温22~25 ℃,湿度50%~60%.小鼠雌雄分笼饲养,随机分为BPA暴露组(0.04,0.4,4和40 mg/(kg·d))和对照组(V(菜籽油)∶V(乙醇)=9∶1).BPA(含量≥99.5%,天津市科密欧化学试剂有限公司)用菜籽油-乙醇(V(菜籽油)∶V(乙醇)=9∶1)溶解,每天灌胃染毒持续12周,灌胃体积为0.1 mL(以体质量30 g计).每天观察动物的饮食和活动情况,注意小鼠的皮肤、被毛、眼睛、呼吸及行为等的变化.每周称体质量,根据体质量变化调整给药体积.染毒结束3 d后进行检测实验.
1.2 性激素含量测定
小鼠染毒结束3 d后,每组随机取8只小鼠眼眶采血1 mL左右,4 ℃静止30 min,之后3 000 r/min离心5 min,收集血清.小鼠断头取脑,分离大脑,称质量,按1∶10的比例加入生理盐水,剪碎,匀浆,4 ℃ 5 000 r/min离心6 min,取上清.使用放射免疫分析法检测雌、雄小鼠血清和脑内雌二醇和睾酮的含量.
1.3 行为测试
在BPA暴露结束后3 d,每组随机取12只小鼠,在安静的行为检测室依次进行行为检测.
1.3.1 旷场行为检测

1.3.2 明暗箱行为检测
实验装置由一黑色封闭箱(25 cm×25 cm×35 cm)和一白色敞开箱(25 cm×25 cm×35 cm)组成,两箱之间有一穿梭孔(5 cm×7 cm).将小鼠放入明箱中央,记录小鼠5 min内在两箱间的穿梭次数,以及在明、暗箱内的停留时间.穿梭次数反映小鼠的活动性;两箱停留时间可反映其焦虑状态[12].每只小鼠检测后清理箱内残留物及气味,以免影响下一只小鼠的行为.
1.3.3 镜子迷宫行为检测
镜子迷宫是由一四面装有镜子的镜箱区(30 cm×25 cm×30 cm)和一不安装镜子的非镜箱区(30 cm×5 cm×30 cm)组成的正方形敞箱(30 cm×30 cm×30 cm),镜箱与非镜箱之间有一直径为5 cm的通道供小鼠穿行.测试时将小鼠放入镜箱区中央,记录小鼠5 min内在镜箱区与非镜箱区之间的穿梭次数,以及在镜箱区的停留时间.镜箱区与非镜箱区穿梭次数可反映小鼠的活动性;而镜箱区停留时间作为小鼠焦虑程度的行为参数[13].每次测试结束后清理箱体.
1.3.4 高架十字迷宫行为检测
高架十字迷宫由2个相对的开放臂(30 cm×5 cm)、2个相对的封闭臂(30 cm×5 cm×15 cm)和1个连接4臂的中央平台(5 cm×5 cm)组成,距地面50 cm.测试时小鼠头朝开放臂放入中央平台区,记录小鼠在迷宫中5 min的行为表现.为防止小鼠在迷宫中留下气味干扰实验结果,每只小鼠测试后用75%乙醇将迷宫擦洗l遍.各项指标由小动物行为分析系统(TSE System GmbH,德国)记录.开放臂进入次数减少、停留时间缩短,或封闭臂停留时间延长,表明动物焦虑状态增加;中央区探头次数增多表明动物焦虑状态弱,而探究欲望增强;封闭臂进入次数或开放臂和封闭臂的总进入次数增加,表明动物活动性增加[14].
1.4 数据处理
2 结 果
2.1 体质量、生殖器官质量/体质量
10周龄的小鼠体质量各处理组和性别之间均无统计学差异.BPA暴露12周后,体质量出现显著的性别差异(F(1,118)=3.509,P=0.01),雄鼠体质量显著高于雌鼠(P<0.01).BPA暴露对小鼠体质量的影响见图1.BPA暴露对雌、雄鼠生殖器官质量/体质量没有显著的影响(见图2).
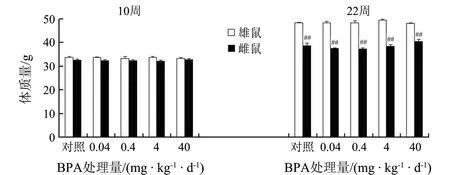
##表示与同处理雄性比较P<0.01图1 BPA暴露对成年小鼠体质量的影响(n=12)
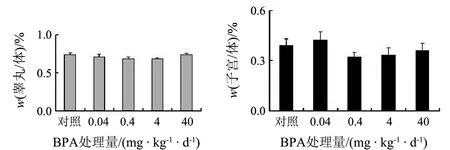
图2 BPA暴露12周对成年小鼠脏器系数的影响(n=12 )
2.2 血清和脑内性激素含量
成年期BPA暴露明显降低雄鼠脑和血清内的睾酮水平,特别是0.4 mg/(kg·d)BPA组血清中睾酮含量显著低于对照组(P<0.05),0.04~4 mg/(kg·d)BPA组脑内睾酮含量显著低于对照组(P<0.05);但对雌鼠脑和血清中雌二醇含量均没有影响.说明长期BPA暴露可降低雄鼠脑和血清中的睾酮水平(见图3).
2.3 行为学检测
2.3.1 旷场行为
双因素方差分析显示,BPA暴露×性别的交互作用不影响小鼠在旷场中的跑动格数、站立次数、理毛次数和中央区停留时间,BPA暴露因素显著影响小鼠的跑动格数(F(4,115)=3.858,P=0.006),而性别因素显著影响小鼠的站立次数(F(1,118)=83.712,P<0.001)、理毛次数(F(1,118)=57.321,P<0.001)和中央区停留时间(F(1,118)=44.363,P<0.001).正常雄鼠表现出比雌鼠更多的站立次数(P<0.01)、理毛次数(P<0.05)和中央区停留时间(P<0.05),表明雄鼠比雌鼠具有更强的探究欲望和更低的焦虑状态;然而,0.04和0.4 mg/(kg·d)BPA暴露消除了小鼠中央区停留时间的性别差异(见表1).
表明长期BPA暴露可以消除小鼠焦虑状态的性别差异.
2.3.2 明暗箱行为
BPA暴露×性别的交互作用、BPA暴露因素及性别因素均显著影响小鼠在明暗箱的穿梭次数(F(4,110)=3.454,P=0.011;F(4,115)=4.88,P=0.001;F(1,118)=5.699,P=0.019).
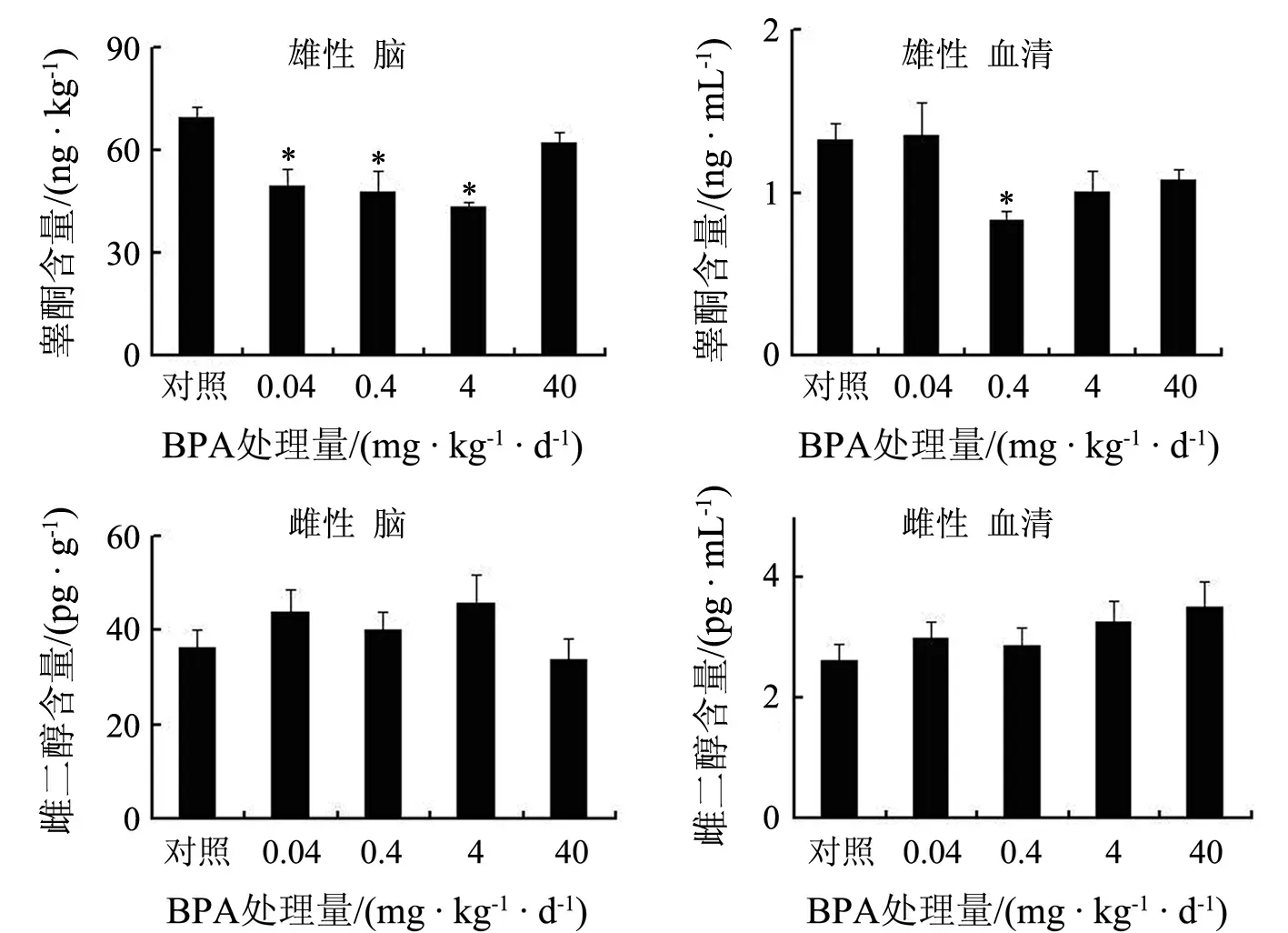
*表示与同性别对照组相比P<0.05图3 BPA暴露12周对成年小鼠血清和脑内性激素含量的影响(n=8)
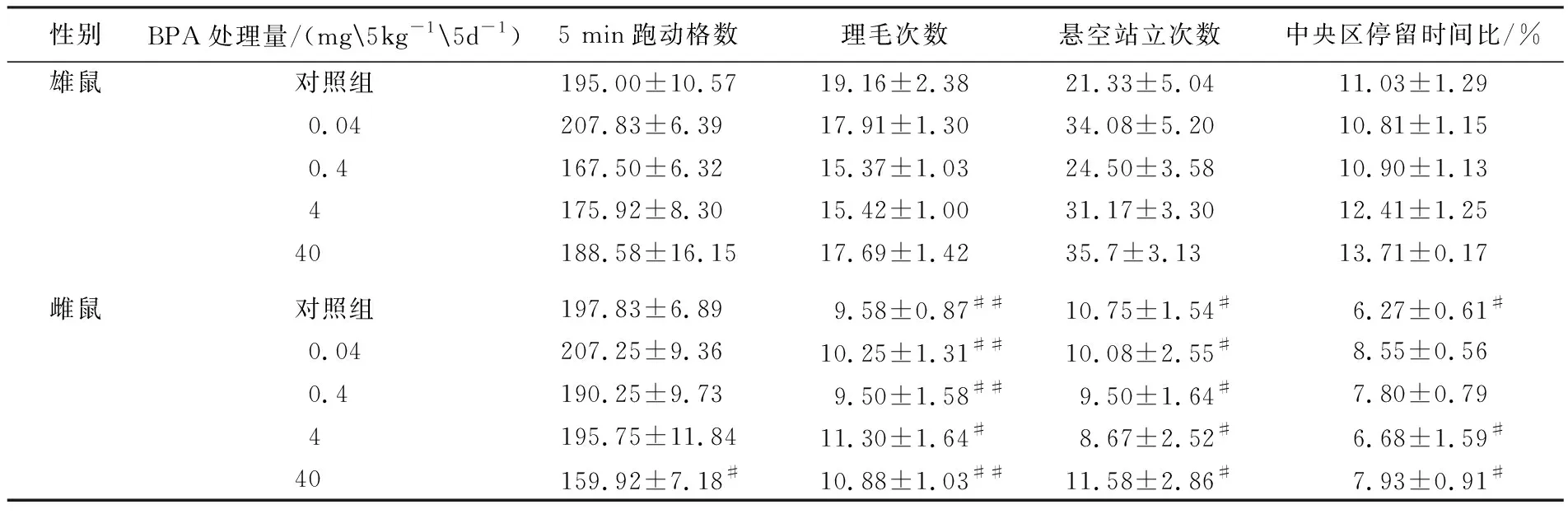
性别BPA处理量/(mg5kg-15d-1)5 min跑动格数理毛次数悬空站立次数中央区停留时间比/%雄鼠对照组195.00±10.5719.16±2.3821.33±5.0411.03±1.290.04207.83±6.3917.91±1.3034.08±5.2010.81±1.150.4167.50±6.3215.37±1.0324.50±3.5810.90±1.134175.92±8.3015.42±1.0031.17±3.3012.41±1.2540188.58±16.1517.69±1.42 35.7±3.1313.71±0.17雌鼠对照组197.83±6.899.58±0.87##10.75±1.54#6.27±0.61#0.04207.25±9.3610.25±1.31##10.08±2.55#8.55±0.560.4190.25±9.739.50±1.58##9.50±1.64#7.80±0.794195.75±11.8411.30±1.64#8.67±2.52#6.68±1.59#40159.92±7.18#10.88±1.03##11.58±2.86#7.93±0.91#
注:与雄性相比,#表示P<0.05;##表示P<0.01.各处理组与同性别对照组相比无显著统计学差异.
如图4所示:BPA暴露主要影响雄鼠的穿梭次数,与同性别对照组相比,4 mg/(kg·d)BPA组雄鼠的穿梭次数显著降低(P<0.05);0.4和4 mg/(kg·d)BPA组穿梭次数的性别差异极小.表明BPA减弱了雄鼠的运动活性.
小鼠在明箱的停留时间表现出显著的性别差异(F(1,118)=61.056,P<0.001),雄鼠在明箱的停留时间明显高于雌鼠(P<0.05),即雌鼠表现出更高的焦虑样状态,BPA暴露对其没有明显的作用(见图4).
2.3.3 镜子迷宫实验
BPA暴露×性别的交互作用对小鼠在镜子迷宫镜区停留时间和镜区与非镜区的穿梭次数均没有显著影响.BPA暴露不影响小鼠的镜区停留时间,但显著影响镜区与非镜区的穿梭次数(F(4,115)=5.914,P<0.001).与同性别对照组相比,0.04 mg/(kg·d)BPA显著增加了雌鼠的穿梭次数(P<0.05),提示BPA暴露可提高雌鼠的活动性.性别因素显著影响小鼠镜区停留时间(F(1,118)=3.965,P=0.049),但不影响镜区与非镜区的穿梭次数(见图5).
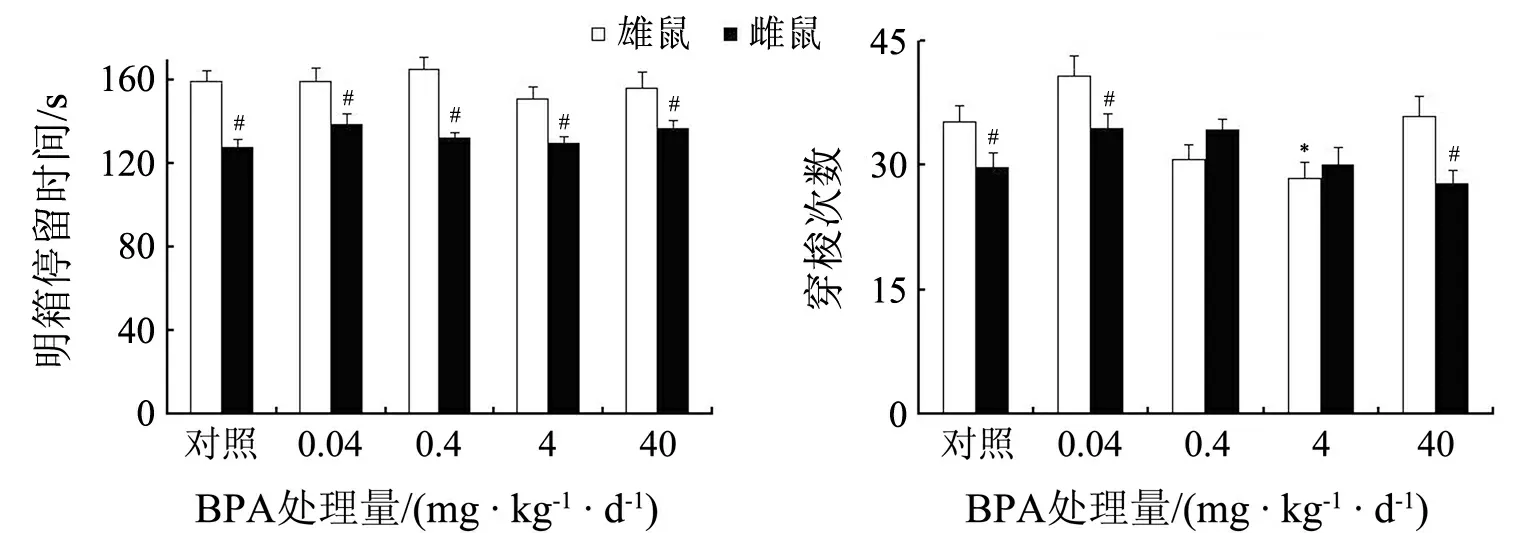
*表示与同性别对照组相比P<0.05;#表示与同处理雄性相比P<0.05
图4 BPA暴露对成年小鼠明暗箱行为的影响(n=12)
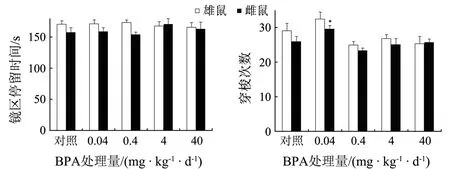
*表示与同性别对照组相比P<0.05
图5 BPA暴露对成年小鼠镜子迷宫行为的影响(n=12)
2.3.4 高架十字迷宫实验
双因素方差分析表明,BPA暴露×性别交互作用显著影响小鼠在高架十字迷宫开放臂的进入次数(F(4,110)=5.113,P=0.01)和开放臂停留时间(F(4,110)=7.213,P<0.001).性别因素显著影响小鼠进入开放臂的次数(F(1,118)=6.104,P=0.015)、封闭臂停留时间(F(1,118)=33.011,P<0.001)和在中央区的抬头次数(F(1,118)=5.46,P=0.021).正常小鼠开放臂停留时间和进入次数具有性别差异(P<0.05),表现为雄鼠高于雌鼠,表明正常雌鼠比雄鼠表现出更强的焦虑样状态.然而,BPA暴露减少了雄鼠却增加了雌鼠进入开放臂的次数和开放臂停留时间,特别是0.4~40 mg/(kg·d)BPA暴露后,与同性别对照组间出现显著性差异(P<0.01和P<0.05);同时,BPA微弱增加雄鼠而减少雌鼠封闭臂停留时间,诱导该参数的性别差异(P<0.05).这些结果提示,长期BPA暴露可增强雄鼠却减弱雌鼠的焦虑样状态,并因此消除其性别差异,甚至逆转雄鼠高于雌鼠焦虑状态的性别差异(见表2).
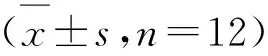
表2 BPA暴露对成年小鼠高架十字迷宫行为的影响
注:与同性别对照组相比,*表示P<0.05,**表示P<0.01;与雄性相比,#表示P<0.05,##表示P<0.01.
BPA暴露×性别交互作用、BPA暴露或性别因素均显著影响小鼠在高架十字迷宫中开放臂和封闭臂的总进入次数(F(4,110)=4.791,P=0.001;F(4,115)=3.275,P=0.014;F(1,118)=7.618,P=0.007).同时,BPA暴露因素显著影响小鼠的封闭臂进入次数(F(4,115)=3.673,P=0.008).正常小鼠开放臂和封闭臂总进入次数表现出雄鼠高于雌鼠的性别差异(P<0.05),表明正常雄鼠比雌鼠具有更高的活动性.但是,BPA暴露显著减少了雄鼠进入开放臂和封闭臂的总次数,特别是0.4和40 mg/(kg·d)BPA暴露组与同性别对照组间出现显著性差异(P<0.05),提示长期BPA暴露可抑制雄鼠的活动性,并因此消除其性别差异(见表2).
3 讨 论
焦虑行为是一种受性激素调节的情感行为,体内正常的雌激素或雄激素水平是维持雌性或雄性动物良好情绪状态的基础.本研究首次报道,长期暴露于低剂量(0.04~40 mg/(kg·d))双酚A(BPA)可性别特异性地影响小鼠的焦虑样行为,表现为加剧成年雄鼠的焦虑程度,减轻雌鼠的焦虑样状态,并消除甚至反向诱导这些行为的性别差异.许多研究证实了人和动物焦虑行为的性别差异,一般女性产生焦虑情绪的几率大于男性.本研究采用多种模型检测小鼠不同诱因导致的焦虑样状态,也发现了雌鼠的焦虑情绪高于雄鼠的性别差异.高架十字迷宫检测动物对新异环境的探究意愿和对高悬敞开臂恐惧而产生的焦虑情绪;镜子迷宫和明暗箱检测动物对镜中自我影像或新异环境的好奇和畏惧而产生的焦虑情绪;旷场行为检测动物对新异环境的探究意愿和畏惧心理而产生的焦虑情绪,理毛即为动物在冲突处境下无所适从而表现出的一种转移行为[15].本研究发现,BPA主要影响小鼠在高架十字迷宫和旷场中的焦虑样状态,表现为显著增加雌鼠而减少雄鼠的开放臂进入次数和停留时间,BPA(0.4~4 mg/(kg·d))消除了小鼠在旷场中央区停留时间的性别差异.同时,明暗箱、镜子迷宫和高架十字迷宫还检测到BPA减少雄鼠的活动性,这与BPA增加雄鼠的焦虑状态相符,因为一般焦虑状态加剧的动物往往表现出活动减少.目前关于成年期BPA暴露对焦虑行为影响的研究很少.鉴于性激素对脑发育及其性别分化的重要作用,许多研究均聚焦在围生期母体BPA暴露对子代成年后焦虑行为的影响,其中对雄性仔鼠的研究较多,发现无论妊娠期、哺乳期还是围生期BPA暴露,成年后的雄性仔鼠在高架十字迷宫、明暗箱或旷场行为中几乎都表现出加重的焦虑样状态[4,16-17];Matsuda等[18]发现围生期BPA暴露加剧雄性仔鼠成年后的焦虑样状态,但对雌鼠没有影响;文献[17,19]高架十字迷宫行为检测结果表明,围生期、出生早期、青春期BPA暴露加剧成年后雄性仔鼠却减缓雌性仔鼠的焦虑样状态.但洪星等[5]发现,妊娠期或哺乳期母体BPA暴露的雌/雄仔鼠成年后均表现出加重的焦虑样状态.这些结果提示,长期BPA暴露对小鼠焦虑状态的影响具有性别特异性,雄鼠对BPA更敏感,无论什么时期暴露均可对其焦虑行为产生负性的远期影响;而BPA对雌鼠的焦虑样行为可能因暴露时期和剂量不同而产生不同的作用.本研究发现,BPA暴露显著降低雄鼠脑和血清中的睾酮水平,但雌鼠血清和脑内的雌二醇水平没有明显变化.这一发现与最近来自人群的研究相一致,即暴露于高浓度BPA的男性血清中游离睾酮水平下降[20].睾酮对于雄性动物脑功能的调节作用与雌激素对雌性动物的作用一样重要.睾酮可正向调节雄性动物的情绪反应,长期睾酮不足的雄鼠表现出抑郁和活动性减弱,而补充睾酮可以缓解性腺摘除小鼠的抑郁程度[21].文献[22]发现BPA也作用于雄激素受体产生抗雄激素作用.因此,BPA对雄鼠的促焦虑作用可能与其抗雄激素作用有关.雌激素调控认知和情绪反应主要通过雌激素β受体(ERβ)介导[23].例如,雌激素和ERβ激动剂DPN均可增加卵巢摘除雌鼠在高架十字迷宫开放臂的进入次数和停留时间,表现出抗焦虑作用[24].另外,BPA还可表现出拟雌激素活性.例如:体外BPA单独暴露可增加树突丝运动性和密度[25];胚胎期BPA暴露剂量依赖性地增加新生鼠浦肯野氏细胞树突分支的生长[26].本研究中BPA对雄鼠脑和血清中睾酮水平和雌鼠在镜子迷宫中的穿梭频率表现出低剂量抑制作用,而高剂量却没有影响,证实了低剂量环境内分泌干扰物剂量效应的非线性作用关系.
综上所述,长期低剂量BPA暴露可性别特异性地影响成年小鼠的焦虑行为,这可能和BPA的拟雌激素和抗雄激素活性有关.因此,笔者下一步将在这些方面进一步深入探讨BPA影响小鼠焦虑情绪的可能机制.
参考文献:
[1]Jones B A,Watson N V.Perinatal BPA exposure demasculinizes males in measures of affect but has no effect on water maze learning in adulthood[J].Horm Behav,2012,61(4):605-610.
[2]Gonalves C R,Cunha R W,Barros D M,et al.Effects of prenatal and postnatal exposure to a low dose of bisphenol A on behavior and memory in rats[J].Environ Toxicol Pharmacol,2010,30(2):195-201.
[3]田栋,徐晓虹,洪星,等.成年期双酚A暴露对小鼠行为的影响[J].心理学报,2011,43(5):534-543.
[4]Cox K H,Gatewood J D,Howeth C,et al.Gestational exposure to bisphenol A and cross-fostering affect behaviors in juvenile mice[J].Horm Behav,2010,58(5):754-761.
[5]洪星,徐晓虹,杨宇杰,等.生命早期双酚A 暴露对子代成年小鼠焦虑和抑郁行为的影响及其神经机制[J].心理学报,2012,44(9):1167-1179.
[6]Kim M E,Park H R,Gong E J,et al.Exposure to bisphenol A appears to impair hippocampal neurogenesis and spatial learning and memory[J].Food Chem Toxicol,2011,49(12):3383-3389.
[7]Eilam-Stock T,Serrano P,Frankfurt M,et al.Bisphenol-A impairs memory and reduces dendritic spine density in adult male rats[J].Behav Neurosci,2012,126(1):175-185.
[8]刘幸毅,徐晓虹,张勤,等.环境雌激素双酚A对成年小鼠学习记忆和突触结构的影响[J].心理学报,2013,45(9):1-12.
[9]Ter Horst G J.Estrogen in the limbic system[J].Vitam Horm,2010,82:319-338.
[10]Walf A A,Frye C A.Estradiol reduces anxiety- and depression-like behavior of aged female mice[J].Physiology Behavior,2010,99(2):169-174.
[11]Gioiosa L,Parmigiani S,Vom Saal F S,et al.The effects of bisphenol A on emotional behavior depend upon the timing of exposure,age and gender in mice[J].Horm Behav,2013,63(4):598-605.
[12]Henderson N D,Turri M G,DeFries J C,et al.QTL analysis of multiple behavioral measures of anxiety in mice[J].Behav Genet,2004,34(3):267-293.
[13]Luo Guangying,Wei Ruifen,Niu Ruiyan,et al.Pubertal exposure to bisphenol A increases anxiety-like behavior and decreases acetylcholinesterase activity of hippocampus in adult male mice[J].Food Chem Toxicol,2013,60:177-180.
[14]Neufeld K M,Kang N,Bienenstock J,et al.Reduced anxiety-like behavior and central neurochemical change in germ-free mice[J].Neurogastroenterol Motil,2011,23(3):255-264.
[15]Frye C A,Sumida K,Dudek B C,et al.Progesterone′s effects to reduce anxiety behavior of aged mice do not require actions via intracellular progestin receptors[J].Psychopharmacology(Berl),2006,186(3):312-322.
[16]Patisaul H B,Sullivan A W,Radford M E,et al.Anxiogenic effects of developmental bisphenol A exposure are associated with gene expression changes in the juvenile rat amygdala and mitigated by soy[J].PLoS One,2012,7(9):e43890.
[17]Fujimoto T,Kubo K,Nishikawa Y,et al.Postnatal exposure to low-dose bisphenol A influences various emotional conditions[J].J Toxicol Sci,2013,38(4):539-546.
[18]Matsuda S,Matsuzawa D,Ishii D,et al.Effects of perinatal exposure to low dose of bisphenol A on anxiety like behavior and dopamine metabolites in brain[J].Prog Neuropsychopharmacol Biol Psychiatry,2012,39(2):273-279.
[19]张婧,徐晓虹,王亚民,等.围生期双酚A暴露对不同性别子代小鼠行为的影响[J].心理学报,2009,41(9):832-841.
[20]Zhou Qin,Miao Maohua,Ran Maomei,et al.Serum bisphenol-A concentration and sex hormone levels in men[J].Fertil Steril,2013,100(2):478-482.
[21]Carrier N,Kabbaj M.Extracellular signal-regulated kinase 2 signaling in the hippocampal dentate gyrus mediates the antidepressant effects of testosterone[J].Biol Psychiatry,2012,71(7):642-651.
[22]Xu Lichun,Sun Hong,Chen Jianfeng,et al.Evaluation of androgen receptor transcriptional activities of bisphenol A,octylphenol and nonylphenol in vitro[J].Toxicology,2005,216(2/3):197-203.
[23]Lund T D,Rovis T,Chung W C,et al.Novel actions of estrogen receptor-beta on anxiety-related behaviors[J].Endocrinology,2005,146(2):797-807.
[24]Weiser M J,Wu T J,Handa R J.Estrogen receptor-beta agonist diarylpropionitrile:biological activities of R- and S-enantiomers on behavior and hormonal response to stress[J].Endocrinology,2009,150(4):1817-1825.
[25]Xu Xiaohong,Ye Yingping,Li Tao,et al.Bisphenol-A rapidly promotes dynamic changes in hippocampal dendritic morphology through estrogen receptor-mediated pathway by concomitant phosphorylation of NMDA receptor subunit NR2B[J].Toxicol Appl Pharmacol,2010,249(2):188-196.
[26]Shikimi H,Sakamoto H,Mezaki Y.Dendritic growth in response to environmental estrogens in the developing Purkinje cell in rats[J].Neurosci Lett,2004,364(2):114-118.
