HPO法制备己内酰胺的羟胺化过程研究
2014-08-05蒋利萍张庆祥
毛 伟,蒋利萍,张庆祥
(1.中国石油化工股份有限公司巴陵分公司己内酰胺事业部,湖南岳阳414000;2.巴陵石化公司职工培训学校,湖南岳阳414014)
己内酰胺是制造聚己内酰胺纤维和工程塑料的单体。我国1950年开始生产己内酰胺,近20年发展较快。目前,己内酰胺生产工艺有多种技术路线,其中荷兰DSM公司开发的磷酸羟胺(HPO)工艺是当今世界较成熟先进的己内酰胺制造工艺[1],采用此工艺生产的己内酰胺产品质量好。1992年,岳阳和南京分别建设了1套70 kt/a己内酰胺生产装置,均采用HPO技术路线,这些装置已进行了一系列技术改造和扩产。2013年,南京东方公司继续采用HPO法工艺路线设计投产了国内单线生产能力最大的200 kt/a己内酰胺生产装置。
羟胺(NH2OH)是制备己内酰胺的中间体,游离状态下很不稳定,易分解成NH3,N2,N2O等产物,在HPO工艺中以磷酸羟胺(NH3OH·H2PO4)的形式存在[2]。作者在中国石油化工股份有限公司巴陵分公司(简称巴陵石化)70 kt/a己内酰胺工业装置上采用高选择性的催化剂,通过反应动力学的研究,分析HPO法羟胺化反应的影响因素,进一步提高磷酸羟胺浓度,减少副产物的生成,提升装置经济运行水平。
1 实验
1.1 原料和试剂
钯/碳(Pd/C)催化剂:Pd质量分数10%,美国Johnson Matthey Catalysts公司产;磷酸:食品级,质量分数85%,江苏澄星磷化工有限公司产;硝酸:自制;氢气:高纯,自制。
1.2 仪器与设备
WZP1-2400-P型温度变送仪:南京宁天自动化仪表厂制;1151DP4E22M2B3D2型气体流量测量仪:西安西仪股份有限公司制;PH200S型pH值测量仪:日本 Yokogawa自控仪表公司制;SPM25422-A型H分压分析仪:美国Underwriters Laboratories股份公司制;自动电位滴定仪:日本岛津公司制。
1.3 实验
硝酸盐加氢还原制备磷酸羟胺的反应是HPO法的核心。磷酸羟胺是在含有水、硝酸盐、磷酸盐和氢离子的无机工艺液中,通过Pd/C催化剂[3]作用,硝酸盐与氢气发生还原反应制得的。反应为气、液、固三相反应,在不带搅拌的鼓泡反应器中进行。原料氢气和无机工艺液从底部进入反应器,从顶部排出反应产物。氢气鼓泡起搅拌混合、增加接触面积、提高传质效果的作用,氢气的进料量太小不能在反应器中形成一个合适的气相循环,所以一部分反应器尾气用压缩机循环。反应过程中产生的热量从反应器底部的水冷换热器移出。反应的催化剂和缓冲溶液在一组平行排列的过滤器中得到分离,为了保持催化剂的悬浮状态,只有一部分工艺液被过滤,剩余的悬浮液再循环到羟胺反应器中,过滤器周期性的用过滤后的无机工艺液进行反冲洗,过滤和反冲由一个专门的程序控制而自动交替进行,硝酸盐加氢还原制备磷酸羟胺的工艺流程见图1。
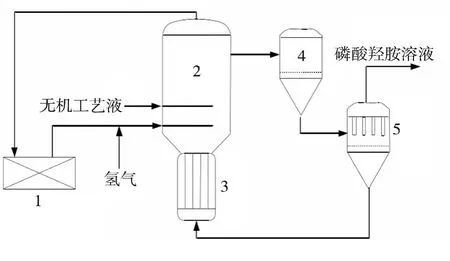
图1 硝酸盐加氢还原制备磷酸羟胺的工艺流程Fig.1 Flow chart of nitrate hydrogenation reduction into hydroxylamine phosphate
1.4 分析测试
H+浓度:用NaOH标准溶液进行电位滴定。
NH3OH+浓度:试样溶液的NH3OH+与丙酮反应生成丙酮肟,每消耗1mol的NH3OH+就会释放出1 mol的酸,释放出的酸再用 NaOH标准溶液进行电位滴定。
H2PO4-浓度:试样溶液的H2PO4-和硝酸镧反应,生成不溶于水的磷酸镧沉淀,每消耗1mol H2PO4-释放出2 mol的H+,释放出的酸用 NaOH标准溶液进行电位滴定。
NH4+浓度:先用丙酮与试样溶液的NH3OH+反应,释放出H+,用 NaOH标准溶液进行电位滴定至pH值为8.2,然后用甲醛与试样中的NH4+反应生成六次甲基四胺,释放出H+,用NaOH标准溶液进行电位滴定至pH值为8.2。
游离酸浓度:H+浓度加NH3OH+浓度减去H2PO4-浓度即为游离酸浓度。
2 结果与讨论
2.1 反应温度
从表1可知:随着反应温度的降低,NH3OH+的生成速率降低,即NO-3还原速率降低;而温度太高,会导致选择性下降,且催化剂寿命有可能缩短。最佳反应温度为58~62℃,NH3OH+浓度为0.95 ~1.06 mol/kg。
表1 反应温度对NO3-还原速率的影响Tab.1 Effect of reaction temperature on reduction rate of

表1 反应温度对NO3-还原速率的影响Tab.1 Effect of reaction temperature on reduction rate of
注:每2 h在线测试;压缩机气体循环量为46.0~48.0 km3/h,系统氢分压体积分数40%,羟胺催化剂总量1 500 kg。
反应温度/℃ 羟胺反应器入口反应液浓度/(mol·kg-1)羟胺反应器出口反应液浓度/(mol·kg-1)游离酸 H+ H2PO-4 NH+4 H+ NH3OH+ H2PO-4 NH+4 64 0.65 3.05 2.40 2.68 0.45 1.08 2.30 2.90 63 0.62 3.03 2.41 2.56 0.46 1.06 2.31 2.86 62 0.65 3.03 2.38 2.65 0.44 1.06 2.28 2.96 61 0.68 3.06 2.38 2.66 0.45 0.99 2.28 2.89 60 0.65 3.04 2.39 2.56 0.43 1.00 2.29 2.95 59 0.61 3.00 2.39 2.57 0.45 0.99 2.29 3.03 58 0.61 3.01 2.40 2.60 0.41 0.95 2.30 3.05 57 0.61 3.04 2.43 2.65 0.44 0.90 2.33 2.97 56 0.61 3.04 2.42 2.66 0.42 0.85 2.32 2.89
2.2 氢分压
硝酸盐催化加氢的速率与氢气浓度的0.34次方成正比。氢分压过高,因催化剂表面氢已饱和,并不能使反应收率成比例地提高,只能增加氢耗;氢分压过低,反应不能正常进行,影响收率,并可能造成催化剂的流失。反应压力控制2 500~2 550 kPa,氢分压体积分数38% ~40%,能达到氢向催化剂表面扩散,提升硝酸盐还原速率的要求[4],NH3OH+浓度为 0.98 ~1.03 mol/kg。
2.3 催化剂浓度
硝酸盐加氢的反应速度与催化剂浓度的1次方成正比[5]。催化剂浓度过低,生产能力降低;浓度过高,增加了滤芯的负荷和滤芯清洗的频率,影响使用寿命。反应液中催化剂浓度应控制在6.5 ~9.6 kg/m3为宜。
2.4 气体循环量
从表2可以看出,由于羟胺反应器是一个鼓泡反应器,在其他条件一定的情况下,当气体循环量增加后,强烈的搅拌将较大的氢气泡破碎,使氢气以微小的气泡分散在溶液中,使得在相同气含率下,气液之间的相界面积增加。同时由于流体湍动程度的增加,催化剂分散更均匀,液膜的传质阻力降低,两者综合的效果使硝酸盐的还原速率增加,羟胺的收率提高。循环压缩机气体循环量最佳控制在 46.0 ~48.0 km3/h,NH3OH+的浓度为0.98 ~1.03 mol/kg。
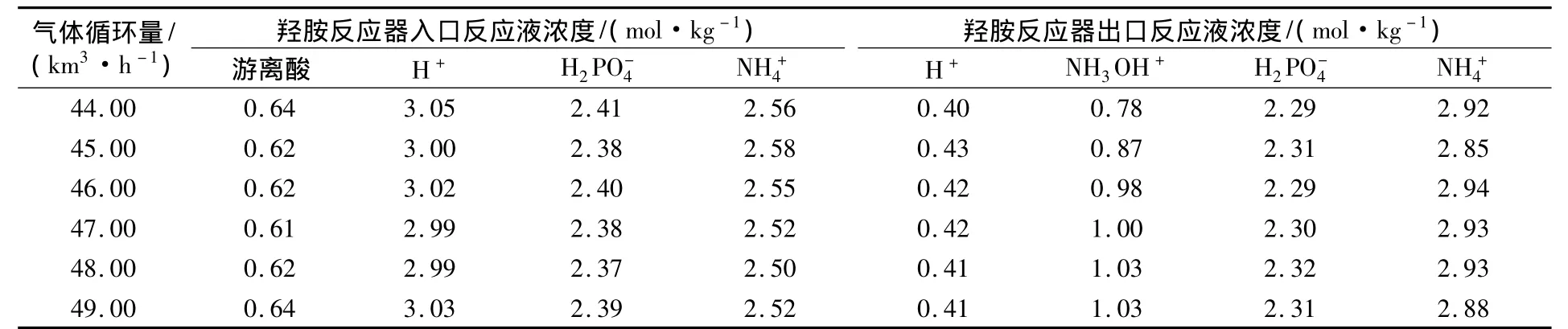
表2 硝酸盐催化还原速率与气体循环量的关系Tab.2 Relationship between nitrate catalytic reduction and gas circulation volume
2.5 pH 值
在羟胺反应中,只有pH小于等于2时,平衡才移向质子化的羟胺,此时才能确保对NH3OH+生成的选择性(pH值太高,平衡对催化剂表面中间体存在有利,反应的产物是NH3和N2O)。当反应器出口无机工艺液的pH小于等于1.80,会增加催化剂在无机工艺液中的溶解速度。pH值是羟胺制备工序中一个重要指标,若其他工艺条件正常稳定,反应器出口pH值下降,则说明催化剂活性在下降。
从图2可以看出,pH值与H+/H2PO-4摩尔比成反比关系。当控制出口pH值为1.80~2.10时,也就是控制出口H+/H2PO-4摩尔比为0.15~0.23。pH值增大,硝酸盐的还原速率线性下降。pH值大于2时,增加了NH+4选择性,NH3OH+生成的反应变慢,而羟胺的分解和生成氨的反应则进行得很快。这是因为无机工艺液中的pH值低时,催化剂表面产生的羟胺容易质子化脱附;pH值高时,则在反应过程中没有足够的H+使催化剂表面产生的羟胺变成稳定形态,而使羟胺进一步发生副反应,产生更完全的加氢产物氨,实验中可确定pH值最佳控制1.80~2.00。
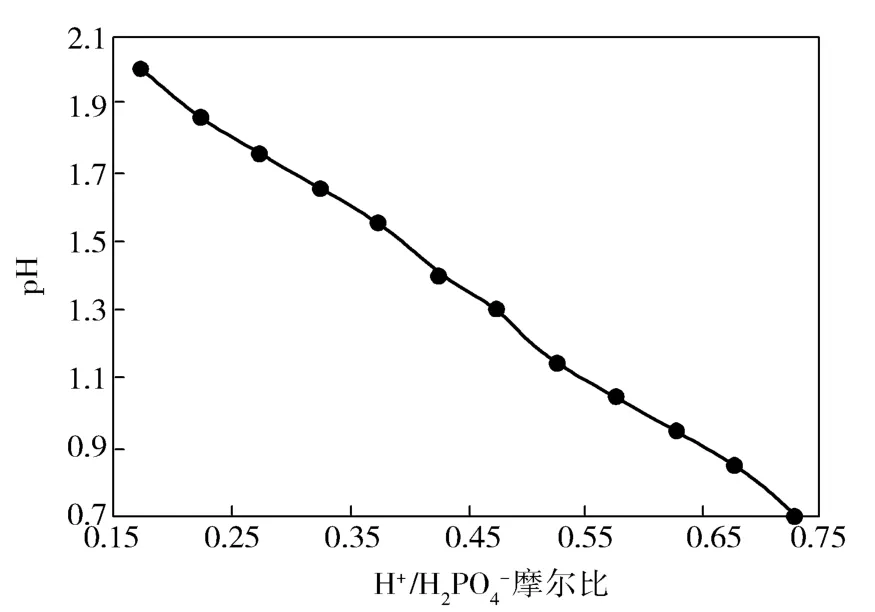
图2 无机工艺液pH值与H+/H2PO-4摩尔比的关系Fig.2 pH value of inorganic process solution as a function of H+/H2mole ratio
2.6 进料无机液组分的影响
2.6.1 H+浓度
反应动力学方程指出,硝酸盐催化还原速率与溶液中H+浓度成正比关系。H+浓度对羟胺生成速率的影响见表3。

表3 H+浓度浓度对羟胺生成速率的影响Tab.3 Effect of H+concentration on hydroxylamine production rate
从表3可看出,H+浓度增加,硝酸盐还原速率增加,但受催化剂稳定性的限制,即H+浓度如过高,则催化剂贵金属在无机工艺液中溶解流失过快。可确定 H+浓度控制在2.90~3.10 mol/kg,得到 NH3OH-的浓度为 0.98 ~1.10 mol/kg。
2.6.2 磷酸盐浓度
从反应动力学方程式可知,硝酸盐的还原速率与磷酸盐浓度无直接关联。但磷酸在无机工艺液中主要起缓冲和平衡的作用,这使系统的pH值不会有太大变化。
磷酸盐浓度太低,则无机工艺液的缓冲能力降低,pH值波动大。系统中硝酸根浓度是正负离子浓度的差值,磷酸盐浓度对羟胺生成速率的影响见表4。
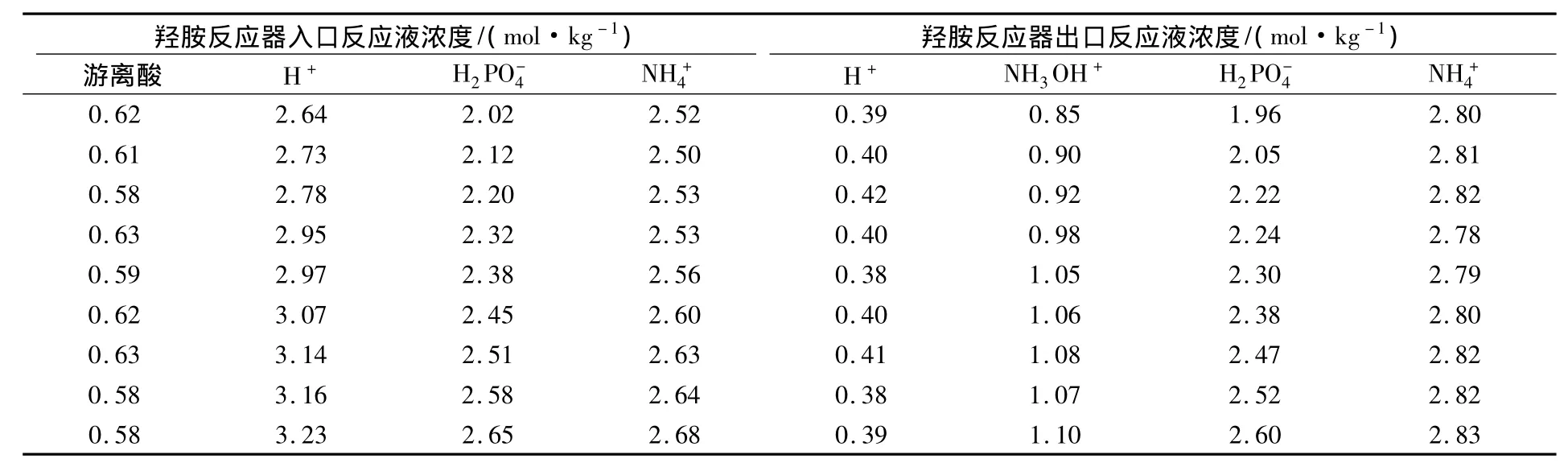
表4 磷酸盐浓度对羟胺生成速率的影响Tab.4 Effect of phosphate concentration on hydroxylamine production rate
3 结论
a.羟胺化反应温度控制在58~62℃,可确保NH3OH+的收率达到最佳。
b.羟胺化反应压力控制在2 500~2 550 kPa,氢分压宜控制体积分数为38% ~40%。
c.羟胺反应系统的催化剂浓度以6.5~9.6 kg/m3无机液为宜。
d.气体循环量最佳控制在46.0~48.0 km3/h,加速气液循环,改善传质效果。
e.羟胺反应器出口的pH值控制为1.80~2.00,NH3OH+的收率最高。
f.通过对羟胺反应进料组分中离子浓度进行调优,严格控制反应进料组分关键参数,H+浓度为2.90~3.10 mol/kg浓度为2.30~2.45 mol/kg浓度为2.50 ~3.00 mol/kg,确保Pd/C催化剂的活性和选择性达到最佳值。
[1] 孙洁华,毛伟.己内酰胺生产工艺及技术特点[J].化学工程师,2009,23(1):38 -44.
[2] 荷兰DSM公司.硝酸盐和一氧化氮催化还原制备羟胺的反应动力学与反应机理[M].北京,中国石化出版社,1992:23-198.
[3] 胡学武.HPO法合成羟胺催化剂Pd+Pt/C的制备研究[J].工业催化,1997(1):31 -35.
[4] Luo Hean,Svendsen H F.Turbulent circulation in bubble columns from eddy viscosity distribution of single-phase pipe flow[J].Can J Chem Eng,1990,69(6):1389 - 1394.
[5] 毛伟.催化剂反应动力学在羟胺化反应中的应用[J].广州化工,2013,41(12):272 -274.
