乳腺癌MRI特征与分子生物学行为的相关性研究
2014-08-03杨爱萍蔡忠刚
杨爱萍,蔡忠刚
(1.甘肃省妇幼保健院放射科;2.甘肃省中医院放射科,兰州 730050)
乳腺癌的肿瘤异质性很强,不同类型的乳腺癌具有明显不同的治疗方式和预后,术前评估其生物学行为具有很重要的临床意义。乳腺癌所表达的ER、PR、Her-2、Ki-67因子及淋巴结转移情况在一定程度上反应了乳腺癌的生物学行为,理论上,这些因子和基因的表达引起组织学上的改变,从而在影像学上间接或直接的反应出来。目前,乳腺癌的影像学评估方法以MR动态增强和扩散加权两种技术最为常用,近几年国外以DWI的研究为多,国内仍以MR-DCE评估乳腺癌预后为主。本文对28例乳腺癌MR-DCE表现和ADC值分析,并与预后因子对比,旨在寻找两者之间更多的相关性,为乳腺癌的活体生物学行为评价提供依据。
1 资料和方法
1.1 一般资料 28例乳腺癌均经病理证实,其中导管内癌(invasive ductal carcinoma,IDC)27例,导管原位癌1例;淋巴结转移数14例(50%)。所有患者均行免疫组织化学染色。
1.2 方法 所有患者均采用Siemens 3.0 T磁共振仪扫描。患者俯卧位,双侧乳腺置于相控阵乳腺表面线圈内。扫描前训练患者呼吸,待患者能熟练配合呼吸要求再开始扫描。扫描序列包括:T1加权轴位、T2压脂序列轴位和矢状位、DWI及动态增强扫描。DWI采用平面回波成像技术,其中b值分别取0、50、400、800。动态增强扫描采用3 D快速小角度激发扰相梯度回波序列(FLASH-3D)+T1压脂序列:TR/TE 4.76 ms/1.66 ms,FOV 340 mm,层厚1.20 mm,无间断扫描8 min 20 s,共采集1+7个时相,第一个时相采集1 min 20 s,后7个时相每个采集59 s。将水脂分离频率差调整至430 Hz水平,注射对比剂前先扫描第1期,然后用高压注射器通过静脉团注钆喷酸葡胺0.20 ml/kg,随后注入10 ml生理盐水,速度2.00 ml/s,注射结束后立即进行动态增强扫描。所有图像均由高年资医生分析。毛刺征诊断标准[1]:由肿瘤向周围延伸的线样影,直径约 1~3 mm,长短不一,近肿瘤端粗,远端逐渐变细,但不呈三角形或锯齿状,无分叉。按照乳腺癌TNM分期标准,将乳腺癌病灶大小分成>2 cm(T2期)和≤2 cm(T1期)两组。SE T1WI序列观察病灶边缘,在周围脂肪的衬托下较好的显示病灶边缘模糊情况。病灶内部坏死情况结合各个序列观察分析,增强后未见强化及平扫呈更长T1更长T2信号为坏死区。选取病灶实性部分(强化最明显的区域)为感兴趣区(ROI),但要避开肉眼可辨别的血管(通过对照MIP图像),病灶较大者取3点分别做DCE-MRI的时间-信号强度曲线(time-signal intensity curve, TIC),以比较标准的曲线为记录结果。肿块小时测量ADC值,先从弥散图像(b值=800时)上找到病灶并定位,然后在ADC图上对应层面定位肿块的位置并测量,病灶较大者选取无明显坏死区测量3次,取平均值记录。
1.3 统计学方法 通过SPSS 13.0软件对数据进行统计分析,采用χ2检验评价乳腺癌MR形态、增强特征与ER、PR、HER-2、Ki-67表达及淋巴结转移的相关性;采用方差分析评价上述各预后因子阳性和阴性组间ADC值的差别。以P<0.05为差异有统计学意义。
2 结 果
2.1 肿瘤免疫组化结果 ER、PR、HER-2、Ki-67表达阳性率分别为67.86%(19例)、64.29%(18例)、53.57%(15例)、60.71%(17例)。病理结果见图1E、1M,免疫组化染色结果见图1F-1I,1N-1Q。
2.2 乳腺癌特征与肿瘤预后因素间的相关性(表1) 肿瘤直径>2 cm和≤2 cm组间比较,Her-2表达差异有统计学意义(χ2=5.184,P=0.023)。有毛刺征和非毛刺征组比较,PR表达差异有统计学意义(χ2=6.857,P<0.05);毛刺征与其它因子表达和淋巴结转移比较,差异无统计学意义。肿瘤TIC Ⅲ型和Ⅱ型组间比较,淋巴结转移差异有统计学意义(χ2=7.337,P<0.05)。乳腺癌MRI特征见图1A-1D,1J-1L。
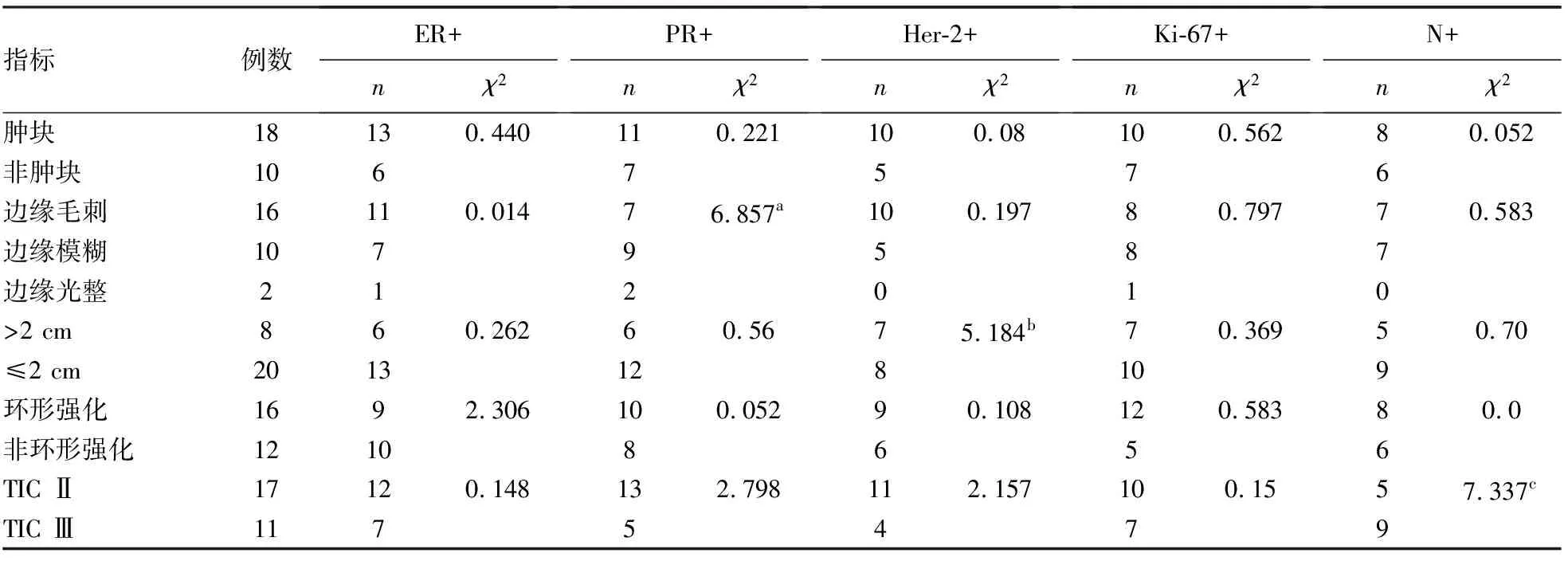
表1 MRI特征与预后因素间的相关性
3.3 不同预后因素组乳腺癌的ADC值(表2) 28例乳腺癌ADC值按ER、PR、Her-2、Ki-67是否阳性及是否有淋巴结转移各分成两组。Her-2阳性组平均ADC值为(1401.3±214.0)mm2/s,阴性组平均ADC值为(985.6±201.3)mm2/s,两组间比较差异有统计学意义(t=5.624,P<0.05)。其余各组间ADC值均无统计学意义。
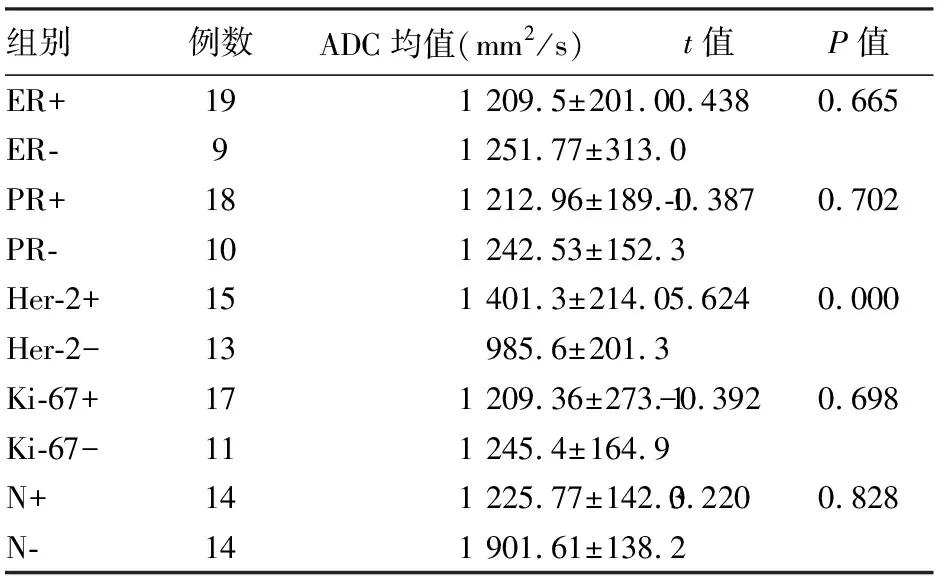
表2 各预后因素组间ADC均值的方差分析结果
3 讨 论
MR是一种具有很大临床应用价值的检查技术,被认为是评价钼靶和超声可疑乳腺肿块的有力补充手段。不同的免疫组化指标(如ER、PR、HER-2、Ki-67)代表着乳腺癌不同的生物学行为,对患者的预后影响很大,早期发现恶性程度高的乳腺癌和术前预测乳腺癌的预后情况,对临床医生和患者具有重要价值。近几年乳腺癌的预后因素与MR特征之间的相关性研究越来越多,但由于各MR检查设备和部分概念解释准则不同,各研究报道结果不一。本文就乳腺癌MR表现与预后因子间的相关性进一步探讨,为临床提供更多有价值的依据。
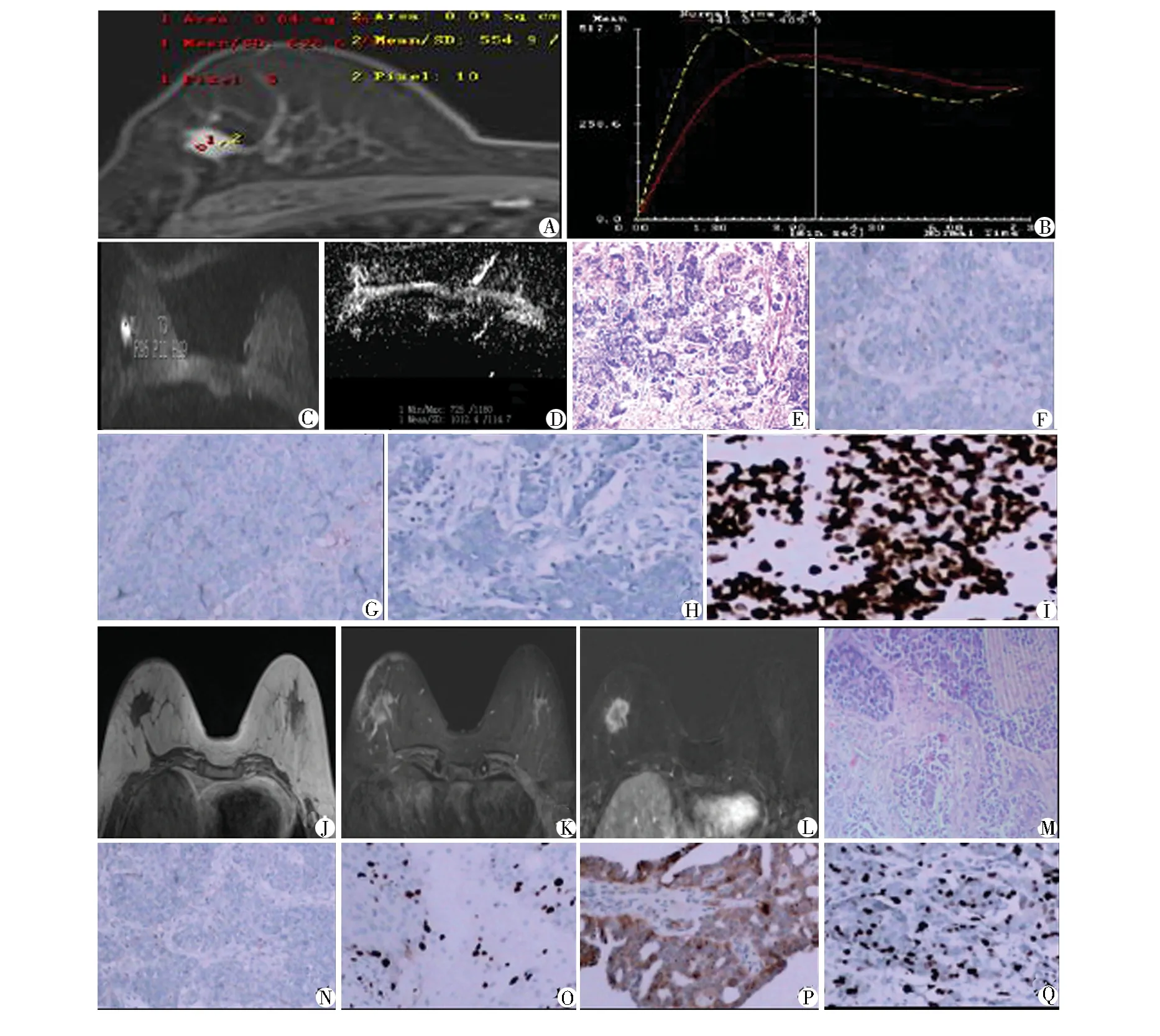
图1 右侧浸润性导管癌
3.1 ER、PR、Her-2、ki-67在乳腺癌中的表达意义 雌激素受体(ER)、孕激素受体(PR)是类固醇激素受体,表达在正常的乳腺上皮细胞核上,雌激素和孕激素通过相应的受体来调节细胞。当细胞恶变,分化程度良好时,部分受体保留下来,这种肿瘤细胞会接受并依赖原来的激素调节,临床上称之为激素受体阳性肿瘤;相反,当恶变的细胞分化差时,激素受体完全或几乎消失,这种肿瘤细胞不在受激素调节,临床上称之为激素受体阴性肿瘤。内分泌治疗在乳腺癌的治疗中占有举足轻重的作用,患者是否适合内分泌治疗决定性因素就是ER、PR的表达。ER阳性肿瘤[2]比起ER表达阴性肿瘤细胞分化良好、侵袭性弱,而且治疗选择多,比如受体阻断剂、芳香化酶抑制剂,可以起到良好的作用。人类表皮生长因子受体2(Her-2,C-erbB-2)是表皮生长因子受体(EGFR)家族成员之一, Her-2多表达与细胞膜上,少数亦可见于胞质内,通过激活Ras通路起到引起细胞增殖的作用。Her-2表达越多,肿瘤细胞增殖越明显,同时也意味着肿瘤容易复发和淋巴结容易转移[3-4]。Ki-67是细胞核抗原,反应细胞增殖活性较理想的检测指标之一。在正常乳腺腺体、乳腺癌病灶旁、分化良好的乳腺癌及良性病灶中Ki-67的表达很低,而分化差的乳腺癌细胞核上高表达。
3.2 乳腺癌MR表现与分子生物学行为的相关性
3.2.1 乳腺癌病灶大小与生物学行为的相关性 Sah等[5]研究认为乳腺癌体积大与ER阴性表达具有正相关性。本研究显示8例大于2 cm的肿瘤中Her-2表达6例(75%),20例小于等于2 cm的肿瘤中Her-2表达13例(65%),两者间具有统计学意义(P<0.05)。另外,本研究肿瘤大于2 cm组Ki-67表达数(7/8,87.5%)高于肿瘤小于等于2 cm组(10/20,50%),由于样本量的原因,数据虽然未见统计学差异,但结合文献认为肿瘤体积越大,说明细胞增殖活跃,提示肿瘤不好的生物学行为。大量研究[5-6]显示乳腺癌预后的最重要两个因素是肿瘤大小和淋巴结转移情况,肿瘤越大、淋巴结转移多,预后越不好。
3.2.2乳腺癌强化形态与分子生物学行为的相关性 文献报道肿块型乳腺癌比非肿块型乳腺癌ER阳性率更高,提示良好的预后[7]。其病理原因为ER阴性肿瘤容易引起瘤内彻底的粉刺样坏死,细胞基质多为淋巴样基质,瘤体内部多发生坏死或纤维化,这些病理学特征更多的会引起乳腺癌向非肿块样形态发展。本研究肿块型乳腺癌ER阳性表达略多于非肿块型(13/18vs6/10),并无统计学意义。但研究发现肿块型乳腺癌淋巴结转移少于非肿块型(8/18vs6/10)。乳腺癌不同强化形态与肿瘤大小有一定相关性,肿块型乳腺癌多体积小,非肿块型乳腺癌病灶范围≥2 cm更多见。由此,笔者同意肿块型乳腺癌比非肿块型乳腺癌预后更好的观点。研究显示肿块型乳腺癌PR表达少(10/18、7/10)、Her-2表达略高(10/18、5/10),可能与样本量有关。
3.2.3 乳腺癌毛刺征与分子生物学行为的相关性 肿瘤毛刺状边缘是否提示肿瘤恶性程度更高的一个征象目前有一些争议。有研究报道肺癌毛刺征的出现代表着肿瘤恶性程度更高、侵袭性更强,未出现毛刺征的肿瘤细胞分化稍好[8]。而另有研究认为肺癌毛刺征在很大程度上是肿瘤周围的间质反应,纤维间质增生限制了肿瘤生长,是一种肿瘤早期保护机制[9]。本研究所有出现毛刺征的IDC病理分级均为Ⅱ级,未显示出细胞分化程度的高低,但笔者认为毛刺征的出现说明乳腺癌细胞向周围有一定的浸润,周围间质才会出现反应性增生,可能提示肿瘤更具有侵袭性。关于毛刺征反应IDC的预后问题,也有大量影像与病理对照研究认为乳腺癌毛刺征与良好的预后因素相关。研究报道乳腺癌毛刺征与Ki-67低表达相关[10],陈蓉、王黎明等[11-12]报道乳腺癌毛刺征与ER高表达相关,两者研究结果均提示出现毛刺征的肿瘤预后良好。以上研究从病理上解释认为:恶性程度高的乳腺癌,细胞外基质内富含透明质酸,容易引起周围正常组织的炎性渗出反应,肿瘤范围比较局限;而病理分级低的乳腺癌细胞疏松,细胞外基质内富含胶原蛋白,引起周围正常组织纤维增生性反应,从而容易出现毛刺状边缘。在16例毛刺征中,PR阳性表达7例(43.75%),而非毛刺征肿瘤12例,PR表达10例(83.33%),两者具有统计学意义(P<0.05),毛刺征与其它因子表达和淋巴结转移情况之间无统计学意义。出现毛刺征的肿瘤PR阳性表达率低,肿瘤内分泌治疗效果不好。本研究未从病理学角度深层次对照研究,但结果更支持毛刺征的出现表明肿瘤预后不良这一观点。
3.2.4 乳腺癌环形强化与分子生物学行为间的相关性 大量研究结果显示乳腺癌环形强化(病灶内坏死形成的环形强化)与不良预后因素正相关,环形强化者ER、PR阴性表达更多见,而Ki-67、P53、Her-2表达高,淋巴结转移多见,肿瘤体积较大[5,13-14]。环形强化或肿瘤内部坏死的原因认为肿瘤细胞增殖快,肿瘤血供不足出现内部坏死、纤维粘连,而肿瘤实性部分与病理对照发现微血管密度增多,证明新生血管增多,其形成机制符合肿瘤恶性程度高、分化差的生物学行为[15-18]。本研究未见环形强化与ER阳性表达率、淋巴结转移数间具有统计学差异,此结果可能是样本量少的原因。
3.2.5 乳腺癌TIC类型与生物学行为间的相关性 TIC直观的反应肿瘤血流灌注情况,对肿瘤良、恶性鉴别具有重要价值[19-20],乳腺癌87%以上是Ⅲ型TIC,85%的良性肿瘤无Ⅲ型TIC。本研究28例乳腺癌Ⅲ型TIC占1/3,Ⅱ型TIC占2/3。文献报道乳腺癌Ⅲ型TIC与不良预后因素正相关,如Ki-67表达高,ER、PR阴性表达多见,淋巴结转移多见,提示肿瘤预后不好[20-25]。本研究结果只显示乳腺癌Ⅲ型TIC与淋巴结容易出现转移间具有相关性(P<0.05),支持上述观点。Her-2是一种原癌基因,阳性表达在一定程度上代表着肿瘤细胞的分化程度,不仅提示肿瘤预后不好,也预示着肿瘤对一些化疗药物不敏感(如环磷酰胺、甲氨蝶呤、佛尿嘧啶及低剂量蒽环类药物等)。理论上,乳腺癌表现为Ⅲ型TIC说明肿瘤细胞分化低,新生血管多,血供丰富,肿瘤细胞更容易出现Her-2高表达。研究也证实 Ⅲ型TIC的IDC对Her-2高表达。本组研究未见乳腺癌TIC类型与预后因子间具有相关性[26]。
3.3 乳腺癌ADC值与生物学行为间的相关性 DWI反应组织内水分子的扩散程度[27-30],通过测量肿瘤组织ADC值能间接了解肿瘤细胞增殖程度和细胞间质成分。乳腺癌激素受体的表达及Her-2因子的表达对乳腺癌间质成分有一定影响,所以在理论上,乳腺癌ADC值与ER、PR、Her-2有一定关联。研究发现ER阳性的IDC间质成分主要为胶原蛋白(ADC值降低),ER阴性的IDC间质成分主要为纤维组织细胞(ADC值升高)。研究显示低的ADC值与ER、PR阳性表达相关,原因为ER可以减少肿瘤血管的生成和诱导细胞增殖,从而导致水分子弥散受限[31-33]。上述研究并没有显示出与Her-2表达相关,但也有研究认为Her-2阳性肿瘤ADC值高于Her-2阴性者[34],与Martincich等[35]研究结果相同。本文未见ADC值与ER、PR表达相关,但显示出Her-2阳性组ADC值高于阴性组,具有统计学意义(P<0.05)。研究同时显示淋巴结组间ADC值无相关性,但研究发现腋窝淋巴结转移、ER阴性表达的乳腺癌ADC值要高于腋窝淋巴结阴性、ER阳性表达者[36],和本文结果不符。结合文献及本研究作者认为乳腺癌的高ADC值与Her-2阳性表达具有相关性,提示肿瘤预后不良,可为临床化疗药物的选择提供依据。ADC值与ER、PR表达及淋巴结阳性间是否有一定相关性,各研究结果不一致,但在理论上推测,肿瘤细胞分化差,细胞增殖活跃,肿瘤ADC值应该降低,而ER、PR阴性表达相应增多,容易出现淋巴结转移。
参考文献
[1]Dixon J M,Anderson T J, Miller W R.Neoadjuvant endocrine therapy of breast cancer: a surgical perspective[J].EurJCancer,2002,38(17):2214-2221.
[2]Rouanet P, Roger P, Rousseau E,etal. Her2 overexpression a major risk factor for recurrence in pT1a-bN0M0 breast cancer: results from a French Regional Cohort[J].CancerMed,2014,3(1):134-142.
[3]Thery J C, Spano J P, Azria D,etal. Resistance to humanity epidermal growth rate factor receptor type 2-targeted therapies[J].EurJCancer,2014,50(5):892-901.
[4]韩冬艳,朱延波,蒋虹伟.Cerbb2、ER、PR、Ki67在乳腺癌中的表达及其意义[J].武警后勤学院学报,2012,21(2):85-87.
[5]Suba Z. Triple-negative breast cancer risk in women is defined by the defect of estrogen signaling: preventive and therapeutic implications[J].OncoTargetsTher, 2014,7(1):147-164.
[6]Zhang S, Chung W C, Miele L,etal. Targeting met and notch in the lfng-deficient,met-amplified triple-negative breast cancer[J].CancerBiolTher,2014,15(5):633-642.
[7]Xu H, Eirew P, Mullaly S C, Aparicio S. The omics of triple-negative breast cancers[J].ClinChem, 2014,60(1):122-133.
[8]Li J, Han X. Research and progress in magnetic resonance imaging of triple-negative breast cancer[J].MagnResonImaging,2014,32(4):392-396.
[9]Uematsu T. Mr Imaging of Triple-negative breast cancer[J].BreastCancer, 2011,18(3):161-164.
[10]Youk J H, Son E J, Chung J,etal. Triple-negative invasive breast cancer on dynamic contrast-enhanced and diffusion-weighted mr imaging: comparison with other breast cancer subtypes[J].EurRadiol,2012,22(8):1724-1734.
[11]陈 蓉,龚水根,张伟国.乳腺癌MRI形态学表现与病理、分子生物学相关性研究[J].中华放射学杂志,2004,38(6):620-625.
[12]王黎明.乳腺浸润性导管癌3T磁共振动态增强特征与预后的相关性研究[J].中国医学影像学杂志,2011,19(8):596-600.
[13]邵真真,刘佩芳, 张淑平. 钙化性乳腺癌MRI表现及其与预后因子的相关性分析[J].中国肿瘤临床, 2013,40(7):389-394.
[14]Nalieskina L A,Luk'ianova N I u,Kuns'ka L M,etal.Visualization of iron nanoparticles accumulation and distribution features in sensitive and resistant to antitumor drugs human breast cancer cells after different time intervals of cultivation with liposomal ferromagnetic[J].TsitolGenet,2011,45(6):61-66.
[15]Sah R G, Sharma U, Parshad R,etal. Association of estrogen receptor, progesterone receptor, and human epidermal growth factor receptor 2 status with total choline concentration and tumor volume in breast cancer patients: an mri and in vivo proton mrs study[J].MagnResonMed, 2012,68(4):1039-1047.
[16]袁中玉,王树森,高 岩.305例三阴乳腺癌患者的临床特征及预后因素分析[J].癌症,2008,27(6):561-565.
[17]彭秀斌,林远青,罗云辉,等.周围型肺癌的CT征象与p53基因结构及表达异常的关系[J].中国医学影像学杂志,2000,8(3):2102-2121.
[18]刘进康,曾纪珍,周建华.周围型肺腺、鳞癌CT征象与癌细胞核DNA含量关系的研究[J].中华放射性杂志, 1996,30(1):15-19.
[19]Lee S H, Cho N, Kim S J,etal. Correlation between high resolution dynamic mr features and prognostic factors in breast cancer[J].KoreanJRadiol, 2008,9(1):10.
[20]Teifke A, Behr O, Schmidt M,etal. Dynamic MR imaging of breast lesions: correlation with microvessel distribution pattern and histologic characteristics of prognosis[J].Radiology, 2006,239(2):351-360.
[21]Jinguji M, Kajiya Y, Kamimura K,etal. Rim enhancement of breast cancers on contrast-enhanced mr imaging: relationship with prognostic factors[J].BreastCancer,2006,13(1):64-73.
[22]Buadu L D, Murakami J, Murayama S,etal. Breast lesions: correlation of contrast medium enhancement patterns on mr images with histopathologic findings and tumor angiogenesis[J].Radiology, 1996,200(3):639-649.
[23]Veltman J, Stoutjesdijk M, Mann R,etal. Contrast-enhanced magnetic resonance imaging of the breast: the value of pharmacokinetic parameters derived from fast dynamic imaging during initial enhancement in classifying lesions[J].EurRadiol,2008,18(6):1123-1133.
[24]Choi N, Han B K, Choe Y H,etal. Three-phase dynamic breast magnetic resonance imaging with two-way subtraction[J].JComputAssistTomogr,2005,29(6):834-841.
[25]Chen J H, Baek H M, Nalcioglu O,etal. Estrogen receptor and breast MR imaging features: a correlation study[J].JMagnResonImaging, 2008,27(4): 825-833.
[26]Jeh S K, Kim S H, Kim H S,etal. Correlation of the apparent diffusion coefficient value and dynamic magnetic resonance imaging findings with prognostic factors in invasive ductal carcinoma[J].JMagnResonImaging, 2011,33(1):102-109.
[27]Tuncbilek N, Karakas H M, Okten O O. Dynamic magnetic resonance imaging in determining histopathological prognostic factors of invasive breast cancers[J].EurJRadiol, 2005,53(2):199-205.
[28]Sharma S, Hiran K R, Pavithran K,etal. A pilot study to assess the feasibility of evaluation of markers of response to chemotherapy at one day & 21 days after first cycle of chemotherapy in carcinoma of breast: a prospective non-randomized observational study[J].JSurgOncol, 2009,7(1):35.
[29]Tewari M, Pradhan S, Singh U,etal. Assessment of predictive markers of response to neoadjuvant chemotherapy in breast cancer[J].AsianJSurg, 2010,33(4):157-167.
[30]Tewari M,Krishnamurthy A,Shukla H S.Predictive markers of response to neoadjuvant chemotherapy in breast cancer[J].SurgOncol, 2008,17(4):301-311.
[31]Matsubayashi R N, Fujii T, Yasumori K,etal. Apparent diffusion coefficient in invasive ductal breast carcinoma: correlation with detailed histologic features and the enhancement ratio on dynamic contrast-enhanced mr images[J].JOncol,2010 doi:10.1155/2010/q21048.
[32]Ko E S, Han B K, Kim R B,etal. Apparent diffusion coefficient in estrogen receptor-positive invasive ductal breast carcinoma: correlations with tumor-stroma ratio[J].Radiology,2014,271(1):30-37.
[33]Choi S Y, Chang Y W, Park H J,etal. Correlation of the apparent diffusion coefficiency values on diffusion-weighted imaging with prognostic factors for breast cancer[J].BrJRadiol, 2012,85(1016):e474-479.
[34]Park S H, Choi H Y, Hahn S Y. Correlations between apparent diffusion coefficient values of invasive ductal carcinoma and pathologic factors on diffusion-weighted mri at 3.0 tesla[J].JMagnResonImaging,2013 doi:10.1002/jmri.24519.
[35]Martincich L, Deantoni V, Bertotto I,etal. Correlations between diffusion-weighted imaging and breast cancer biomarkers[J].EurRadiol, 2012,22(7):1519-1528.
[36]Kamitani T, Matsuo Y, Yabuuchi H,etal. Correlations between apparent diffusion coefficient values and prognostic factors of breast cancer[J].MagnResonMedSci, 2013,12(3):193-199.
