3种碱性盐胁迫对紫穗槐形态和生理的影响1)
2014-08-02江远芳王竞红
江远芳 王竞红 薛 菲
(东北林业大学,哈尔滨,150040)
3种碱性盐胁迫对紫穗槐形态和生理的影响1)
江远芳 王竞红 薛 菲
(东北林业大学,哈尔滨,150040)
依据东北地区边坡土壤不同坡段土壤的pH值的变化情况,采取不同浓度的Na2CO3、NaHCO3及二者混合盐对2年生紫穗槐幼苗进行人工模拟胁迫;采用叶片表象及生理指标,比较不同浓度、不同盐分的胁迫处理对紫穗槐的影响程度。结果表明:在150 mmol·L-1浓度下,Na2CO3、NaHCO3处理45 d后的紫穗槐叶片受害表象最明显,叶片出现大量黄化、甚至脱落;电导率、丙二醛质量摩尔浓度、脯氨酸质量分数、可溶性糖质量分数,与胁迫程度、胁迫时间呈正相关,叶片相对含水量与胁迫程度呈负相关;高浓度(150 mmol·L-1)Na2CO3胁迫下,紫穗槐生理指标变化最为显著。
紫穗槐;盐害症状;叶片表象;生理指标
黑龙江省作为我国东北的边陲省份,其土壤类型具有黑土、黑钙土、暗棕壤等。全省大约有三分之一的区域属于盐浸敏感区域,尤其是松花江沿岸地区,由于地下水位深度较浅,属于盐浸化高发区域[1]。经过研究证明,黑龙江地区主要以碱性盐形成了对土壤的侵蚀,其成分以Na2CO3和NaHCO3为主。盐浸地域的植物生长状况研究和在盐浸地区的边坡防护过程中进行植物种类的选择,成为了研究人员日益关心的内容。植物的枯枝落叶作用于土壤,形成了土壤有机物的重要来源,有利于改善土壤的物理和化学特性,而植物的蒸腾作用和减少雨水淋溶的效用可以适当改善土壤的pH值[2]。植物护坡的优良性能,有效增强了边坡稳定性,降低了边坡防护成本。在北方边坡防护过程中,应用广泛的树种——紫穗槐(Amorpha),其优良的繁殖能力、较大的落叶量、发达的根系、优良的抗污染能力,使其成为优良的固土护坡树种[3-4]。针对紫穗槐的研究,主要集中在正常生长情况下土壤含盐量的范围测定、紫穗槐抵抗单盐胁迫土壤含盐量临界值的测定,以及单盐胁迫下紫穗槐幼苗生理指标的变化等方面[5-9]。本研究以东北地区碱性盐的主要成分作为胁迫因素,对比研究单盐(Na2CO3、NaHCO3)和混合盐(Na2CO3、NaHCO3混合)胁迫对紫穗槐形态和生理指标的影响,旨在为紫穗槐在北方地区不同坡地应用提供数据支持。
1 材料与方法
从黑龙江省林木种苗示范基地,购进2年生紫穗槐幼苗,作为实验材料。于2011年4月至6月,在东北林业大学苗圃缓苗。
胁迫处理:于2011年7月初开始试验,做好自然降雨对紫穗槐胁迫浓度影响的阻断工作。设定10个实验组,每个实验组含有5株健康植株。各选3组分别进行不同浓度Na2CO3胁迫、NaHCO3胁迫和混合盐(Na2CO3、NaHCO3混合)胁迫,一组作为对照组(CK)。3种胁迫处理浓度均设为50、100、150 mmol·L-1,pH在8.48~11.31之间[10]。试验设计见表1。
胁迫初期,每隔3 d浇灌相同浓度500 mL的各种胁迫溶液。胁迫进行到21 d时,进行为期15 d的恢复实验;在36 d,开始再进行20 d的胁迫试验,并在胁迫10、20、35、45、55 d分别进行实验数据的采集。
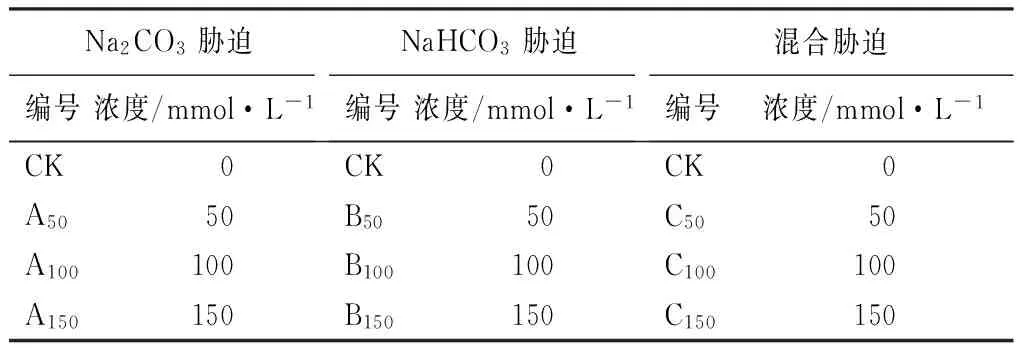
表1 胁迫试验设计
紫穗槐的形态测定:本实验参照王业遴[11]对木本植物的盐害症状调查方法,将盐害症状分5个等级(见表2)。在每次取样前,观察并记录各盐分胁迫对紫穗槐叶片形态的影响。

表2 盐害症状等级
紫穗槐生理指标的测定:分别在胁迫处理10、20、35、45、55 d时,剪取成熟叶片,带回实验室,进行电导率、丙二醛质量摩尔浓度、相对含水量、脯氨酸质量分数、可溶性糖质量分数测定。生理指标测定方法,参照文献[12]。
数据处理:采用Excel 2007软件进行数据处理和分析,用SPSS 16.0软件进行处理间差异显著性分析。
2 结果与分析
2.1 盐胁迫对紫穗槐形态的影响
胁迫初期10 d时,各盐分组成的各浓度胁迫对紫穗槐叶片外观均无改变性影响;胁迫20 d时,只有A150、B150两种处理出现个别叶片边缘黄化现象;说明短期的盐胁迫对紫穗槐的生长不能产生明显伤害。在35 d时,虽然进入恢复期,但是A100、C150两个浓度处理的紫穗槐植物受害的症状已经显现,出现叶片黄化和脱落;胁迫45 d时,高浓度单盐胁迫(A150和B150)对紫穗槐的叶片影响,表现出2级盐害症状胁迫持续到55 d时各浓度不同盐分胁迫盐害等级均升级,其中Na2CO3胁迫表象最重(见表3)。
从图1可见,紫穗槐盐害表象主要为:叶片黄化、焦枯、脱落;叶片黄化先从植株的老叶片开始,伴随胁迫浓度的增加,逐渐伤害到幼叶,幼叶的盐害症状从叶片边缘逐渐漫展至全叶。可见,低浓度碱性盐胁迫对紫穗槐叶片形态生长影响不大,在中浓度胁迫下伤害较轻,在高浓度单盐胁迫下症状明显。
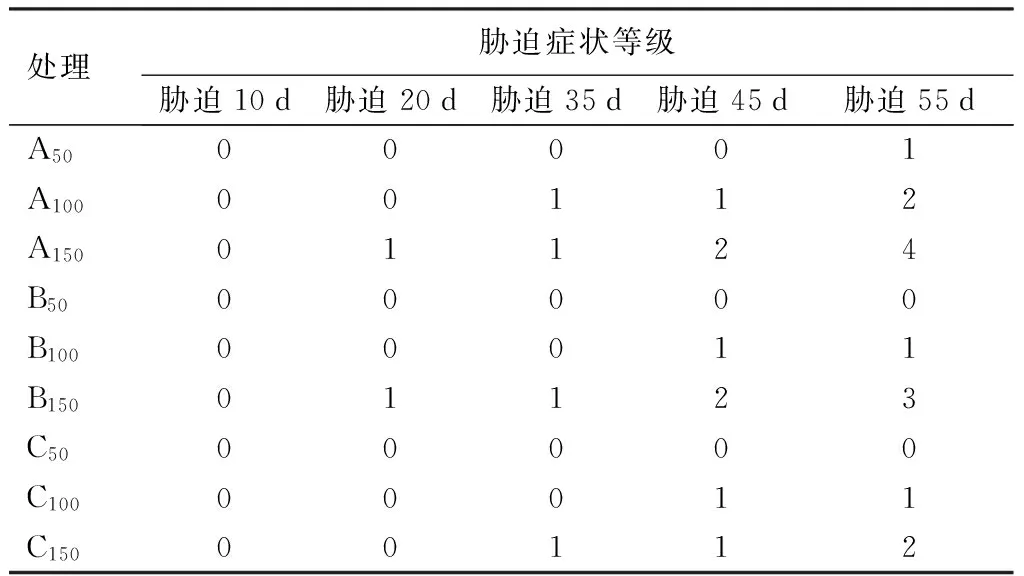
表3 紫穗槐胁迫症状统计
注:A为Na2CO3胁迫,B为NaHCO3胁迫,C为混合胁迫(Na2CO3和NaHCO3摩尔比为1∶1的混合溶液);50、100、150为处理液浓度(mmoL·L-1)。
2.2 盐胁迫对紫穗槐生理指标的影响
2.2.1 盐胁迫对叶片细胞膜透性的影响
由表4可知,胁迫初期,各盐分各浓度处理与CK,均无明显差异;胁迫20 d时,A150胁迫下的叶片相对电导率为CK的1.74倍(P<0.01),说明此处理已经对叶片的细胞膜造成伤害;恢复期,各盐分高浓度胁迫下,紫穗槐叶片的相对电导率均显著高于CK(P<0.05);从胁迫45 d开始,所有处理的紫穗槐叶片相对电导率均出现显著增加,显著高于CK(P<0.01),尤其是高浓度胁迫对细胞膜透性的影响较大,而且混合盐胁迫明显低于NaHCO3胁迫,更低于Na2CO3胁迫。可见,紫穗槐对低浓度的混合盐和NaHCO3胁迫具有较好适应力,在两者低浓度胁迫下紫穗槐可正常生长。
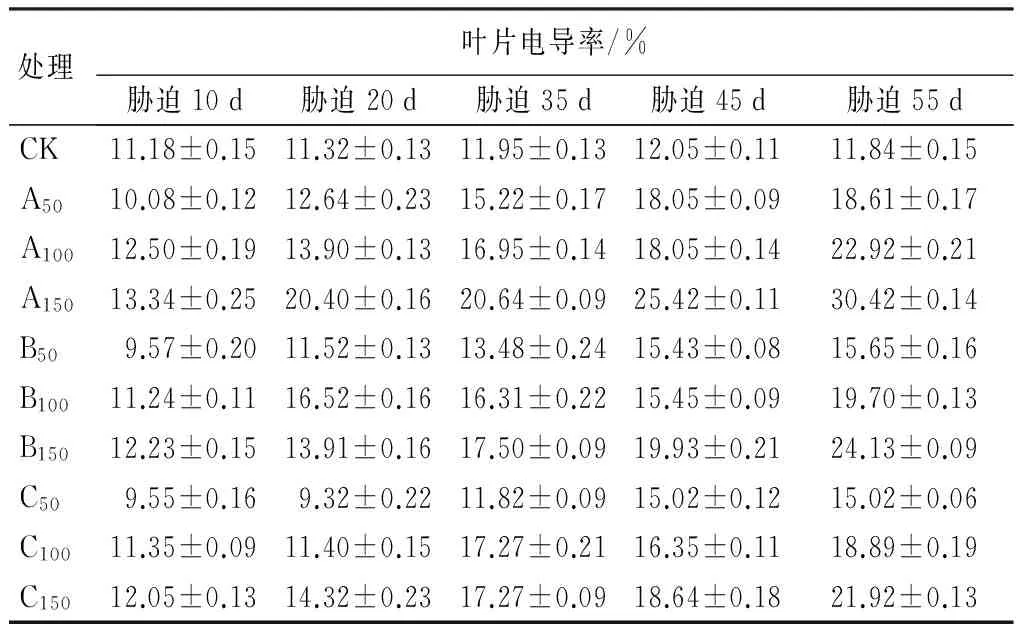
表4 Na2CO3、NaHCO3胁迫下紫穗槐叶片电导率的变化
注:表中数据为“平均值±标准差”。
2.2.2 盐胁迫对叶片丙二醛质量摩尔浓度的影响
丙二醛(MDA)作为植物受到胁迫时,发生膜质过氧化反应的最终分解产物,其含量的高低可以指示植物受胁迫程度的强弱。从表5可知,Na2CO3、NaHCO3胁迫下,紫穗槐叶片MDA质量摩尔浓度高于混合盐(Na2CO3和NaHCO3混合)胁迫。胁迫10 d,所有处理与CK无显著性差异(P>0.05);胁迫20 d时,高浓度处理下的MDA质量摩尔浓度明显增加(P<0.05);胁迫35 d时,中、高浓度的单盐胁迫处理极显著高于CK(P<0.01),混合盐的中低浓度胁迫对MDA质量摩尔浓度影响不显著。胁迫中后期(45 d和55 d),除B50、C50、C100以外,所有处理均极显著高于CK(P<0.01);尤其是A150在胁迫55 d时,MDA质量摩尔浓度是对照组的2.76倍,说明叶片细胞的膜质过氧化反应十分强烈。

A为Na2CO3胁迫,B为NaHCO3胁迫;150为处理液浓度(mmoL·L-1)。
表5 Na2CO3、NaHCO3胁迫下紫穗槐叶片MDA质量摩尔浓度的变化
注:表中数据为“平均值±标准差”。
2.2.3 盐胁迫对叶片含水量的影响
对紫穗槐叶片含水量的测定表明:在碱性盐胁迫下,从胁迫开始直至胁迫20 d,叶片含水量呈现上升的趋势,在20 d时各处理均达到最高值,此后逐渐下降(见表6);在35 d时,虽然在恢复期内,但是,各处理的叶片含水量均较胁迫初期有大幅下降的趋势。胁迫55 d时,A150、B150和C150均极显著低于CK(P<0.01),分别为CK的78.01%、81.94%、89.13%。
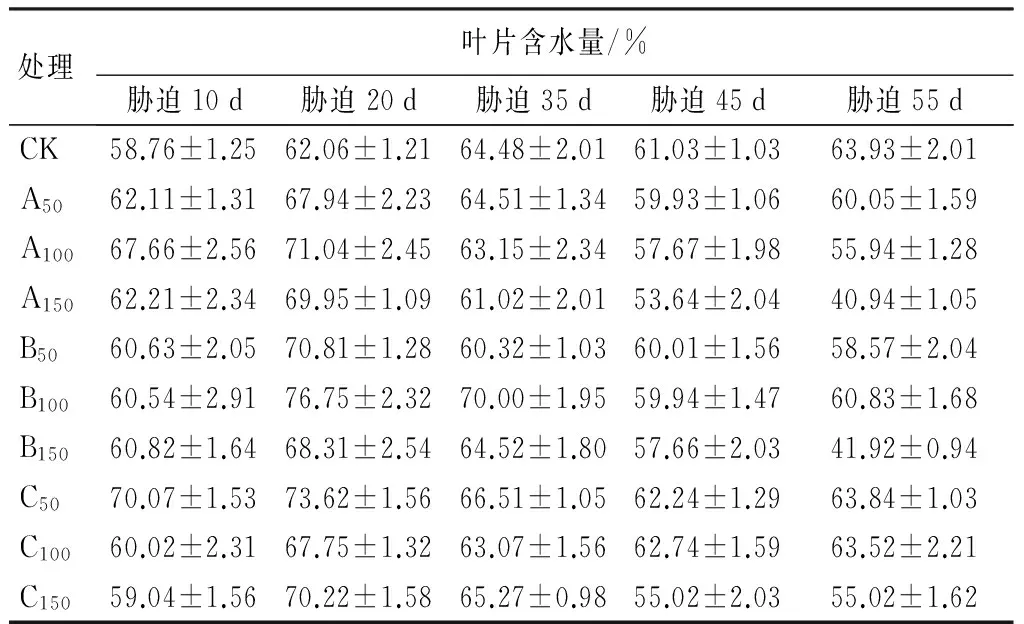
表6 Na2CO3、NaHCO3胁迫下紫穗槐叶片含水量的变化
注:表中数据为“平均值±标准差”。
2.2.4 盐胁迫对叶片脯氨酸质量分数的影响
植物体内的脯氨酸含量可以显示植物受到冻害、干旱或者盐碱胁迫的抗逆反应。由表7可见:在碱性盐胁迫下,紫穗槐叶片内脯氨酸随胁迫时间的延续迅速积累,逐渐增加。高浓度Na2CO3(A150)胁迫的紫穗槐叶片的脯氨酸质量分数,在各个阶段都明显高于同盐分的其他浓度胁迫。胁迫20 d时,只有C50、C100、B50处理与CK差异不显著(P>0.05);胁迫45 d时,各处理均与CK达到极显著差异水平(P<0.01);胁迫后期55 d,高浓度各盐分处理明显高于其他浓度,A150处理的脯氨酸质量分数为CK的4.81倍。
表7 Na2CO3、NaHCO3胁迫下紫穗槐叶片脯氨酸质量分数的变化
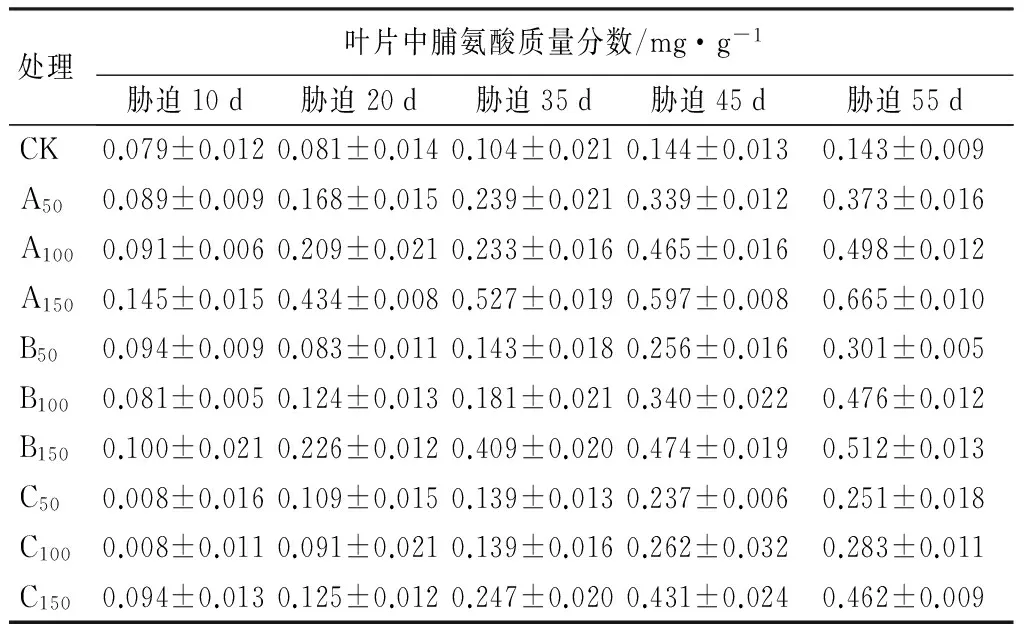
处理叶片中脯氨酸质量分数/mg·g-1胁迫10d胁迫20d胁迫35d胁迫45d胁迫55dCK0.079±0.0120.081±0.0140.104±0.0210.144±0.0130.143±0.009A500.089±0.0090.168±0.0150.239±0.0210.339±0.0120.373±0.016A1000.091±0.0060.209±0.0210.233±0.0160.465±0.0160.498±0.012A1500.145±0.0150.434±0.0080.527±0.0190.597±0.0080.665±0.010B500.094±0.0090.083±0.0110.143±0.0180.256±0.0160.301±0.005B1000.081±0.0050.124±0.0130.181±0.0210.340±0.0220.476±0.012B1500.100±0.0210.226±0.0120.409±0.0200.474±0.0190.512±0.013C500.008±0.0160.109±0.0150.139±0.0130.237±0.0060.251±0.018C1000.008±0.0110.091±0.0210.139±0.0160.262±0.0320.283±0.011C1500.094±0.0130.125±0.0120.247±0.0200.431±0.0240.462±0.009
注:表中数据为“平均值±标准差”。
2.2.5 盐胁迫对叶片可溶性糖质量分数的影响
由表8可知,各盐分胁迫后,紫穗槐叶片中的可溶性糖质量分数,随胁迫时间持续呈现逐渐累积。胁迫10 d,各处理或低于CK、或与之差异微小,说明初期胁迫影响到植物的糖代谢活动;从胁迫35 d开始,Na2CO3各浓度处理均大于CK,而中、低浓度的NaHCO3和混合盐处理的叶片可溶性糖质量分数无明显增加;胁迫55 d,低浓度的NaHCO3和混合盐处理叶片可溶性糖质量分数变化与CK趋同,说明低浓度的混合盐和NaHCO3处理对植物叶片可溶性糖质量分数的影响不大。
表8 Na2CO3、NaHCO3胁迫下紫穗槐叶片内可溶性糖质量分数的变化
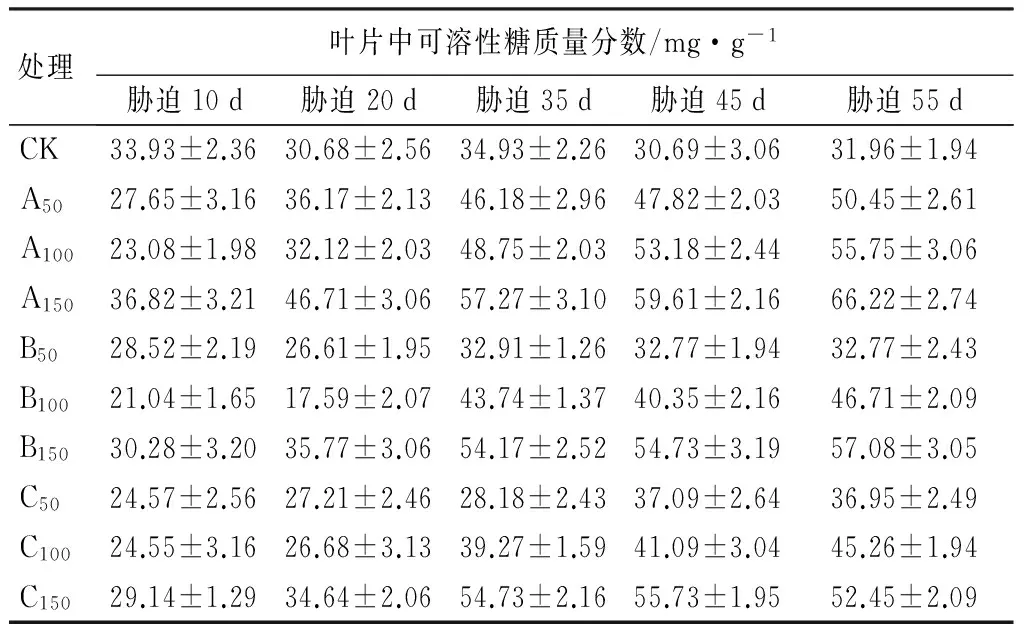
处理叶片中可溶性糖质量分数/mg·g-1胁迫10d胁迫20d胁迫35d胁迫45d胁迫55dCK33.93±2.3630.68±2.5634.93±2.2630.69±3.0631.96±1.94A5027.65±3.1636.17±2.1346.18±2.9647.82±2.0350.45±2.61A10023.08±1.9832.12±2.0348.75±2.0353.18±2.4455.75±3.06A15036.82±3.2146.71±3.0657.27±3.1059.61±2.1666.22±2.74B5028.52±2.1926.61±1.9532.91±1.2632.77±1.9432.77±2.43B10021.04±1.6517.59±2.0743.74±1.3740.35±2.1646.71±2.09B15030.28±3.2035.77±3.0654.17±2.5254.73±3.1957.08±3.05C5024.57±2.5627.21±2.4628.18±2.4337.09±2.6436.95±2.49C10024.55±3.1626.68±3.1339.27±1.5941.09±3.0445.26±1.94C15029.14±1.2934.64±2.0654.73±2.1655.73±1.9552.45±2.09
注:表中数据为“平均值±标准差”。
紫穗槐叶片内可溶性糖质量分数,随胁迫浓度的增加、胁迫时间的延长,呈不断上升的变化趋势,说明可溶性糖的积累可以增加细胞质浓度并降低细胞水势,从而有效抵御盐害。
2.2.6 各生理指标的相关性
由表9可知,紫穗槐叶片含水量与胁迫时间和盐分浓度呈极显著性负相关;电导率、MDA质量摩尔浓度、脯氨酸质量分数、可溶性糖质量分数,与胁迫时间和盐分浓度呈极显著性正相关;电导率,与含水量呈极显著性负相关,与MDA质量摩尔浓度、脯氨酸质量分数、可溶性糖质量分数呈极显著性正相关。这说明,在碱性盐胁迫下,叶片细胞的膜透性增加,膜质过氧化作用增强,代谢分解产物丙二醛增加,植物体内的渗透调节物质脯氨酸不断积累,以提高植物的抗御能力。
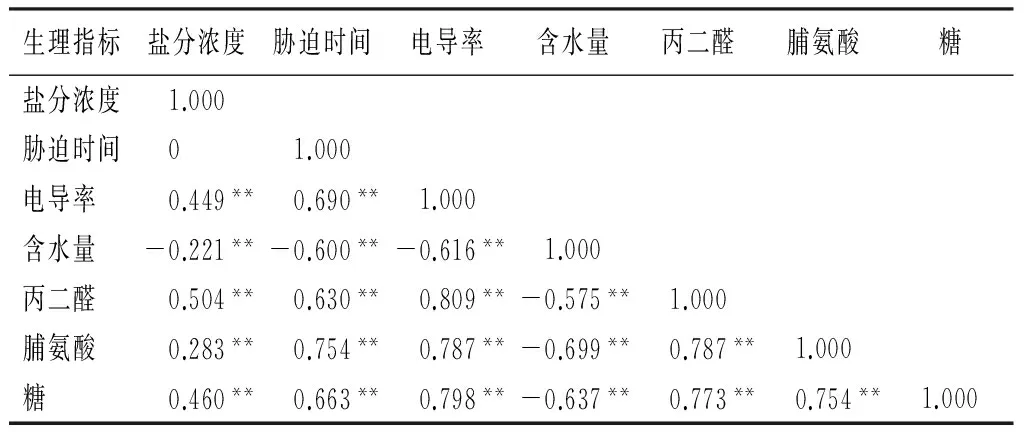
表9 紫穗槐各生理指标的相关性分析
3 结论与讨论
本研究中,紫穗槐形态变化和指标变化均反映出,单盐Na2CO3对植株的伤害程度明显高于NaHCO3和混合盐处理,紫穗槐能够适应中、低浓度混合盐分胁迫,其生长状况没有显著改变。而盐浸对紫穗槐的形态影响,主要症状表现为:叶片黄化、脱落、焦枯,基部老叶片受伤害表现要早于幼叶,叶片从边缘先出现发黄和褐斑,受害症状由叶缘向叶中脉延展。
生理指标研究表明:Na2CO3、NaHCO3各胁迫浓度对紫穗槐叶片电导率和MDA质量摩尔浓度影响较大,伴随胁迫时间持续影响加剧,说明单盐胁迫对紫穗槐叶片细胞质膜透性产生了危害,尤其是高浓度的单盐胁迫,即使在恢复期,叶片电导率和MDA质量摩尔浓度依然是上升趋势,说明碱性盐对紫穗槐胁迫20 d植物的质膜发生了不可恢复的改变。当紫穗槐遇到盐害威胁时,叶片中的渗透调节物质游离脯氨酸、可溶性糖质量分数与胁迫程度呈正比例关系。紫穗槐在盐胁迫下,植物叶片细胞内渗透式下降,体内渗透调节物质游离脯氨酸质量分数不断积累[13-14],可以降低细胞内渗透势,提高植物的吸水能力。这说明,紫穗槐自身具有抗逆能力。叶片含水量在混合盐和NaHCO3胁迫下,自由水丧失的程度低于Na2CO3胁迫,可见,紫穗槐的叶片含水量变化,也说明了紫穗槐对NaHCO3和混合盐胁迫的抵抗能力强于单盐Na2CO3胁迫。
另外,胁迫浓度也是影响紫穗槐生长的重要因素[15]。浓度为100mmol·L-1的Na2CO3胁迫20d,紫穗槐形态和生理指标开始发生显著变化;浓度为150mmol·L-1的NaHCO3胁迫35d时,紫穗槐的各项指标变化显著。可见,低浓度三种盐分胁迫,无论从形态,还是生理指标,均对紫穗槐无显著影响,混合盐对紫穗槐的伤害程度弱于单盐胁迫,植株的外部形态,最能直观地反映植株生长状态[16],体现植株的耐盐能力。张华新等[17]对日本丁香等11个树种、樊华[18]对连翘等15种园林绿化植物的耐盐性研究中,都表示植物在受到盐害时会出现不同等级的一系列枯黄、萎蔫等盐害症状。实验结果显示,只有高浓度的单盐超过30d的胁迫,才会严重影响紫穗槐的生长;说明,在盐害威胁下紫穗槐满足存活的要求,却无法满足景观需求。植物受到外界胁迫的影响,使其生理指标发生改变,从而表征在外部形态上,所以,形态变化是植物对环境胁迫的最直观的表现。
盐碱胁迫下,植物体内环境的pH值发生改变,植物受到不同程度的渗透胁迫伤害,渗透调节物质游离脯氨酸、可溶性糖以及各种矿物质的含量也将发生改变[19]。而参与细胞水分吸收的质膜透性也是反映植物受伤害程度的重要指标,胁迫初期,紫穗槐含水量受Na2CO3、NaHCO3影响小,有升高的趋势,是一种抵御胁迫的积极响应,这与张华新等[20]对紫穗槐幼苗生理特性研究中部分结论一致。紫穗槐对同种盐不同浓度处理,浓度越大,对生理的影响越显著;相同浓度不同种盐处理下,Na2CO3对植物伤害最大,NaHCO3次之,混和盐的最小,此结果与胡枝子、沙棘等实验结果相同[17];可以推测,Na2CO3对植物伤害最大。本研究对紫穗槐生理指标的测定,没有对植株抗氧化酶指标进行检测,尚需了解在盐浸胁迫下紫穗槐膜脂过氧化危害程度。
[1] 马彪,衣俊国.黑龙江省土壤盐渍化敏感性分析[J].环境科学与管理,2011,36(5):133-135,146.
[2] 李春艳,李秀蓉.黑龙江省土壤形成的生物气候条件与土壤地带性分布规律研究[J].哈尔滨师范大学自然科学学报,1992,8(1):96-103.
[3] 王印川.紫穗槐及其经济利用价值[J].山西水土保持科技,2003(1):21-23.
[4] 姜永诰.发展紫穗槐产业的分析[J].安徽农业科学,2007,35(1):98,151.
[5] 王淑芳,李艳敏,王耀虹.盐碱地园林绿化优良树种:紫穗槐[J].河北林业,2008(4):20.
[6] 闫永庆,朱虹,刘兴亮,等.盐胁迫对紫穗槐生长发育及生理特性的影响[J].东北农业大学学报,2008,39(12):31-35.
[7] 师爱华.Na2SO4盐胁迫对紫穗槐酶活性的影响[J].山西林业科技,2009,38(2):16-18,21.
[8] 邹丽娜,周志宇,颜淑云,等.盐分胁迫对紫穗槐幼苗生理生化特性的影响[J].草业科学,2011,20(3):84-90.
[9] 周丽,李鲁华,张伟,等.咸水灌溉对紫穗槐生长及生理特性的影响[J].新疆农业科学,2010,47(7):1280-1287.
[10] 石伟.极端盐碱土壤细菌的分离筛选及抗盐碱特性研究[D].哈尔滨:东北林业大学,2011.
[11] 王业遴,马凯,姜卫兵,等.五种果树耐盐力试验初报[J].中国果树,1990(3):8-12.
[12] 李合生.植物生理生化实验原理和技术[M].北京:高等教育出社,2000.
[13] Delauney A J, Verma D P S. Proline biosynthesis and osmoregulation in plants[J]. The Plant Journal,1993,4(2):215-223.
[14] 倪建伟,武香,张华新,等. 3种白刺耐盐性的对比分析[J].林业科学研究,2012,25(1):48-53.
[15] Jithesh M N, Prashanth S R, Sivaprakash K R, et al. Antioxidative response mechanisms in halophytes: their role in stress defence[J]. Journal of Genetics,2006,85(3):237-254.
[16] Kozlowski T T. Responses of woody plants to flooding and salinity[J]. Tree Physiology Monograph,1997,1(1):1-29.
[17] 张华新,刘正祥,刘秋芳.盐胁迫下树种幼苗生长及其耐盐性[J].生态学报,2009,29(5):2263-2271.
[18] 樊华.15种常见园林绿化植物的耐盐性研究[D].重庆:西南大学,2007.
[19] 赵建诚,秦柱南,孙超,等.紫穗槐种子萌发对盐旱逆境的生理响应[J].种子,2012,31(5):26-29.
[20] 薛菲,王竞红,王磊.胡枝子对盐碱胁迫的生理响应[J].东北林业大学学报,2012,40(12):47-50,55.
Morphology and Physiological Response of Amorpha under Three Kinds of Alkaline Salt Stress/
Jiang Yuanfang, Wang Jinghong, Xue Fei
(Northeast Forestry University, Harbin 150040, P. R. China)//Journal of Northeast Forestry University.-2014,42(8).-30~33,64
According to the changes of pH values in soil slope soil in northeast area, with different contents of Na2CO3, NaHCO3, and two mixed combination, we studied the artificial simulated stress on the seedlings of two-year Amorpha, through leaf appearance and physiological index, comparison of different influence on Amorpha under different contents of salt stress. The most obvious victims representation for Amorpha leaves is in 150 mmol·L-1of Na2CO3and NaHCO3after 45 days with a lot of yellow and falling off leaves. Conductivity, MDA, proline, soluble sugar content in Amorpha leaves and the degree of stress, time were positively correlated. Leaf relative water content was negatively correlated with the degree of stress. The of Amorpha was with the most obvious change under 150 mmol·L-1of Na2CO3.
Amorpha; Salt injury symptoms; Leaf appearance; Physiological indicators
江远芳,女,1988年4月生,东北林业大学园林学院,硕士研究生。E-mail:1137921116@qq.com。
王竞红,东北林业大学园林学院,副教授。E-mail:jinglife26@126.com。
2014年5月21日。
S715.3
1) 中央高校基本科研业务费专项资金(2572014CA27)。
责任编辑:张 玉。
