杨树授粉亲和性与雌蕊生理生化变化的关系1)
2014-08-02周骏辉荆艳萍
张 鹏 周骏辉 荆艳萍
(北京林业大学,北京,100083)
杨树授粉亲和性与雌蕊生理生化变化的关系1)
张 鹏 周骏辉 荆艳萍
(北京林业大学,北京,100083)
对杨树不同亲和性授粉过程中(加杨×加杨,加杨×银腺杨)花粉的萌发及花粉管的伸长进行了荧光染色观察,并对雌蕊的内源性激素及保护性酶的含量进行分析。结果表明,加杨×银腺杨授粉后花粉管伸长明显慢于加杨×加杨,同时,授粉均引发了柱头保护性酶SOD和POD的波动,但两种授粉所引发的酶活性变化不同,加杨×加杨授粉后SOD活性升高要早于加杨×银腺杨,而加杨×银腺杨授粉后POD活性在增加过程中有下降的变化。加杨×加杨授粉后雌蕊内源激素生长素(IAA)、赤霉素(GA3)及玉米核苷素(ZR)等质量分数要高于加杨×银腺杨,而ABA质量分数远低于加杨×银腺杨。结果表明,SOD活性的延迟升高,低水平的IAA、GA3、ZR以及高水平的ABA可能对授粉后花粉管的伸长起抑制作用,是引发杨树杂交授粉不亲和性的原因之一。
杨树;杂交授粉;内源激素;保护性酶
授粉是大部分植物进行繁衍的前提,花粉与柱头接触后,主要经过花粉萌发和花粉管伸长这两个阶段,并最终到达胚珠和胚囊[1],这一过程受到多种酶的调节[2]。在甘蓝(Brassicaoleracea)[3]、百合(Lilium)[4]、苹果(Malusdomestica)[5]、郁金香(Tulipa)[6]等植物中,均发现SOD、POD等保护性酶在授粉过程中含量发生明显变化,并且授粉亲和性品种与不亲和性品种中,上述酶的变化趋势也存在差异。此外,花粉管的生长与花柱中内源激素的变化相关[7]。梨属植物授粉后,杂交亲和性授粉的花柱内激素变化与自花不亲和授粉的花柱不同[8],亲和性授粉花柱中促进生长的激素如IAA、GA3、ZR等含量均高于不亲和授粉的花柱,而ABA含量显著低于不亲和授粉的花柱。杨晓苓等[4]也认为高水平的ABA与杂交不亲和授粉机理相关。
杨树派间杂交育种过程中存在严重的杂交不亲和现象,主要表现为授粉后花粉萌发率低或花粉管生长缓慢、花粉管在柱头上表现异常,扭曲、盘绕、爬行等现象[9],而有关杨树杂交授粉不亲和性机制的研究尚不多见。本研究主要探究不同亲和性杨树授粉后花柱内的保护性酶及激素含量的变化,以期阐明保护性酶及内源激素与杨树杂交授粉不亲和性的关系,进而为杨树杂交育种工作提供理论基础。
1 材料与方法
以雌性加杨(北京林业大学校区)为母本,雄性加杨(北京林业大学校区)和银腺杨(山东冠县苗圃)为父本。在2012年2月上旬采集发育良好带有花芽的枝条,于温室水培。雄蕊成熟前1周套袋收集花粉,花粉储藏在冰箱中-20 ℃保存。雌蕊柱头长出后观察可授性。对处于可授期的雌蕊进行人工授粉,分2种组合进行:加杨×加杨、加杨×银腺杨。在授粉后1、2、5、10、24和48 h时间段分别取雌蕊,一部分放入FAA固定液用于观察花粉管伸长情况,另一部分于冰箱-80 ℃保存。
1.1 授粉后不同时期花粉管行为的荧光观察
分批水培雌性加杨枝条,当雌蕊进入最佳可授期之后进行人工授粉。并于授粉后1、2、5、10、24和48 h分时间段收集样品,每个时间段加杨和银腺杨授粉的雌蕊各取若干,以FAA固定液固定2 h以上,转移到70%酒精之中保存,用蒸馏水清洗3次,每次3 min,以洗去固定液。将花柱从雌蕊上剪下,然后用5mol/L氢氧化钠解离40 min,蒸馏水冲洗数次,再用0.1%水溶性苯胺蓝避光染色20 min并压片。在荧光显微镜下用紫外光激发,观察花粉萌发和花粉管伸长情况,并照相记录。
1.2 雌蕊中保护性酶和激素含量的测定
分批水培雌性加杨枝条,当雌蕊进入最佳可授期后进行人工授粉,并收集未授粉及授粉后1、2、5、10、24和48 h的雌蕊,每个时间段加杨和银腺杨授粉的雌蕊各0.5 g,液氮冷冻后转移到冰箱中-80 ℃保存,重复3次。超氧化物歧化酶(SOD)测定采用氮蓝四唑(NBT)光还原法,过氧化物酶(POD)测定采用愈创木酚法[10]。应用酶联免疫(ELISA)方法测定雌蕊柱头四种激素——生长素(IAA)、赤霉素(GA3)、玉米核苷素(ZR)和脱落酸(ABA)的含量[11]。激素试剂盒及酶标板购自中国农业大学,各时期样品激素测定重复3次,取平均值。
2 结果与分析
2.1 授粉后花粉在雌蕊上的生长动态
加杨×加杨和加杨×银腺杨两种组合授粉后不同时间段的花粉萌发和花粉管伸长情况如图1所示。授粉后1和2 h两种授粉组合均没有大量花粉萌发。授粉后5 h,加杨授粉的花粉已经萌发,花粉管伸长到一定长度;银腺杨授粉的花粉也已经萌发,但花粉管伸长长度较短。授粉后10 h,加杨授粉的花粉管继续伸长,长度约到达整个花柱的1/2处;银腺杨的花粉管伸长速度较慢,长度约到整个花柱的1/4处。授粉后24 h,加杨授粉的花粉管伸长到接近花柱的末端;银腺杨的花粉管伸长到整个花柱的1/2处。授粉后48 h(此时两组授粉的柱头都已经萎蔫),加杨授粉的花粉管穿越花柱到达子房;银腺杨的花粉管则停止伸长(或者伸长速度很慢),仍然停留在整个花柱的1/2处。
2.2 授粉后雌蕊保护性酶的含量变化
2.2.1 超氧化物歧化酶(SOD)活性变化
人工授粉加杨和银腺杨花粉后,加杨雌蕊中SOD活性变化如表1所示。雌蕊进入最佳可授期时,即未授粉时SOD活性最大,授粉后SOD活性开始下降。在加杨授粉后2 h SOD活性开始上升,到授粉后5 h达到一个峰值之后SOD活性缓慢下降。

表1 人工授粉后雌蕊中SOD活性变化
注:表中数据为“平均值±标准差”。
银腺杨授粉后直到5 h SOD活性才停止下降,此时花粉管的长度较短。授粉后5~10 h,SOD活性开始上升并达到一个峰值,之后SOD活性急剧下降,至授粉后24 h后,SOD活性下降趋势较平稳,但SOD活性已处于较低水平。
除授粉后2 h和授粉后10 h的部分时间里加杨授粉的雌蕊柱头SOD活性低于银腺杨授粉组合外,其余时间均是加杨×加杨的SOD活性高于加杨×银腺杨授粉组合。
2.2.2 过氧化物酶活性变化
人工授粉加杨和银腺杨花粉后雌蕊中POD活性变化如表2所示。未授粉前雌蕊中POD活性很低,授粉后加杨和银腺杨的POD活性均显著上升。授粉后2~5 h,加杨的POD上升趋势减缓,而此时花粉开始萌发,花粉管快速伸长。授粉后5~24 h,POD活性再次急剧上升。

表2 人工授粉后雌蕊中POD活性变化
注:表中数据为“平均值±标准差”。
银腺杨授粉后雌蕊柱头POD活性在授粉后5~10 h开始缓慢下降,此时为银腺杨花粉管的快速生长期。授粉后10~24 h,POD活性也急剧上升。
加杨和银腺杨授粉后雌蕊柱头POD活性变化除授粉后2~10 h有显著差异外,其余时间变化趋势基本一致。
2.3 授粉后花柱内源激素质量分数变化
2.3.1 IAA、GA3及ZR质量分数变化
如表3—表5所示,加杨×加杨授粉组合雌蕊中IAA质量分数在授粉2 h内未发生明显变化,2~10 h迅速升高,而后在10~48 h发生回落。加杨×银腺杨组合在授粉后2 h内IAA质量分数有一定上升,2~10 h急剧下降并持续稳定。

1~6为加杨授粉后1、2、5、10、24、48 h花粉在雌蕊上的发育过程,7~12为银腺杨授粉后1、2、5、10、24、48 h花粉在雌蕊上的发育过程。
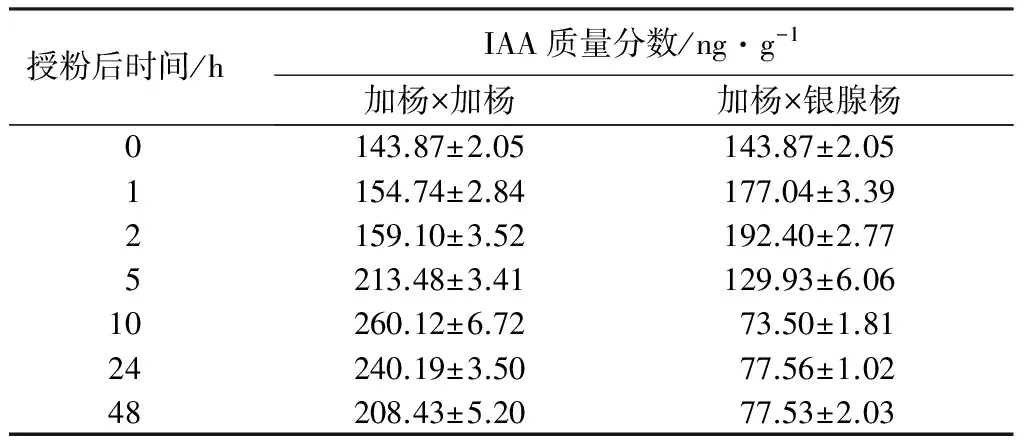
授粉后时间/hIAA质量分数/ng·g-1加杨×加杨加杨×银腺杨0143.87±2.05143.87±2.051154.74±2.84177.04±3.392159.10±3.52192.40±2.775213.48±3.41129.93±6.0610260.12±6.7273.50±1.8124240.19±3.5077.56±1.0248208.43±5.2077.53±2.03
注:表中数据为“平均值±标准差”。
加杨×加杨和加杨×银腺杨雌蕊在授粉后GA3变化趋势基本相同,均为24 h内略有下降,而24~48 h迅速上升并高于初始未授粉柱头GA3水平。但在整体变化过程中,加杨×银腺杨GA3质量分数一直低于加杨×加杨授粉组合。
加杨×加杨授粉组合ZR质量分数在授粉后稳定上升,但上升幅度不大,并于24~48 h内出现一定程度的下滑。而加杨×银腺杨ZR质量分数在授粉后1 h之内有一定上升,2~5 h迅速下降,并在之后的时间内持续下降。
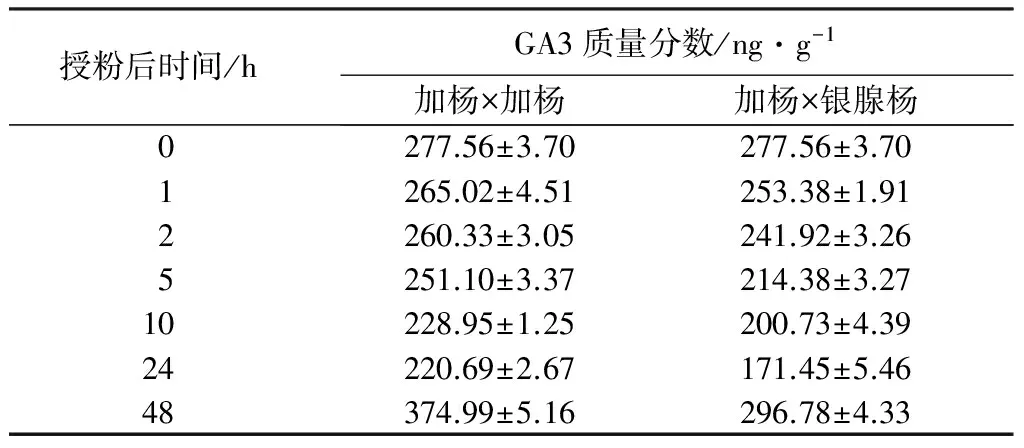
表4 杨树雌蕊中GA3质量分数变化
注:表中数据为“平均值±标准差”。
整体来看,不同授粉组合的上述3种激素在雌蕊中质量分数的改变趋势有所差别,但加杨×加杨授粉后3种激素质量分数均整体高于加杨×银腺杨。
2.3.2 脱落酸(ABA)质量分数变化
如表6所示,两种授粉组合柱头内ABA含量变化与IAA、GA3及ZR3种激素质量分数变化完全相反。在授粉初始阶段,加杨×银腺杨雌蕊柱头ABA质量分数便迅速升高,直至5 h后达到顶点,之后持续下落。而加杨×加杨ABA质量分数在2 h内呈现小幅波动,2~48 h持续下落至最低点。总体上看,加杨×加杨ABA质量分数始终远低于加杨×银腺杨授粉组合,且呈现整体下落趋势。
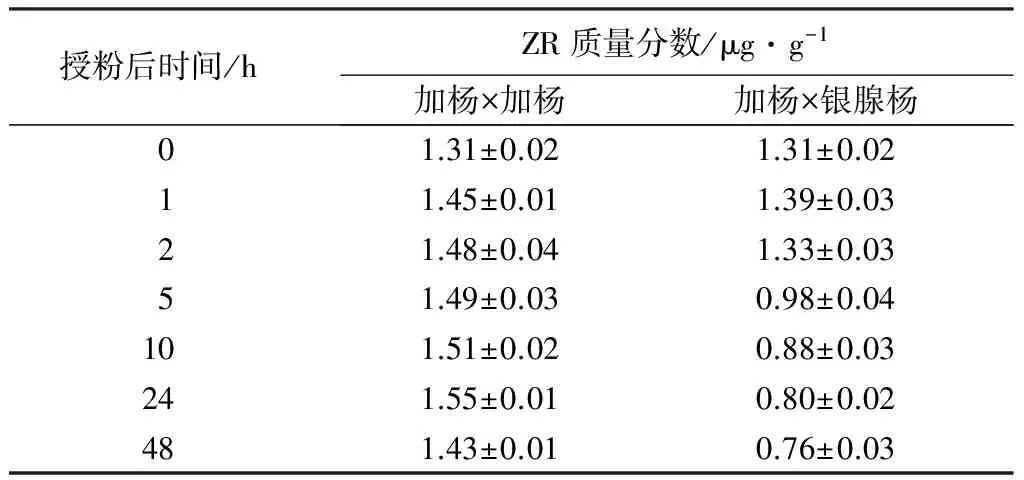
表5 杨树雌蕊中ZR质量分数变化
注:表中数据为“平均值±标准差”。

表6 杨树雌蕊中ABA质量分数变化
注:表中数据为“平均值±标准差”。
2.3.3 授粉后雌蕊(IAA+GA3+ZR)/ABA变化
为了进一步对比不同授粉组合中柱头内源激素的变化关系,计算授粉后不同时间的雌蕊(IAA+GA3+ZR)/ABA比值如表7。在整个授粉过程中,加杨×加杨雌蕊(IAA+GA3+ZR)/ABA含量明显高于加杨×银腺杨,两者之间的差异从2 h之后开始逐渐增大。
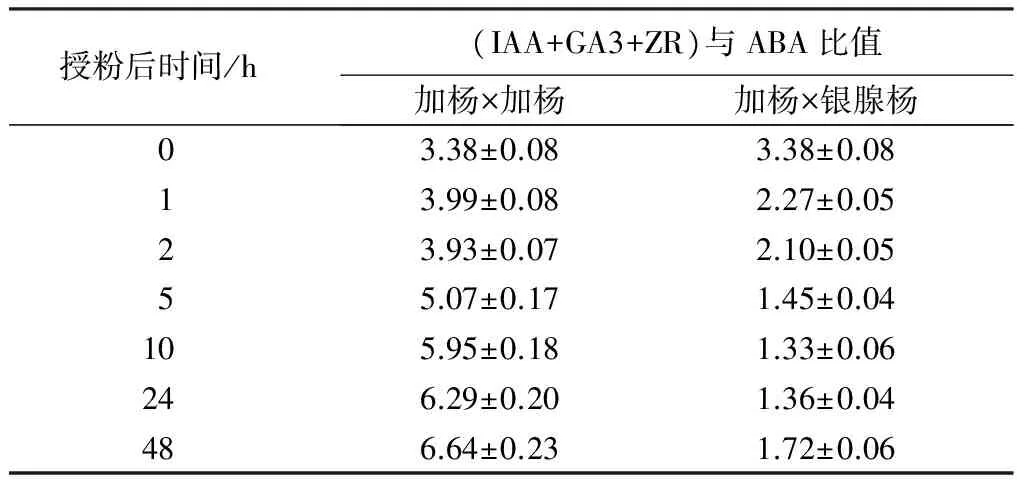
表7 杨树雌蕊中(IAA+GA3+ZR)/ABA比值的变化
注:表中数据为“平均值±标准差”。
3 结论与讨论
本研究中,加杨×加杨授粉后花粉管延伸顺利,速度快,而加杨×银腺杨授粉后花粉管延伸不畅,延伸速度慢且最终停滞于整个花柱的1/2附近。研究表明,授粉可以引发SOD和POD的活性变化,高水平的SOD和POD有利于亲和花粉与柱头的识别、黏附和萌发。百合授粉3 h内,亲和性授粉的酶活性高于不亲和性授粉的酶活[4]。本研究中,授粉后SOD和POD活性呈现波动,并且加杨×加杨与加杨×银腺杨授粉后两种酶的变化趋势不同。SOD活性在花粉识别阶段下降,而在花粉管快速伸长时上升,但加杨×加杨授粉后SOD活性要先于加杨×银腺杨上升。当花粉管延伸减缓时,SOD活性下降,并且加杨×加杨SOD活性也先于加杨×银腺杨下降。上述结果表明,较高活性的SOD利于花粉的生长。可能与花粉快速生长需要消耗大量的氧[12],而线粒体在有氧代谢过程中会产生超氧阴离子自由基[13],超氧阴离子自由基的清除需要SOD有关。
POD的活性在加杨和银腺杨的授粉试验中均呈现整体上升趋势。但在加杨×银腺杨授粉后POD有一个明显的上升后下降的过程,由于POD也是一种细胞壁酶[2],它参与细胞壁内结构蛋白,果胶和半纤维素的交联反应,从而使细胞壁硬化,控制细胞的生长速度。加杨×银腺杨授粉后期POD活性下降,可能与其花粉管生长受到抑制有关。
植物内源激素和其他信号分子一起通过复杂的相互作用决定细胞的命运,与植物花粉的萌发、花粉管生长、授粉受精过程密切相关[14-15]。在实验室条件下,一定质量分数的IAA及GA3可以促进花粉萌发及花粉管的伸长[16]。齐国辉等[8]在对鸭梨花柱的研究中认为高水平的IAA、ZR和GA3均有利于花粉的萌发和正常的受精作用。烟草花柱中的IAA含量最高时,柱头上花粉可以大量萌发[17]。许明等[18]在对紫菜薹的研究中认为低水平的IAA、GA3及ZR诱发了自交授粉不亲和过程的不结实效应。白杨杂交实验中也发现低水平的IAA与花粉的变形扭曲有关[14]。本研究结果表明,加杨×加杨雌蕊柱头中的IAA,GA3及ZR等激素水平相比加杨×银腺杨处于较高的水平,表明高质量分数的IAA、GA3及ZR等参与了花粉与柱头的应答,诱导并促进了花粉的萌发。而加杨×银腺杨中由于IAA、GA3及ZR等激素水平较低,一定程度上抑制了花粉管的伸长,低水平的IAA、GA3及ZR诱发了杨树杂交授粉的不亲和现象。这与前人关于自交授粉不亲和机制研究中的相关结果一致[8]。Lewis和Crowe等人曾提出:种间杂交不亲和与自交不亲和具有很多相似性[19],我们的结果也印证了这一点。
高水平的ABA是花粉萌发及伸长过程中的不利因素,能够引起种间不亲合授粉后杨树花的脱落[20],也是矮牵牛授粉不亲和的原因[21]。ABA也被发现能够抑制花粉的体外萌发[16]。本实验中测得授粉不亲和样本雌蕊柱头ABA质量分数远高于亲和样本,也说明高浓度的ABA可能是抑制杂交不亲和授粉雌蕊柱头花粉伸长的原因之一。
(IAA+GA3+ZR)/ABA的比值较低是一些物种自交不亲和授粉后的特点[8],我们对实验中两种授粉组合雌蕊柱头的(IAA+GA3+ZR)/ABA进行计算,发现杂交不亲和样品的(IAA+GA3+ZR)/ABA远低于亲和授粉样品,说明4种内源激素之间量的变化关系与杂交不亲和授粉后花粉的萌发与伸长具有一致性,较低的(IAA+GA3+ZR)/ABA是杨树杂交不亲和性产生的原因之一。
[1] 孟金陵.植物生殖遗传学[M].北京:科学出版社,1995.
[2] 郭云,支崇远,赵宇中.显花植物受精早期阶段的酶作用[J].种子,2007,26(2):45-48.
[3] 吴能表,徐光德,唐于婷,等.自交不亲和甘蓝的花粉萌发与花柱内保护酶活性变化[J].西南师范大学学报:自然科学版,2004,29(5):848-851.
[4] 杨晓苓,杨利平,尚爱芹,等.百合授粉亲和性与雌蕊中保护酶和激素的关系[J].园艺学报,2009,36(6):855-860.
[5] 张雪梅,李保国,赵志磊,等.苹果自花授粉花粉管生长和花柱保护酶活性与内源激素含量的关系[J].林业科学,2009,45(11):20-25.
[6] 王彩霞,欧阳彤,姜彦成,等.郁金香授粉后雌蕊生理生化变化的初步研究[J].林业科学研究,2010,23(4):622-625.
[7] Wu J, Qin Y, Zhao J. Pollen tube growth is affected by exogenous hormones and correlated with hormone changes in styles inToreniafournieriL[J]. Plant Growth Regulation,2008,55(2):137-148.
[8] 齐国辉,徐继忠,张玉星.鸭梨自交不亲和性与花柱内源激素关系的研究[J].河北农业大学学报,2007,30(1):31-34.
[9] 张金凤,朱之悌,张志毅.黑白杨派间杂交试验研究[J].北京林业大学学报,1999,21(1):6-10.
[10] 李合生.植物生理生化实验原理和技术[M].北京:高等教育出版社,2000.
[11] 李宗霆,周燮.植物激素及其免疫检测技术[M].南京:江苏科学技术出版社,1996.
[12] Tadege M, Kuhlemeier C. Aerobic fermentation during tobacco pollen development[J]. Plant Molecular Biology,1997,35(3):343-354.
[13] Rasmusson A G, Heiser V, Zabaleta E, et al. Physiological, biochemical and molecular aspects of mitochondrial complex I in plants[J]. Biochimica et Biophysica Acta,1998,1364(2):101-111.
[14] Ma K, Song Y, Huang Z, et al. The low fertility of Chinese white poplar: dynamic changes in anatomical structure, endogenous hormone concentrations, and key gene expression in the reproduction of a naturally occurring hybrid[J]. Plant Cell Reports,2013,32(3):401-414.
[15] Mesejo C, Yuste R, Martínez Fuentes A, et al. Self-pollination and parthenocarpic ability in developing ovaries of self-incompatibleClementinemandarins(Citrus clementina)[J]. Physiol Plant,2013,148(1):87-96.
[16] 张绍铃,高付永,陈迪新,等.植物生长调节物质对丰水梨花粉萌发和花粉管生长的影响[J].西北植物学报,2003,23(4):586-591.
[17] Chen D, Zhao J. Free IAA in stigmas and styles during pollen germination and pollen tube growth ofNicotianatabacum[J]. Physiologia Plantarum,2008,134(1):202-215.
[18] 许明,白明义,魏毓棠.紫菜薹细胞质雄性不育系及其保持系在不同发育时期内源激素的变化[J].西北农业学报,2007,16(3):124-127,135.
[19] Lewis D, Crowe L K. Unilateral interspecific incompatibility in flowering plants[J]. Heredity,1958,12(2):233-256.
[20] Label P, Imbault N, Villar M. ELISA quantitation and GC-MS identification of abscisic acid in stigma, ovary and pedicel of pollinated poplar flowers (PopulusnigraL.)[J]. Tree Physiology,1994,14(5):521-530.
[21] Kovaleva L, Zakharova E. Hormonal status of the pollen-pistil system at the progamic phase of fertilization after compatible and incompatible pollination inPetuniahybridaL[J]. Sexual Plant Reproduction,2003,16(4):191-196.
Relationship Between Physiological and Biochemical Changes in Pistil and Pollination Compatibility of Poplar/Zhang Peng, Zhou Junhui, Jing Yanping
(Beijing Forestry University, Beijing 100083, P. R. China)//
Journal of Northeast Forestry University.-2014,42(6).-11~14,33
We obsevered pollen germination and pollen tube growth after pollinations (PopulusCanadensisMoench×P.CanadensisMoench andP.canadensisMoench×P.alba×P.glandulosa) with a fluorescence microscope, and analyzed the content of endogenous hormones and protective enzymes of pistils. The pollen tubes ofP.canadensisMoench×P.alba×P.glandulosasamples grow significantly slower than that of theP.canadensisMoench×P.canadensisMoench, and different pollination combination initiated the coordinated variation of content of protective enzymes and endogenous hormones in pistil. The SOD activity inP.canadensisMoench×P.canadensisMoench increases earlier than that ofP.canadensisMoench×P.alba×P.glandulosa, whereas, the POD activity of the latter shows a downward change during the process of ascent. Hormones including IAA, GA3 and ZR are higher inP.canadensisMoench×P.canadensis, while the ABA content is much lower than that inP.canadensisMoench×P.alba×P.glandulosa. The delay of SOD activity increase, the low contents of IAA, GA3, ZR and high concent of ABA are possible reasons on leading to cross-pollination incompatibility of poplar.
Poplar; Cross-pollination; Endogenous hormones; Protective enzymes
1) 国家自然科学基金(30700636)资助。
张鹏,男,1986年12月生,北京林业大学生物科学与技术学院,硕士研究生。
荆艳萍,北京林业大学生物科学与技术学院,副教授。E-mail:ypjing@bjfu.edu.cn。
2013年8月14日。
S718.43
责任编辑:潘 华。
