刺槐苗木抗氧化保护系统对石油污染的响应
2014-08-02李凯荣崔碧霄
王 波,李凯荣,崔碧霄,韩 刚
(1.西北农林科技大学 资源环境学院,陕西 杨凌712100;2.西北农林科技大学 林学院,陕西 杨凌712100)
陕北已经成为我国重要的石油开采基地之一,然而石油开采、冶炼和运输过程中的污染和泄露问题已经对当地脆弱的生态环境造成巨大威胁。石油污染可引起土壤孔隙堵塞,改变土壤有机质的组成结构和微生物区系,并对植物生长和生产力产生影响。与此同时,石油中的有害物质可在植物体内积累,并通过食物链对动物和人类产生危害。鉴于石油污染的上述威胁,对污染土壤进行修复已经成为一个亟待解决的环境问题。相对于其他土壤修复方法,植物修复由于具有成本低、无二次污染、吸收污染物量大、环境友好等诸多优点,逐渐成为去除土壤石油污染的首选手段[1]。然而,目前大多数针对石油污染土壤修复植物的研究仅限于考虑草本植物和农作物的生长指标或根际降解能力对土壤石油烃的去除作用,如时腾飞等[2]研究了石油污染对豆科牧草发芽和幼苗生长的潜在影响,并据此筛选出毛苕子(Viciavillosa)等适于在石油污染区播种且生长良好的灌草种,陈嫣等[3]则研究了紫花苜蓿(Medicagosativa)、披碱草(Elymusdahuricus)根际微生态效应对石油污染的去除效果。此外,尚有关于大麦(Hordeumvulgare)[4]和三叶草(Trifoliumrepens)等草本植物根系降解石油能力的众多研究。而由于在陕北地区特别是一些老油井区普遍存在先垫土覆盖后进行植被恢复的现象,草本植物和农作物受到根系长度限制,对地下石油污染的修复效果十分有限。在此情况下,筛选适宜在石油污染地区生长并等具有修复石油污染潜能的木本树种是非常必要的。目前,仅有Spriggs等[5]研究了白杨(Populustomentosa)等树种对根际土壤石油污染去除的作用,关于陕北石油污染区适生乔木树种则少见报道,关于树种在石油污染下的生理特征特别是抗氧化保护系统的响应研究尤为不足。
刺槐(Robiniapseudoacacia)是陕北地区植被恢复和重建的主要树种之一,耐干旱瘠薄,在该地区表现出较强的适应性和抗逆性。而因其具有根系发达、生物量大的特点,能够穿透覆土层对污染土壤进行修复,具有更强的吸收、降解土壤石油的潜力。对石油污染刺槐抗氧化保护系统的响应进行研究能更为深刻地反映其对石油污染的耐受能力,且较之生长指标更为灵敏[6]。据此,本研究采用盆栽试验对不同浓度石油污染下,较长时期内刺槐苗木的抗氧化保护系统对土壤石油污染的响应特征进行研究,以期阐明石油污染下刺槐苗木抗氧化保护调节适应机制,确定其对石油污染的耐受能力,为筛选适宜陕北地区的木本石油污染修复植物提供理论依据。
1 材料与方法
1.1 试验地概况
盆栽试验设在陕西杨凌西北农林科技大学苗圃,当地属暖温带半湿润大陆性季风气候,海拔454.5m,年均日照数2 150h,年均降水635mm,年平均湿度70%左右。年平均气温12.9℃,≥10℃年有效积温4 169.2℃,无霜期221d。
1.2 试验材料及处理
试验苗木(长势基本一致的1年生刺槐苗)及供试原油购自安塞县。栽培基质采集自陕北安塞县人为活动稀少的荒草地表层(0—20cm)无污染土壤,其有机质含量8.45g/kg,全氮0.42g/kg、速效磷5.5 mg/kg、速效钾74.6mg/kg,pH 值为7.8。
于2011年2月中旬将供试土壤风干后过4mm筛,在部分土壤中分别按照石油污染物浓度为5,10,15,20g/kg共4个水平添加原油(据在安塞调查,采油区内原油污染物含量呈不均匀分布状态,大致在5~20g/kg的范围内,故盆栽试验设置上述4个石油污染浓度水平),多次搅拌混合均匀(不添加任何有机溶剂),经自然平衡60d后过4mm筛备用,以无污染土壤作为对照栽培基质。
于2011年4月中旬在盆栽桶中装入处理后的栽培基质,每桶基质相当于12.94kg无污染土壤(干重),每处理9桶。将刺槐苗木植入桶中,每桶植3株,定植后放置于可移动式防雨棚内,防止天然降雨,晴天正常照光,各处理充分供水,以保证成活和正常生长。至6月底采用称重法将土壤水分统一控制在各处理土壤的田间持水量75%的水平。为消除苗木对称重控水的影响,各处理均毁苗1桶测苗木鲜重,确定称重标准。此后为隔30d均毁苗1桶测苗木鲜重,用于调校称重标准。并分别于30,60,90d的上午9:00前后在每处理剩余栽植桶内随机挑选5桶,并分别在内采集5份苗木中部功能叶片测定抗氧化酶活性以及抗氧化剂、H2O2和MDA含量。
1.3 指标测定
叶片中抗氧化保护系统相关指标采用下述方法测定[7]:SOD活性采用氮蓝四唑光还原法,以抑制NBT光反应50%为一个酶活单位;CAT活性采用H2O2分解量法,以每分钟OD值减少0.1为一个酶活单位;APX活性采用AsA氧化比色法,以每1min消耗1μmol的AsA为一个酶活单位;GR活性采用NADPH氧化比色法,以1min内OD340下降变化1.0为一个酶活单位;AsA含量采用H2O2消耗比色法;GSH含量采用DTNB法;Car含量采用丙酮浸提比色法测定;MDA含量采用硫代巴比妥酸法测定;H2O2含量采用过氧化物-Ti复合物沉淀法测定。各指标均重复5次测定。
1.4 数据处理
应用SPSS 19.0软件进行方差分析(one-way ANOVA),多重比较采用最小显著差法(LSD)。
2 结果与分析
2.1 石油污染对刺槐苗木抗氧化酶活性的影响
SOD可以将超氧阴离子自由基歧化成H2O2,在保护系统中处于核心地位[8],其活性的高低是植物抗逆性的重要标志之一。随生长时间延长,刺槐苗木叶片SOD活性对不同浓度石油处理的响应有所变化(图1A):总体而言,各浓度石油污染处理30d时,刺槐苗木SOD活性均较对照显著降低,其中石油浓度为10,15g/kg 时 降 幅 最 为 显 著,达 51.03% ~54.28%,石油浓度为5,20g/kg时SOD活性降幅则相对较小。这可能是由于低浓度下,石油对SOD的毒性作用相对较弱,而在高浓度下则对刺槐幼苗产生强烈胁迫,刺激了SOD活性使其有所提高;随时间延长,各石油浓度下SOD活性较对照基本无显著差异或显著提高,表明长期污染下刺槐苗木可对石油污染产生一定适应,从而保持正常的活性水平。

图1 石油污染对刺槐苗木抗氧化酶的影响
CAT是专性清除 H2O2的保护酶[9],其活性随污染时间和石油污染浓度的变化规律与SOD有所不同(图1B):在不同浓度石油污染处理30d时,CAT活性均较对照显著降低,其中10,15g/kg石油浓度时降幅最为显著(55.08%~76.06%),这与上述SOD活性的变化规律一致,出现此现象的机理可能也与SOD活性变化的机理相似。而60d时,除5 g/kg石油浓度下CAT活性较对照增加不明显外,其他浓度下CAT活性则均较对照显著升高,且随浓度增加呈递增趋势。至处理90d,石油浓度为5,10g/kg时,CAT活性再次显著低于对照(降幅达31.97%~33.96%),而石油浓度为15,20g/kg时CAT 活性与对照无显著差异。这表明在石油污染短期内,CAT活性即受到抑制,而随时间延长,植物对胁迫环境进行适应,CAT活性逐步恢复并产生一定提高,且在较高石油浓度下,这种抗胁迫响应持续的时间更长。
APX与SOD和CAT共同构成植物的抗氧化保护系统,三者间具有协同作用[10],但在石油污染下APX的响应规律与后两者存在不同(图1C):石油污染处理30d时,刺槐苗木APX活性较对照均无显著差异,而在60,90d时较对照显著降低,且随石油浓度增加,APX活性降幅趋于明显,其中石油浓度为15~20g/kg时降幅可达57.12%~62.62%,但两者在同期差异不显著。表明相对于SOD和CAT,APX对短期石油污染的耐受性较高,但对长期污染的适应性较差。GR是Halliwell-Asada途径的重要组成部分,对于叶绿体内H2O2的去除具有重要意义。石油污染处理下,刺槐苗木GR活性基本低于对照同期水平,与APX的变化趋势相似(图1D):5g/kg浓度石油处理30d和60d时,GR活性较对照无显著差异,至90d时其活性则显著降低(降幅为37.78%),表明在污染短期至中期内,GR对较低石油污染具有一定抗性。但随着时间延长,GR受到一定程度的破坏,在10~20g/kg石油浓度下,处理30~90d时GR活性均出现显著降低,其中20g/kg下处理90d时降幅最显著,表明长时间的高浓度石油污染可对GR的活性产生强烈损害。
2.2 石油污染处理下刺槐苗木抗氧化物质含量的变化
AsA是APX最重要的电子供体,缺少AsA时APX将迅速失活[11],刺槐苗木AsA受到不同程度石油污染时其响应方式有所差异(图2A):各浓度石油污染处理30~60d时,AsA含量较对照均无显著差异或显著增加的现象(增幅达4.19%~52.59%),随后这种趋势减弱至不显著的程度。至处理90d时,AsA含量在较低石油浓度下则表现为较对照显著降低。表明在石油污染短时段内,刺槐苗木通过增加AsA以清除活性氧,但长时间污染下AsA的形成受阻,保护能力下降,这与APX活性在长期石油污染后显著降低的现象相吻合。GSH可直接或通过Halliwell-Asada途径间接清除H2O2,猝灭单线态氧及其他自由基,防止膜脂过氧化,并修复自由基损伤[12]。在5~15g/kg浓度石油污染下,GSH在处理30d时较对照显著降低(图2B),但60~90d时,其含量与对照无显著差异,表明在上述浓度下,刺槐苗木GSH保护机制在较长时段内对石油污染产生适应;在20 g/kg石油浓度下,GSH含量对石油污染的抗性更为明显:处理30d时,GSH含量即可保持对照水平,而在60~90d时则较对照显著增加(增幅达24.87%~36.86%),表明在该污染浓度下,GSH保护机制的反应更加迅速,且强度更大。
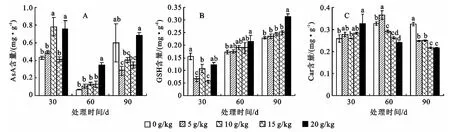
图2 石油污染对刺槐抗氧化剂的影响
Car可直接猝灭单线态氧,或间接猝灭三线态叶绿素阻止其产生,从而保护叶绿素[13]。在5g/kg浓度石油处理下,刺槐苗木Car含量在30d时与对照差异不显著(图2C),60d时较对照显著提高,90d时则显著降低;石油浓度为10~15g/kg,处理30d时Car含量变化不显著,石油浓度达到20g/kg时则较对照显著增加(增幅为25.92%),除石油浓度为5 g/kg处理60d时Car含量较对照显著增加外,其他浓度石油处理60~90d时,Car含量均则较对照显著降低(降幅达12.42%~33.98%)。上述结果表明短时段内Car对石油污染具有一定抗性,且表现出应激增加的现象,但随胁迫时间延长,刺槐苗木Car维持能力受到明显破坏。
2.3 石油污染处理下刺槐苗木H2O2和MDA含量的变化
胁迫环境下植物产生的活性氧往往超过其活性氧清除系统能力范围,导致H2O2等产生积累,对蛋白质和膜结构产生破坏。除在15g/kg浓度下,60d时较对照差异不显著外,几乎所有石油浓度下,处理30~60d时刺槐苗木H2O2含量均较对照显著提高(图3A),增幅可达192.00%;处理90d时,石油浓度为5,15g/kg下H2O2含量均较对照显著降低,而浓度为10,20g/kg下虽仍较对照显著增加,但增幅明显变小(46.41%~57.60%)。试验结果表明H2O2含量对石油污染敏感,在较低污染程度下即显著增加,且除部分处理较对照显著降低外,在长时间内基本高出正常水平,对植物生理过程造成长期干扰,但其同时受到抗氧化保护系统的有效抑制。MDA是活性氧积累导致膜脂过氧化作用的典型产物,故常用于评价活性氧造成的膜伤害程度。本试验中,4种石油污染程度下,处理时间为30~90d时刺槐苗木MDA含量均显著等于或低于对照水平(图3B)。该结果表明,尽管在石油污染下刺槐苗木体内活性氧水平有明显提高,但在抗氧化保护系统作用下并未对膜结构造成实质性的损伤。

图3 石油污染对刺槐苗木H2O2和MDA含量的影响
3 讨论与结论
植物体在受到胁迫时,体内往往产生大量活性氧,从而导致蛋白质、生物膜发生损害。在长期进化过程中,植物形成了完备的活性氧清除系统从而对各种环境胁迫进行适应和抵抗。通常情况下,适度的逆境处理可以提高保护酶系统的活性,增强抗逆性。随胁迫程度增加和时间延长,造成植物体活性氧产生量增加,同时降低保护酶活性和抗氧化剂含量,引发膜脂过氧化以及蛋白质、DNA等的损伤。
弓晓峰等[14]研究发现,在石油污染20d时,1%~10%浓度石油处理下,玉米SOD的活性均显著提高,APX活性显著下降且随浓度增加降幅趋于明显,MDA含量显著提高。李春荣等[15]研究发现随石油浓度增加,黄豆SOD活性先升后降,而MDA在高浓度下显著增加。与上述结果相反,本试验的结果则表明,各石油污染浓度处理30d后,除APX外其他保护酶活性基本出现显著降低,同时MDA含量则显著低于对照,这可能是由于植株因分解有毒物质消耗了大量的保护酶活性,而MDA产生量因毒害物质减少而降低[16]。此外,本实验结果表明,高浓度石油污染处理30d时AsA和Car含量显著增加,这表明短期内,尽管刺槐苗木受到石油污染影响,体内出现H2O2积累,但其抗氧化剂含量仍能维持较高水平以抵消活性氧含量的增加,降低生物膜所受到的实际伤害。且刺槐抵御活性氧胁迫的机制与玉米不同,更加倾向于维持非酶抗氧化剂的含量而非抗氧化保护酶系的活性。出现上述现象可能是由于土壤水分和氮素有效性对刺槐抗氧化保护系统的组分均具有一定的影响[17],而石油污染对土壤水分和氮素有效性存在显著相关性,不同程度的石油污染即可通过影响土壤氮素而间接对抗氧化保护酶和抗氧化剂产生作用。此外,石油还可能影响到刺槐苗木根系的生长状况、体内激素水平和其他的生化代谢途径,从而增加石油胁迫结果的复杂性。同时,考虑到不同试验使用的石油成分存在一定的差异,其毒性物质的含量必然也有所不同,这可能是引起不同试验间结果变异的重要原因之一。
随处理时间延长,SOD活性在各浓度下均能维持或高于对照水平,CAT活性仅在浓度为5~10 g/kg下90d时显著低于对照,其余则仍高于或持平于对照水平,APX和GR活性则均显著低于同期对照水平,且随石油浓度增加降幅显著增大;AsA和GSH含量在中长期石油污染下仍能维持正常水平,在20g/kg下甚至显著增加。Car含量则在石油浓度≥10g/kg下处理60~90d时,较对照显著降低。说明在长期石油污染下,刺槐抗逆机制由单一依靠抗氧化剂清除活性氧逐渐转变为抗氧化保护酶与抗氧化剂协同作用,其中SOD对石油胁迫的适应能力最强,CAT活性以及AsA和GSH对胁迫的适应能力相对较弱,但在各浓度石油持续处理下仍可维持较高水平,这可能是由于H2O2积累对上述抗氧化保护物质产生了一定的诱导。而APX、GR活性和Car则在长期石油污染处理下遭到严重破坏,其降低程度与石油浓度正相关。这可能与不同酶和抗氧化保护物质本身的特性有关,其机理有待进一步的研究。另外,刺槐苗木各时期的生理指标受影响的程度很少呈现明显的浓度—指标响应关系(同期高浓度石油污染并未造成更明显胁迫),这可能是由于石油浓度增加的同时,其中主要毒性成分的积累越过了刺槐苗木的耐受阈值,而在多种毒性成分综合作用下产生复杂的胁迫现象。此外,石油长期污染下其中间代谢产物的作用也对其胁迫效果产生影响[17],其机理也尚需进一步的研究阐释。
尽管在5~20g/kg石油胁迫下刺槐苗木体内H2O2产生量显著增加,但膜脂过氧化产物MDA在5~20g/kg浓度下始终维持在或者显著低于同期对照水平,这与岳冰冰等[18]的研究结果相似,表明在抗氧化保护系统在较高浓度石油污染下能快速做出响应,使活性氧造成的膜损伤显著降低。试验结果表明,刺槐苗木抗氧化保护系统对20g/kg以内的石油胁迫具有较强且长期的抗逆响应。
[1]夏会龙,吴良欢,陶勤南.有机污染环境的植物修复研究进展[J].应用生态学报,2003,14(3):457-460.
[2]时腾飞,刘增文,田楠,等.黄土区石油污染对土壤及豆科灌草植物的潜在影响[J].草地学报,2013,21(2):295-301.
[3]陈嫣,李广贺,张旭,等.石油污染土壤植物根际微生态环境与降解效应[J].清华大学学报:自然科学版,2005,45(6):784-787.
[4]Li X,Feng Y,Sawatsky N.Importance of soil-water relations in assessing the endpoint of bioremediated soils[J].Plant and Soil,1997,192(2):219-226.
[5]Spriggs T,Banks M K,Schwab P.Phytoremediation of polycyclic aromatic hydrocarbons in manufactured gas plant-impacted soil[J].Journal of Environmental Quality,2005,34(5):1755-1762.
[6]宋雪英,宋玉芳,孙铁珩,等.石油污染土壤植物修复后对陆生高等植物的生态毒性[J].环境科学,2006,27(9):1866-1871.
[7]高俊凤.植物生理学实验指导[M].北京:高等教育出版社,2006:210-226.
[8]王生耀,王堃,赵永来,等.干旱和 UV-B对两种牧草生长和抗氧化系统的影响[J].草地学报,2008,16(4):392-395,402.
[9]赵丽英,邓西平,山仑.活性氧清除系统对干旱胁迫的响应机制[J].西北植物学报,2005,25(2):413-418.
[10]杨文权,寇建村,雷忠萍.小冠花抗氧化保护系统对干旱胁迫及复水的动态响应[J].草地学报,2013,21(2):316-321.
[11]Zhang J,Kirkham M B.Antioxidant responses to drought in sunflower and sorghum seedlings[J].New Phytologist,1996,132(3):361-373.
[12]王娟,李德全.水分胁迫下植物体内的抗氧化剂及其作用[J].生物学通报,2002,37(10):22-23.
[13]韩刚,党青,赵忠.干旱胁迫下沙生灌木花棒的抗氧化保护响应研究[J].西北植物学报,2008,28(5):1007-1013.
[14]弓晓峰,荣亮,杨丽珍,等.石油污染土壤对玉米生长的影响及其生态毒性研究[J].环境科学与技术,2011,34(10):71-75.
[15]李春荣,王文科,曹玉清,等.石油污染土壤对黄豆生长的生态毒性效应[J].西北农林科技大学学报:自然科学版,2008,36(1):116-120.
[16]王雪峰,陈桂珠,许夏玲.白骨壤对石油污染的生理生态响应[J].生态学报,2005,25(5):1095-1100.
[17]庄飞,范阳阳,魏瑞峰.土壤水分和氮素有效性对刺槐幼苗叶片活性氧产生和清除的影响[J].西北植物学报,2013,33(6):1190-1196.
[18]岳冰冰,李鑫,任芳菲,等.石油污染对紫花苜蓿部分生理指标的影响[J].草业科学,2011,28(2):236-240.
