不同抗生素对紫雨桦离体叶片愈伤组织诱导的影响
2014-08-01王芳姜静
王 芳 姜 静
(林木遗传育种国家重点实验室(东北林业大学),黑龙江 哈尔滨 150040)
转基因是获得植物新品种的方法之一,人们常采用农杆菌介导法来获得成功的林木转化子[1-4],迄今为止,育种学家已利用该方法获得了抗逆、早花等性状的转基因株系[5-7]。然而在植物转基因的筛选过程中,抑菌抗生素和选择抗生素种类及浓度的确定是转基因成功的关键,因为抑菌抗生素在抑制农杆菌的同时也对植物细胞产生伤害作用,抑制植物受体细胞的分化,从而影响植株的再生[8]。研究表明,遗传转化中所用的农杆菌主要有EHA4404、EHA105和AGL1等[3,5,7,9],不同种类的农杆菌对抗生素的敏感程度有差异,植物表达载体携带的外源基因不同也可能影响抑菌抗生素的使用剂量和种类[3,10-14]。因此,在利用农杆菌介导法开展植物转基因之前,必须对供试植物受体进行抗生素敏感试验,筛选抑菌效果好同时又对供试植物再生影响小的抗生素作为抑菌剂,并确定其最佳使用浓度,才能保证其既能抑制农杆菌的生长,又能使转化细胞正常再生。
选择剂在遗传转化中主要用于筛选转化体和检测转基因后代,其浓度的高低直接影响转化效率。浓度过高,抑制成功转化细胞的生长,浓度过低又会形成大量假阳性抗性愈伤和嵌合体。因此,为获得最佳的筛选效果,确定合适的选择剂浓度,有必要在转化试验之前,对植物受体进行选择抗生素的敏感试验。
紫雨桦(Betulapendula‘Purple Rain’)是欧洲白桦种内变种,叶片紫色,已经成为重要的观赏树种。本研究团队采用Solexa技术对紫雨桦及欧洲白桦(Betulapendula)基因表达谱分析发现,紫雨桦中显著上调的基因有:编码苯丙氨酸解氨酶、肉桂酸羟化酶、花色素合成酶和花色苷-3-O-葡萄糖基转移酶等基因[15]。为了查明欧洲白桦变种(紫雨桦)叶片呈现紫色的原因,必须通过转基因手段进行基因的功能验证。本试验以紫雨桦为研究对象,分别进行适宜的抑菌剂和选择剂筛选,为开展紫雨桦基因功能验证奠定基础。
1 材料与方法
1.1 材料来源
紫雨桦无菌苗。材料取自黑龙江省森林植物园,摘取紫雨桦腋芽置于70%乙醇中1 min,随后用无菌水浸泡1 min,于超净台上剥去外层芽鳞,随后在10%(W/V)Ca(ClO)2中处理10 min,期间不断搅动,最后用无菌水漂洗3~5遍。将消毒后的腋芽接种到WPM + 1.0 mg/L 6-苄氨基嘌呤(6-Benzylaminopurine,6-BA)+ 0.5 mg/L GA3的初始培养基上,培养30 d后,即可获得丛生不定芽。
1) 菌种:农杆菌EHA105(pCHS ),由本实验室保存。
2) 抗生素:卡那霉素(kanamycin, Kan)、新霉素(neomyxin)均购自Sigema公司;潮霉素(hygromycin)购自amresco公司;G418购自Invitrogen Corporation;头孢霉素(cefalotin, Cef)购自北京鼎国生物技术有限责任公司;头孢曲松钠(ceftriaxone sodium)购自上海新先锋药业有限公司;羧苄青酶素(carbenicillin, Carb)购自Bedfont Limited;特美汀(Ticarcillin Clavulanate Acid)购自中科瑞泰(北京)生物科技有限责任公司。
1.2 试验方法
活化农杆菌EHA105(pCHS )的菌种至对数期[16],随后菌液与50 ℃左右的LB固体培养基以1∶100的比例混匀,倒平板。无菌条件下用直径为1 cm 的无菌滤纸片蘸取不同种类和浓度的抑菌抗生素置于平板上,28 ℃下暗培养,3 d后观察抑菌圈的大小。根据相关文献设置抑菌抗生素(头孢霉素、头孢曲松钠、羧苄青霉素、特美汀)的浓度范围均为:200~800 mg/L,对照组CK不加抗生素[17-19]。
将不定芽转接于WPM + 0.4 mg/L IBA生根培养基中, 25 d后切除根部再次转接于生根培养基中培养25 d,取苗木顶部的第2片或第3片叶片于培养皿中。延与主叶脉垂直的方向从靠近叶柄处切一刀,形成2片有创口的叶片,置于附加不同种类和浓度抑菌抗生素、选择抗生素的分化培养基上,每处理重复3次,每个重复约5片紫雨桦完整叶片(10片有创口的叶片),在温度为(25±2) ℃,光照时间为16 h/d,光照度 1 500~2 000 lx的条件下培养,定期观察叶片的变化及愈伤组织诱导情况,培养25 d后统计产生愈伤的叶片个数并计算愈伤产生率(愈伤产生率=产生愈伤的叶片数/总叶片数×100%)。抑菌抗生素的种类及浓度与上述相同,选择抗生素种类与浓度范围分别为卡那霉素:10~40 mg/L;G418:5~20 mg/L;新霉素:10~50 mg/L;潮霉素:5~20 mg/L ;对照组CK不加抗生素[17-18,20]。
2 结果与分析
2.1 抑菌抗生素对农杆菌的抑制作用
将蘸有不同浓度头孢霉素、头孢曲松钠、羧苄青霉素、特美汀的滤纸片置于含有LB的平板上,观察抑菌圈的大小,结果见表1。当抗生素浓度在200 mg/L时,含有头孢霉素、头孢曲松钠和特美汀的LB平板上均出现抑菌圈,说明已经产生了抑菌效果,只有附有羧苄青霉素的平板上没有出现抑菌圈。随着抗生素浓度的增大,抑菌圈的半径逐渐增大,其中,特美汀的变化最明显,最小的抑菌圈为0.1~0.2 cm,最大则可达到0.8~1.0 cm。头孢霉素与头孢曲松钠作用下的抑菌圈变化比较平缓。羧苄青霉素的浓度在200~600 mg/L时,一直没有出现抑菌圈,只有在800 mg/L时才出现0.2~0.5 cm的抑菌圈,较其他3种抗生素抑菌效果不明显。综上研究结果表明:头孢霉素、头孢曲松钠、特美汀对农杆菌EHA105(pCHS)有较好的抑制作用,以0.2~0.5 cm的抑菌圈为基准,认为此时可达到明显的抑菌效果。由表1可知,对农杆菌有较好抑制作用的3种抗生素的浓度分别为:头孢霉素200~400 mg/L,头孢曲松钠200~600 mg/L,特美汀400~800 mg/L。
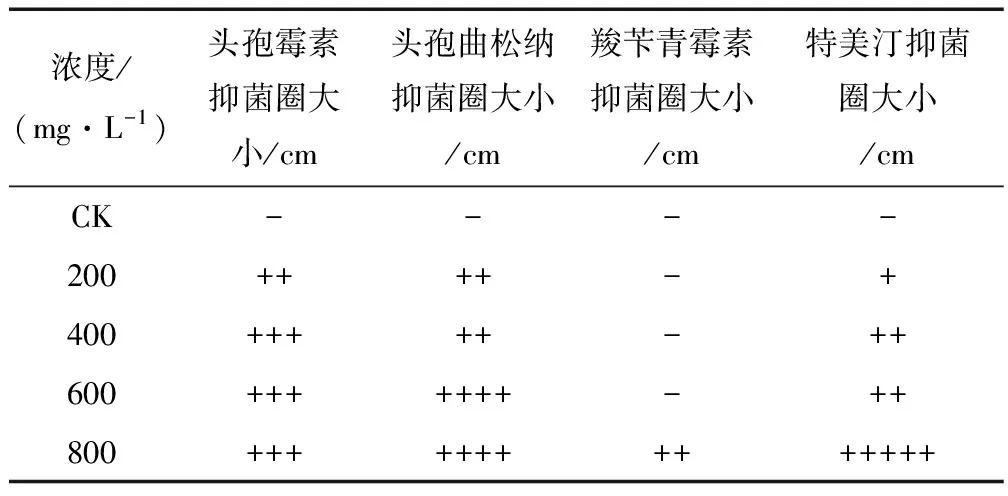
表1 不同种类、浓度的抑菌抗生素 对农杆菌的抑制试验结果
2.2 抑菌抗生素对叶片愈伤组织诱导的影响
将紫雨桦叶片分别接种到含不同浓度的头孢霉素、头孢曲松钠、羧苄青霉素、 特美汀的愈伤诱导培养基上,培养25 d后,统计愈伤组织形成率,见图1。图1表明:在设置的浓度范围内,头孢霉素、羧苄青霉素、特美汀对叶片的毒害作用较小,这3种抗生素的愈伤形成率均在55%以上,只有头孢曲松钠对离体叶片愈伤形成的影响略大,随着浓度的增大,愈伤形成率逐渐降低,当浓度达到800 mg/L时,不再产生愈伤组织,即愈伤形成率为0。以愈伤形成率在50%以上认为是对叶片伤害较小为基准,由图1可知:200~800 mg/L的头孢霉素、羧苄青霉素、特美汀或200~400 mg/L的头孢曲松钠对紫雨桦叶片愈伤的形成影响不大。结合上述抑菌剂的抑菌效果选出既能有效抑制农杆菌的生长又对离体叶片产生最小伤害的抑菌剂,认为头孢霉素、头孢曲松钠和特美汀可作为紫雨桦遗传转化试验中适宜的抑菌抗生素,其适宜浓度范围分别为:头孢霉素200~400 mg/L,头孢曲松钠200~400 mg/L,特美汀400~800 mg/L。

2.3 选择抗生素对叶片愈伤组织诱导的影响
将切好的紫雨桦叶片置于含有不同种类及浓度选择剂的愈伤培养基平板上,25 d后观察愈伤的形成率(表2)。由表2可知:随着选择剂浓度的增大,愈伤形成率逐渐降低。叶片对G418与潮霉素较敏感,当G418、潮霉素浓度为 15 mg/L 时,叶片愈伤形成率均为0。而卡那霉素在30 mg/L时,愈伤形成率才为0,新霉素在所设置的浓度范围内,始终都有愈伤形成,因此不宜作为紫雨桦遗传转化实验中的选择剂。综上结果表明:卡那霉素、G418、潮霉素都可作为紫雨桦遗传转化试验的选择剂,卡那霉素的临界浓度为30 mg/L,G418和潮霉素的临界浓度为15 mg/L。

表2 不同种类、浓度选择抗生素下离体叶片愈伤形成率
3 结论与讨论
在植物遗传转化的研究中,农杆菌侵染后为了避免菌体泛滥,必须采用抑菌抗生素进行抑菌,常用的抑菌抗生素有头孢类、羧苄青霉素、特美汀等[20]。不同种类、浓度的抑菌剂对农杆菌(含外源基因)的抑菌效果不同[21-23],因此,选择适宜的抑菌剂并确定其最佳浓度范围在转基因试验中是非常必要的。同时,试验中所用的工程菌虽然均是农杆菌,但由于内含不同的重组外源基因的质粒载体,有可能导致含不同载体的农杆菌对不同抑菌剂的敏感性也不同[3,12],本试验表明,不同抑菌抗生素对农杆菌EHA105(pCHS)的抑菌效果不同,羧苄青霉素对该工程菌抑菌作用较差,而头孢霉素、头孢曲松钠、特美汀的抑菌作用较强。 植物遗传转化的选择培养过程中,若抑菌抗生素浓度过低,则起不到良好的抑菌效果;浓度过高,虽然可以抑菌,但对植物会产生毒害作用,从而抑制叶片愈伤的形成[24]。因此,在加入抗生素抑制农杆菌生长的同时,必须保证所加抗生素不影响叶片愈伤组织的形成。在明确了对EHA105(pCHS)的最适抑菌剂后,必须结合抑菌剂对紫雨桦叶片愈伤形成的影响,最后确定适宜的抑菌剂及其浓度,结果表明:特美汀对紫雨桦的愈伤形成影响最小,在浓度800 mg/L条件下,紫雨桦的愈伤形成率仍为70%;头孢霉素的影响次之,在800 mg/L时,愈伤形成率为55.6%;头孢曲松钠在600 mg/L,愈伤形成率仅为30%。因此,在紫雨桦的遗传转化试验中,适宜的抑菌抗生素有3种,即头孢霉素、头孢曲松钠、特美汀,其中头孢霉素和头孢曲松钠的适宜浓度范围为200~400 mg/L,特美汀为400 ~800 mg/L。然而,长期使用同一种抗生素,细菌会产生耐药性而起不到抑菌作用[25],因此,若开展紫雨桦的遗传转化实验,建议交替使用头孢霉素、头孢曲松钠、特美汀3种抗生素。
植物转基因研究中,常利用选择抗生素来筛选转化细胞,不同载体所含有的选择标记基因不同,需要的选择抗生素也不同。本研究所用载体包括NPTII和HPT等2种选择标记基因,其中,NPTII编码合成新霉素磷酸转移酶(NPT),能分解卡那霉素、G418、新霉素等氨基糖苷类抗生素,使其磷酸化而失活;HPT编码合成潮霉素磷酸转移酶(HPT),该酶可分解潮霉素。含有这些选择标记基因的转基因植物对相应的抗生素具有抗性[26]。合适的选择抗生素浓度也是转基因成功的关键,浓度过低,起不到筛选作用,浓度过高又可能使转化细胞因生长能力变弱而死亡[27]。因此,确定适宜的选择抗生素种类和浓度对获得成功的转化子是非常必要的。同时外植体不同,即使是同一树种,由于品种的不同,所需要的抑菌抗生素和选择抗生素的种类和浓度可能也不尽相同[17-18,22]。如卡那霉素和新霉素可作为山新杨(Populusdavidiana×P.bollena)遗传转化中的较好选择剂,适宜浓度分别为20 mg/L和50 mg/L[17],而银白杨(Populusalba)适宜的选择剂是15 mg/L卡那霉素和10 mg/L的G418[28]。我国白桦遗传转化研究始于2003年[3],主要用卡那霉素作为选择抗生素,其使用浓度在15~50 mg/L[3,7,12],可见同是白桦(Betulaplatyphylla),不同个体之间对抗生素浓度的要求也存在差异。以紫雨桦离体叶片为试材的选择抗生素筛选试验结果表明:卡那霉素要求的浓度为30~40 mg/L,G418或潮霉素的浓度为15~20 mg/L,新霉素不是适宜的选择剂。紫雨桦是欧洲白桦的一个变种,与白桦不同的是叶片为紫色,叶片中花色素苷含量显著高于欧洲白桦[15]。目前认为,这些代谢物含量的改变致使遗传转化中选择剂的浓度不同于白桦[3,7,12]。因此,在开展紫雨桦遗传转化试验之前,抗生素敏感性试验的探究是非常必要的,本试验结果为紫雨桦遗传转化研究提供了参考依据。
[1] Dutta I, Kottackal M, Tumimbang E, et al. Sonication-assisted efficientAgrobacterium-mediated genetic transformation of the multipurpose woody desert shrubLeptadeniapyrotechnica[J]. Plant Cell Tissue and Organ Culture (PCTOC), 2013, DOI 10.1007/s11240-012-0236-4.
[2] Vidal N,Mallón R, Valladares S,et al. Regeneration of transgenic plants byAgrobacterium-mediated transformation of somatic embryos of juvenile and matureQuercusrobur[J]. Plant Cell Reports, 2010,29(12):1411-1422.
[3] 詹亚光,王玉成,王志英,等. 白桦的遗传转化及转基因植株的抗虫性[J]. 植物生理与分子生物学学报,2003,29(5):380-386.
[4] Karimi M,Inzé D, Depicker A. GATEWAYTMvectors forAgrobacterium-mediated plant transformation [J]. Trends in Plant Science, 2002,7(5):193-195.
[5] 杨传平, 刘桂丰, 梁宏伟,等. 耐盐基因Bet-A转化小黑杨的研究[J]. 林业科学, 2001,37 (6):34-38.
[6] 黄海娇,胡雪婷,李慧玉,等. 盐胁迫下 8 个转基因小黑杨株系的抗逆性比较[J]. 森林工程,2009,25(4):14-18.
[7] Huang H,Wang S,Jiang J,et al. Overexpression ofBpAP1 induces early flowering and produces dwarfism inBetulaplatyphylla×B.pendula[J]. Physiologia Plantarum, 2013, DOI:10.1111/ppl.12123.
[8] Lin J J,Assad-Garcia N,Kuo J. Plant hormone effect of antibiotics on the transformation effkiency of plant tissues byAgrobacteriumtumefacienscells [J]. Plant Science,1995,109(2):171-177.
[9] 刘桂丰,程桂兰,姜静,等. 以胆碱脱氢酶基因对小黑杨花粉植株的遗传转化[J].植物生理与分子生物学学报,2006, 32 (2): 163-168.
[10] 王冬梅,郝秀英.抗生素对新疆棉花愈伤组织诱导和生长的影响[J]. 新疆农业大学学报,1998, 21 (4):267-269.
[11] 张晓英,尹伟伦,朱祯,等. 抗生素对国槐愈伤组织诱导和生长的影响[J]. 北京林业大学学报,2004,26 (6):62-65.
[12] 张瑞萍.脱水素基因逆境表达模式与白桦遗传转化研究 [D]. 哈尔滨: 东北林业大学, 2009.
[13] 傅荣昭,贾士荣,孙勇,等. 植物遗传转化技术手册 [M]. 北京:中国科学技术出版社,1994.
[14] 杨美株. 根癌农杆菌介导的植物基因转化[J].植物生理学报,1998,24(3):258-271.
[15] Lin L, Mu H, Jiang J,et al. Transcriptomic analysis of purple leaf determination in birch[J]. Gene, 2013,526(2):251-258.
[16] 邹永梅,施季森. 北美一球悬铃木高效遗传转化体系的建立[J]. 南京林业大学学报: 自然科学版,2005,29(4):15-19.
[17] 徐晨曦,姜静,李俊涛,等. 几种抗生素对山新杨离体叶片不定芽再生的影响[J]. 东北林业大学学报,2007,35 (1):28-30.
[18] 詹立平,姜静,赵鑫,等. 农杆菌抑菌剂的抑菌效果及其对小黑杨叶片不定芽产生率的影响[J]. 植物生理学通讯,2004,40(6):689-692.
[19] 王丽,张俊莲,王蒂,等. 抗生素对根癌农杆菌的抑菌效果及对烟草叶片分化的影响[J]. 中国烟草学报, 2006,12 (1):32-37.
[20] 王关林,方宏均. 植物基因工程原理与技术 [M]. 2版. 北京:科学出版社,2002.
[21] 张福丽,王贤,李季平,等. 抗生素对根癌农杆菌抑制作用及对大豆子叶节再生的影响分析[J]. 广东农业科学,2011 (14):76-78.
[22] 王成, 王义军,李慧玉,等. 抗生素对根癌农杆菌的抑菌作用及对新西伯利亚黑杨组培叶片再生的影响[J]. 东北林业大学学报,2009,37 (9):4-7.
[23] Nauerby B, Billing K, Wyndaele R. Influence of the antibiotic timentin on plant regeneration compared to carbenicillin and cefotaxime in concentrations suitable for elimination ofAgrobacteriumtumefaciens[J]. Plant Science,1997,123(1):169-177.
[24] 裴冬丽,耿慧霞,冯翊阳, 等. 抗生素对白菜型油菜愈伤组织诱导的影响[J]. 中国农学通报,2011,27(16):168-171.
[25] 赵明秋,沈海燕,潘文,等. 细菌耐药性产生的原因、机制及防治措施[J]. 中国畜牧兽医,2011,38(5):177-181.
[26] 刘谦,朱鑫泉.生物安全[M].北京:科学出版社,2001.
[27] 孙春玉,孙旸,刘庆忠,等. 根癌农杆菌介导的苹果遗传转化研究进展[J]. 中国农学通报,2010,26(4):231-233.
[28] 李慧,陈晓阳,李云,等. 银白杨遗传转化中抗生素浓度优化的研究[J]. 北京林业大学学报,2005,27(5):118-121.
