蒜头果蛋白对人白血病K562细胞体外生长的抑制作用
2014-07-25王红斌ColinBarrow杨文荣
袁 燕,张 薇,李 彬,王红斌,Colin J.Barrow,杨文荣
(1.云南民族大学民族药资源化学国家民委-教育部重点实验室,云南昆明 650500;2.澳大利亚迪肯大学生命与环境科学学院化学与生物技术中心,吉朗3216,澳大利亚)
蒜头果(Malania oleiferaChun et S.Lee),常绿乔木,属于铁青树科(Olacaceae)蒜头果属[1],是中国云南、广西稀有濒危植物[2],广西重点保护野生植物[3],国家二级保护树种[4]。蒜头果种仁富含油脂,含油率高达51.85%~67.0%,成分为油酸、棕榈酸和硬脂酸等,为良好的木本油料植物[5]。蒜头果油可以食用,也可作为润滑油和制皂的原料,油饼还可以作饲料。其油脂中还富含二十四碳-15-烯酸,是一种长链单不饱和脂肪酸,具有活跃脑细胞、治疗身体免疫缺乏性疾病、心血管疾病等功用,且还是合成高价值的麝香酮所需的廉价理想原料[6-7],具有较高的经济价值[8]。
蒜头果蛋白(malanin)是通过粉碎、抽提、硫酸铵沉淀、疏水色谱层析等分离手段从蒜头果中分离纯化出一种新的植物蛋白质[9],属于原创研究。本文从蒜头果种仁中提取蒜头果蛋白并测定其对人白血病K562体外生长的抑制作用,为该蛋白作为新药的开发利用提供理论依据与实验基础。
1 材料与方法
1.1 材料与仪器
蒜头果种子 购自云南文山;HiprepTMphenyl FF(High sub,20ml)预装柱 Amersham公司;人白血病K562细胞 昆明医学院;注射用顺铂 齐鲁制药有限公司;四甲基偶氮唑盐 Sigma公司;DMEM培养基 Gibco公司。
蛋白纯化系统 Amersham公司;酶标仪Spectra Max 190 Molecular Devices Corporation;二氧化碳培养箱 日本SANYO公司;倒置相差显微镜 美国OLYMPUS公司;超净工作台 苏净集团安泰公司。
1.2 实验方法
1.2.1 malanin的分离提取 将蒜头果种仁捣碎,4℃抽提过夜,纱布过滤,30%~80%(NH4)2SO4沉淀,离心,沉淀用20mmol/L pH7.2的磷酸盐缓冲液溶解,在蛋白质纯化系统上疏水预装柱,用去离子水按0%100%线性梯度洗脱,4mL/min,280nm紫外检测,按峰高收集。12%SDS-PAGE电泳检测后收集样品峰,冷冻干燥后备用[9]。
1.2.2 细胞形态学观察 将人白血病细胞K562细胞株在含有10%胎牛血清的DMEM培养液中,37℃、饱和湿度、5%CO2的培养箱中培养,取指数生长期的细胞接种于6孔细胞培养板中培养24h后,加入已过滤灭菌的malanin溶液(50μL/孔),继续培养72h后于倒置显微镜观察结果。
1.2.3 体外抑制肿瘤细胞活性测定 采用MTT比色法测定[10-11]。取对数生长期的K562细胞,充分吹打混匀成单细胞悬液,以5×104个细胞/mL浓度接种于96孔细胞培养板中,100μL/孔。在37℃、5%CO2培养箱中培养24h后,更换培养基(100μL/孔),每孔再加入20μL不同浓度的malanin样品,用培养液作为阴性对照组,广谱抗癌药物顺铂(DDP)作为阳性对照组,均为6个平行复孔。继续培养72h后,吸除上清液,每孔加入新配制的5g·L-1MTT溶液20μL,再培养4h,吸除上清,加入150μL/孔二甲基亚砜(DMSO),振荡约30min,待紫色结晶完全溶解后,于酶标仪在550nm波长下测定其吸光值(A),计算72h时malanin和DDP对K562细胞的抑制率。
抑制率(%)=[1-(A实验组/A对照组)]×100[12]
1.2.4 IC50值的测定 半数抑制浓度(IC50,Median Inhibitory Concentration)是指一种药物能将某种酶的活性或肿瘤细胞生长或病毒复制抑制50%所需的浓度。以每个样本实际浓度的负对数(-lgC)为横坐标,抑制率(%)为纵坐标作线性回归分析,计算以引起50%细胞抑制率浓度,即72h时malanin和DDP的IC50值[13]。
1.2.5 malanin与DDP联合抑制效应 为了比较malanin抗肿瘤活性的强弱,本实验采用广谱抗癌药物DDP作阳性对照,同时用malanin和DDP联合应用(malanin+DDP)对每种细胞的生长是否具有协同抑制作用。
将malanin、DDP和malanin+DDP在同一浓度下与K562细胞作用12、24、36、48和72h后,计算其对K562细胞的抑制率,判断malanin和DDP联合用药是否对K562细胞具有协同作用。
1.2.6 malanin的稳定性分析
1.2.6.1 malanin在不同保存方式下的稳定性分析 为了解malanin以何种方式保存比较稳定,本实验采用MTT比色法测定在不同保存方式下的malanin样品对K562细胞的IC50值,分析其稳定性。
1.2.6.2 Malanin热稳定性分析 将malanin溶液于50、60、70、80、90、100℃条件下在水浴锅中热处理2h,4℃则是样品保存于4℃冰箱中,计算在不同温度下处理的malanin与K562细胞作用24、48和72h的成活率:成活率(%)=(A实验组/A对照组)×100[14]。
2 结果与分析
2.1 malanin的分离提取
在蛋白纯化系统上疏水色谱层析柱后,其结果如图1所示,主要得到4个组份(I、Ⅱ、Ⅲ、Ⅳ),通过SDSPAGE电泳(如图2第3孔所示)检测结果发现,组份Ⅳ即为malanin,其相对分子质量约为60ku左右。收集组份Ⅳ真空冷冻成干粉,置于-20℃冰箱中保存备用。
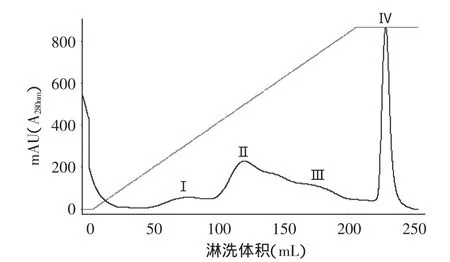
图1 malanin分离提取的疏水色谱层析图Fig.1 Purification of malanin on HiprepTMphenyl FF(High sub)column
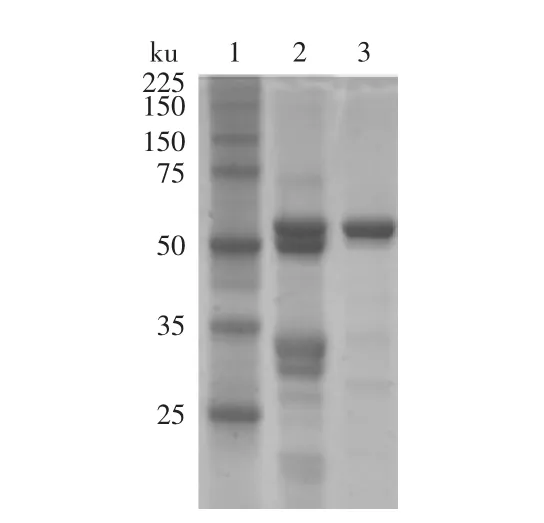
图2 12%SDS-PAGE电泳图Fig.2 12%SDS-PAGE of malanin
2.2 细胞形态学观察
malanin与 K562细胞作用72h后的细胞形态如图3所示。可见,空白对照组(图3(A))K562悬浮在培养基中,长势良好,呈圆形,胞体饱满,细胞密度大,大部分单个生长。随着作用时间的延长,细胞外型逐渐皱缩,细胞的体积变小,继而细胞发生崩解,破裂成碎片,散落在培养瓶底部(图3(B)),说明malanin能较强地作用于肿瘤细胞并抑制其生长。

图3 Malanin对K562细胞的抑制效果图(20×)Fig.3 The inhibitory effect of malanin on K562 cells(20×)
2.3 IC50值的测定
体外抑制肿瘤细胞活性测定结果表明,malanin和DDP均具有抑制K562细胞体外增殖的作用,且随着浓度的增大和作用时间的延长,malanin和DDP对K562细胞的生长抑制率均逐渐升高,呈一定的剂量和时效依赖性。
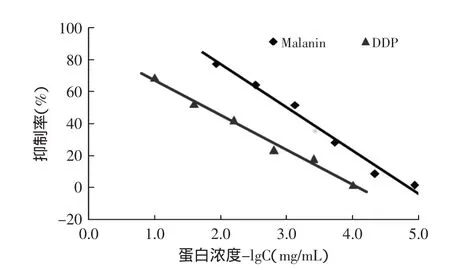
图4 Malanin和DDP与K562细胞作用72h的抑制率Fig.4 The inhibition rate of malanin and cisplatin on K562 cells for 72h
以蛋白浓度的负对数为横坐标,细胞的抑制率为纵坐标进行直线作图(如图4所示),根据线性回归方程计算malanin、DDP对K562细胞的IC50值分别为1.58×10-8、5.50×10-5mol·L-1。可见,malanin的IC50值明显小于广谱抗癌药物DDP,说明malanin的抗肿瘤活性较强,具有用于免疫毒素治疗癌症的应用前景。
2.4 malanin与DDP联合抑制效应
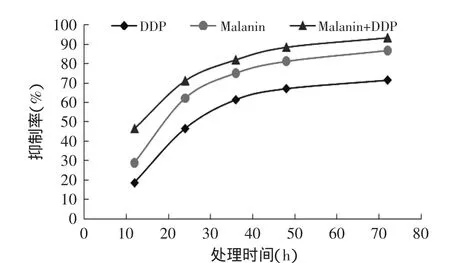
图5 Malanin、DDP和malanin+DDP与K562细胞作用不同时间的抑制率Fig.5 The inhibition rate of malanin,cisplatin and malanin combined with cisplatin on K562 cells at different times
从图5中可以看出,malanin、DDP和两药联合(malanin+DDP)对K562细胞的生长抑制率曲线随着时间的延长,抑制率逐渐升高,细胞的成活率逐渐降低,表现出明显的生长抑制作用,说明malanin、DDP和malanin联合DDP均具有抑制K562细胞体外生长的作用,且存在时间依赖性。此外,两药联用对K562细胞的抑制率曲线是最高的,均高于malanin和DDP单独与K562细胞作用的抑制率曲线,说明malanin和DDP联用表现出了明显的协同抑制效应,两药联合应用效应会增加。
2.5 malanin的稳定性分析

表1 malanin在不同保存方式下对K562细胞活性的影响Table 1 The cytoactivity effect of malanin on K562 cells in different time of save
2.5.1 malanin在不同保存方式下的稳定性分析 表1为malanin在不同保存方式下对K562细胞活性的影响。可见,malanin溶液直接从层析柱上分离纯化后立即进行K562细胞活性测定,其抗肿瘤活性最高;将此溶液于-20℃保存12个月后其活性下降了2.2倍,但反复冻、融3次后其活性明显急剧下降。而将malanin干粉于-20℃保存6个月和12个月后,再测定其活性,发现其活性变化不大。此结果表明,malanin样品最好的保存方式是将其冷冻成干粉并于-20℃保存,避免反复冻融。

图6 不同温度水浴处理的malanin与K562细胞作用24,48,72h的成活率Fig.6 The cell viability of malanin on K562 cells under different temperature for 24,48 and 72h
2.5.2 malanin热稳定性分析 在不同温度下水浴处理的malanin溶液与K562细胞作用24、48、72h后,细胞的成活率如图6所示。结果表明,malanin对K562细胞的热稳定性比较好,在4~70℃细胞活性差异不大,随着温度的升高,细胞的成活率逐渐升高,到80℃以上时,malanin变性就比较彻底,几乎就没有细胞活性了,且随着malanin与细胞作用时间的延长,细胞成活率逐渐升高。
3 结论与讨论
疏水色谱层析是基于溶质极性流动相和非极性固定相表面间的疏水效应建立的一种色谱模式,其一个非常重要的特点就是配基具有很弱的疏水性,与蛋白质作用很温和,从而能很好地保留蛋白质的天然构象和生物活性。本研究将粗蛋白干粉上疏水色谱层析柱HiprepTMphenyl FF(high sub)后,结果出现了4个峰(如图1所示)。前3个峰在280nm处的吸收值都比较低,第4个峰则远远高于其他吸收峰,收集这4个峰经SDS-PAGE电泳发现,前3个峰浓度低,且条带比较多,但第4个峰浓度很高,且只出现一条比较明显的60ku左右的条带(如图2所示),说明纯度较高,得率为26%左右。
本研究以人白血病K562细胞为对象,测定蒜头果蛋白体外抗肿瘤活性。结果表明,malanin具有明显抑制K562细胞体外增殖的作用,其IC50值为1.58×10-8mol·L-1,比广谱抗癌药物DDP抗肿瘤活性都强,而且malanin和DDP联用表现出了明显的协同抑制效应,两药联合应用效应会增加。此外,malanin的热稳定性非常好,将其冷冻成干粉并于-20℃保存1年其活性仍变化不大,此结果为malanin在肿瘤治疗方面的开发利用提供依据和思路,也为该蛋白作为新药的研发打下基础,同时也对云南植物资源的开发利用具有重要意义。
[1]丘华兴,林有润.中国植物志(第二十四卷)[M].科学出版社,1988:89-90.
[2]傅立国主编.中国植物红皮书——稀有濒危植物(第一册)[M].北京:科学出版社,1992:480-481.
[3]王才明,黄仕训,王燕.广西国家级珍稀濒危保护植物种质资源调查研究[J].广西植物,1994,1(3):277-281.
[4]国家环境保护局.中国珍稀濒危保护植物名录[M].北京:科学出版社,1987:21-22.
[5]欧乞缄.一个重要脂肪酸CIS-TETRCOS-15-ENOIC的新存在—蒜头果油[J].云南植物研究,1981,3(2):181-184.
[6]欧乞缄.中国植物油脂的研究I.一百种植物种子油的脂肪酸成分[J].云南植物研究,1980,2(3):275-295.
[7]李用华,朱亮锋,欧乞缄,等.蒜头果油合成麝香酮简报[J].云南植物研究,1983,5(3):238-239.
[8]云南植物研究所.云南经济植物[M].昆明:云南人民出版社,1972:35-36.
[9]Yuan Y,Dai XC,Wang DB,et al.Purification,characterization and cytotoxicity of malanin,a novel plant toxin from the seeds ofMalania oleifera[J].Toxicon,2009,54:121-127.
[10]Wang TX,Shi XY,Cong Y,et al.Reversal of multidrug resistance by 5,5’-dimethoxylariciresinol-4-O-β-D-glucoside in doxorubicin-resistant human leukemia K562/DOX[J].Indian Journal of Pharmacology,2013,45(6):597-602.
[11]逯城宇,张尊凯,刘艳,等.蛹虫草N102多糖提取条件优化及其抗肿瘤活性研究[J].食品工业科技,2012,33(14):250-254.
[12]Matic′IZ,Aljancˇic′I,Žižak Ž,et al.In vitroantitumor actions of extracts from endemic plantHelichrysum zivojinii[J].BMC Complementary and Alternative Medicine,2013,13(1):36-41.
[13]李义勇,陈玉婵,李冬利,等.几种虫草菌发酵提取物的抗菌抗肿瘤活性研究[J].食品工业科技,2010,31(6):88-90
[14]晁若瑜,杨靖亚,蔡晓晔,等.芦根多糖的分离纯化和体外抗肿瘤研究[J].食品工业科技,2011,32(12):284-286
[15]阴梅云,郑力芬,韩硕,等.阿克拉霉素对顺铂和足叶乙甙杀伤卵巢癌细胞的影响[J].细胞生物学杂志,2003,25(1):47-51.
[16]马卫东,阴梅云,蒋常文,等.顺铂与足叶乙甙对白血病细胞K562的协同杀伤作用及其机制[J].癌症,2005,24(8):958-964.
