葡萄籽原花青素对秀丽隐杆线虫抗衰老的影响
2014-07-25王艳菊马建伟王曦茁张柏林汪来发
王艳菊,马建伟,王曦茁,周 方,张柏林,*,汪来发,*
(1.北京林业大学生物科学与技术学院,北京 100083;2.中国林业科学研究院森林生态环境与保护研究所,国家林业局森林保护学重点实验室,北京 100091)
原花青素(procyanidins,PC)是聚多酚类化合物,广泛存在于多种植物体中,被认为具有抗氧化、抗衰老、抗癌、抗炎、抗突变、保护心血管系统等多重功效[1-2]。目前对葡萄籽原花青素的研究多集中在抗氧化作用和对心血管疾病预防等方面,而对抗衰老的影响,报道相对较少。衰老是老龄化社会持续关注的社会和经济问题之一,据2012年2月22日国家统计局发布的数据显示,我国65岁及以上老年人口比重已达到9.1%,老年人口达到12288万人,我国已经进入老龄化社会。预计到2040年,我国60岁以上老年人口将达到约4亿人,占总人口26%。衰老以及与衰老相关的疾病已成为日趋严重的社会问题,因此阐明衰老的机制以及干预衰老进程具有重要的现实意义。如果能够通过食物达到延缓衰老的目的,对延缓生物衰老具有重要意义。江岩[3]以黑腹果蝇为模式生物,研究了新疆药桑葚花青素对黑腹果蝇衰老的影响。研究表明喂食112.5mg/kg新疆药桑葚花青素可以显著延长黑腹果蝇的半数致死时间、平均寿命及平均最高寿命,且存在剂量-反应关系。Liu等[4]发现蓝莓花青素可以延缓视网膜色素上皮细胞的衰老。Chio等[5]用WI-38人类二倍体纤维母细胞经300μmoL/L H2O2处理后做早衰细胞模型,与对照组相比,添加花青素组细胞的生存能力显著增加,并显著延长了不同时期细胞的寿命。Yokozawa等[6]用老鼠作为模型,喂食柿子原花青素后显著增加了早衰老鼠SAMP8的寿命,并且没有引起诸如跳跃、倒挂在笼子上等行为学上的改变。
国内外研究中,用于衰老研究的生物模型主要以果蝇和小鼠为主,近年来秀丽隐杆线虫(Caenorhabditis elegans)作为一种热点模式生物,因其生命周期短、个体小、易于培养[7],且在衰老进程方面,线虫与脊椎动物有保守一致的特点等[8],成为衰老研究中的首选模型[9]。本文选取来自葡萄籽中的原花青素作为材料,以衰老研究的热点生物秀丽隐杆线虫为模式生物,研究了不同浓度下原花青素对线虫寿命、运动能力、生殖能力、氧化应激和热应激等方面的影响,旨在评价葡萄籽原花青素延缓秀丽隐杆线虫衰老的效果,初步探讨其作用机制,为葡萄籽原花青素的深度利用提供理论基础。
1 材料与方法
1.1 材料与仪器
大肠杆菌(Escherichia coli)OP50、野生型秀丽隐杆线虫(C.elegans)N2中国人民解放军军事医学科学院惠赠;葡萄籽原花青素 陕西浩洋生物技术有限公司,纯度≥95%;百草枯 SIGMA-ALDRICH公司,纯度≥98%;琼脂粉 日本Japan公司;胰蛋白胨 英国OXOID公司;CaCl2分析纯,国药集团化学试剂有限公司;KH2PO4、K2HPO4、MgSO4·7H2O 分析纯,西陇化工股份有限公司;胆固醇、无水乙醇、NaCl 分析纯,北京化工厂。
HPG-400HX人工气候箱 中国深圳市永业昌机电有限公司;SMZ645体视显微镜 日本Nikon公司。
1.2 实验方法
1.2.1 线虫培养 采用Brenner[10]的方法,将雌雄同体线虫饲养与涂布大肠杆菌OP50(E.coliOP50)的线虫标准培养基(Nematode Growth Medium,NGM)上,培养温度20℃,观察线虫生长情况,定期将线虫转至新的涂有E.coliOP50的NGM培养基中。
NGM固体培养基配方(1L):氯化钠3g,琼脂粉17g,胰蛋白胨2.5g,加入975mL蒸馏水,120℃灭菌15min,55℃水浴15min后无菌条件下加入1mol/L CaCl2、1mol/L MgSO4及5mg/mL溶解于无水乙醇中的胆固醇各1mL和25mL 1mmoL/L pH6.0磷酸钾缓冲液,混匀后倒入培养皿。
线虫的同期化方法:参照Lakowski等[11]的方法,将处于产卵期的雌雄同体线虫置于含或者不含原花青素的NGM板中产卵1~2h,移走成虫,将平板置于20℃培养,卵孵化后,线虫的发育即处于同一时期。
1.2.2 线虫寿命测定 将葡萄籽原花青素用蒸馏水溶解,配制成19mg/mL的贮存液,用细菌过滤器过滤除菌,备用。实验设定对照组(原花青素终浓度为0μg/mL)、低剂量组(原花青素终浓度为100μg/mL)、中剂量组(原花青素终浓度为200μg/mL)和高剂量组(原花青素终浓度为300μg/mL)。将原花青素贮存液按照比例加入NGM培养基中,使其终浓度分别为100、200、300μg/mL,观察线虫对添加在NGM培养基中原花青素物质的生长发育反应。
按照同期化方法处理线虫,记录产卵当天为寿命实验第0d,注意在产卵期每天将线虫挑至新的涂有E.coliOP50的NGM板上。每天在显微镜下观察线虫,并记录线虫生存、死亡以及剔除出实验的数目。死亡判断标准:对机械刺激无任何反应即视为死亡。剔除标准:由于爬至平皿壁或盖上而干死;虫卵在体内孵化而成袋样虫导致死亡;钻进培养基中。
1.2.3 运动能力测定 分为对照组和200μg/mL原花青素组。按照同期化方法处理线虫,从第4d起,每天随机抽取50~60条线虫,记录线虫1min内走过的峰数。
1.2.4 生殖能力测定 分为对照组和200μg/mL原花青素组。将同期化处理后的L4期线虫挑取至NGM板中,每板挑取一只线虫,每组30个平板,此时记录生殖实验第1d。20℃培养,每隔8~12h将线虫挑至新的NGM板上,直至生殖能力丧失。计数产卵量,并将所有产卵板置于20℃孵育2d后计数子代数目,并统计孵化率。
1.2.5 应激实验
1.2.5.1 急性热应激实验 实验设定对照组(0μg/mL GSP)和原花青素组(200μg/mL GSP)。首先,将线虫进行同期化处理后置于20℃培养,为防止孵化的卵影响结果,产卵期每天将线虫挑至新培养基。参照Saul等[12]方法,在成年期的第6d,将线虫转至35℃进行培养,每小时计数线虫死亡、存活的数目,计算线虫在35℃时的热应激存活率。每组30条,重复3次。线虫死亡标准同寿命实验。
1.2.5.2 氧化应激实验 将百草枯用蒸馏水溶解,分别添加到NGM培养基和含有200μg/mL原花青素的NGM培养基中,使其终浓度为10mmol/L。然后将NGM培养基分组为:正常NGM培养基(0μg/mL GSP),含有200μg/mL原花青素的NGM培养基(200μg/mL GSP),含有10mmol/L百草枯的NGM培养基(10mmol/L Paraquat),含10mmol/L百草枯和200μg/mL原花青素的NGM培养基(10mmol/L Paraquat+200μg/mL GSP)。将线虫进行同期化处理后置于20℃培养,在成年期的第6d,将在正常NGM培养基中培养的秀丽隐杆线虫分别挑至正常NGM培养基(0μg/mL GSP)和含10mmol/L百草枯的NGM培养基(10mmol/L Paraquat)中;将在饲喂200μg/mL原花青素的秀丽隐杆线虫分别挑至含200μg/mL原花青素的NGM培养基(200μg/mL GSP)以及含10mmol/L百草枯和200μg/mL原花青素的NGM培养基(10mmol/L Paraquat+200μg/mL GSP)中,每隔24h记录线虫存活情况,统计线虫在氧化应激条件下的存活率(%)。每组30条,重复3次。
1.3 统计学方法
实验数据采用SPSS Statistics 20.0进行统计分析,以平均值±标准差表示,组间比较采用ANOVA分析。
2 结果与讨论
2.1 不同浓度原花青素对线虫寿命的影响
不同浓度的葡萄籽原花青素对线虫寿命的影响如图1所示。从线虫的全程生存情况看,与对照组(0μg/mL)相比,无论是采用中剂量组(200μg/mL)及高剂量组(300μg/mL)的原花青素饲喂线虫,均能使线虫生存曲线右移,但是采用低剂量组原花青素(100μg/mL)效果则不明显。
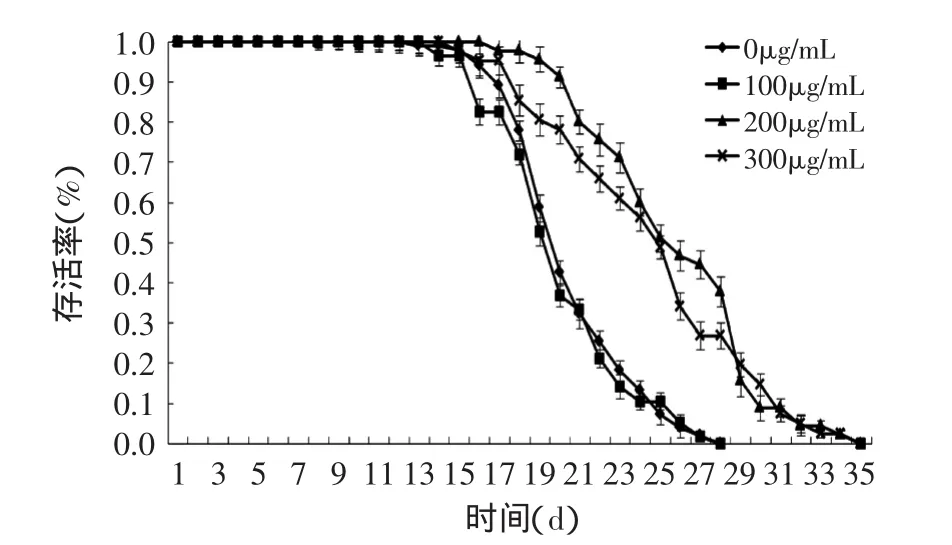
图1 线虫生存曲线Fig.1 Survival curves of C.elegans
如表1所示,就对照组而言,线虫的平均寿命为(20.6±3.0)d,最大寿命为(26.3±1.2)d。对中剂量组而言,线虫的平均寿命为(25.9±4.2)d,延长了25.7%(p<0.001);最大寿命为(32.6±1.9)d,延长了24.0%(p<0.01),与对照组相比,差异极显著。对高剂量组而言,线虫的寿命较对照组显著延长,其中平均寿命为(24.7±4.9)d,最大寿命达到(32.5±1.3)d,但对线虫寿命的延长效果不如中剂量组,所以选取200μg/mL作为最优剂量组,继续进行研究。

表1 不同浓度原花青素对秀丽隐杆线虫寿命的影响Table 1 Effects of procyanidins on the lifespan of C.elegans
Tadahiro等[13]研究了苹果原花青素对线虫衰老的影响,结果表明采用65、100μg/mL的苹果原花青素饲喂线虫,线虫的寿命延长效果分别为12.1%和12.0%,延长寿命效果相似。Wilson等[14]在蓝莓多酚研究中发现,与饲喂200μg/mL原花青素相比,取食67μg/mL原花青素能使秀丽隐杆线虫平均寿命的提高28%,寿命最大值提高14%。显然,不同植物中所含原花青素因种类与结构不同,原花青素延缓衰老的适宜剂量或许也存在差异。
2.2 原花青素对秀丽隐杆线虫运动能力的影响
与对照组相比,饲喂原花青素的秀丽隐杆线虫运动速度增加,显著差异从第6d开始,平均每天每分钟爬过的峰数显著延长13.2%(p<0.05),表明饲喂原花青素增加了线虫的运动能力,缓解了线虫运动能力随年龄的增加而下降的情况(图2)。

图2 原花青素对秀丽隐杆线虫运动能力的影响Fig.2 Effects of procyanidins on the movement of C.elegans
2.3 原花青素对秀丽隐杆线虫生殖能力的影响
饲喂原花青素后线虫的生殖峰期较对照组略有延迟(图3)。在对照组中,线虫的生育高峰期发生在第1d至第3d,且第2d最多。对于原花青素组,则线虫的生育高峰期发生在第2d至第4d,且第3d最多。与对照组相比,尽管在原花青素组线虫总产卵量低,但是与对照组相比并无统计学差异。将所有产卵板置于20℃孵育2d后计数子代数目,并统计孵化率(图4)。在对照组,线虫的孵化率为95.6%±1.2%,在原花青素组则为94.4%±1.4%,无统计学差异。
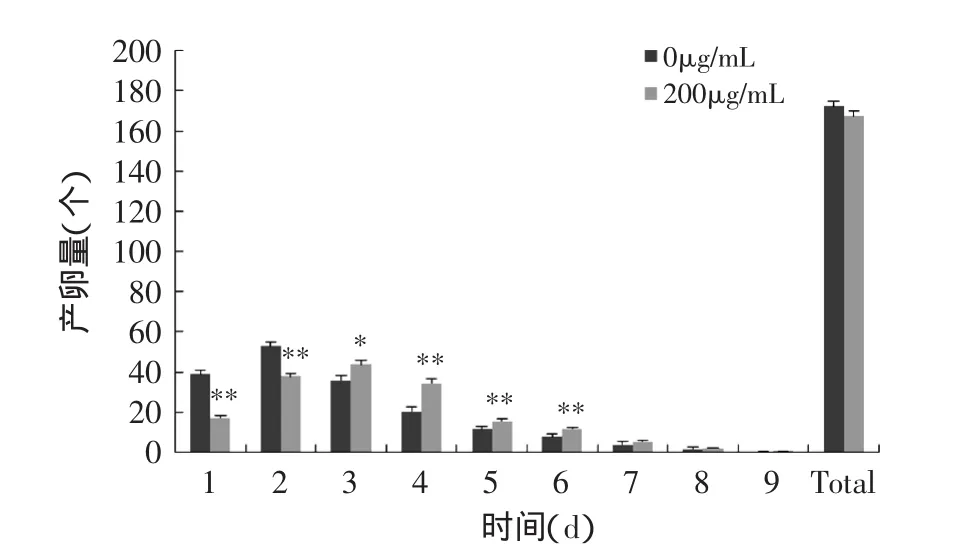
图3 原花青素对秀丽隐杆线虫产卵量的影响Fig.3 Effects of procyanidins on the reproduction of C.elegans
一般认为,寿命的延长或许与生殖能力存在固有的逆向关系[15]。但实验结果表明饲喂原花青素并没有影响秀丽隐杆线虫的生殖能力及卵的孵化率,也就是说取食原花青素后,线虫寿命的延长并不是以降低或丧失其生殖能力为代价的。自然界中,某些延长寿命的天然物也存在类似的现象[16],如儿茶素、槲皮素、蓝莓提取物等延长了秀丽隐杆线虫的寿命,但并没有影响产卵量[17-19]。

图4 原花青素对秀丽隐杆线虫孵化率的影响Fig.4 Effects of procyanidins on the hatchability of C.elegans
2.4 原花青素对秀丽隐杆线虫压力应激能力的影响
热应激胁迫条件下,在成年的第6d,将线虫转至35℃培养,饲喂原花青素组线虫的生存曲线明显右移。对照组(0μg/mL)的平均生存时间为(15.4±4.8)h,原花青素组的平均生存时间为(19.6±4.4)h,比对照组显著延长了27.3%(p<0.01)。表明饲喂原花青素能显著增强线虫的耐热能力(图5)。
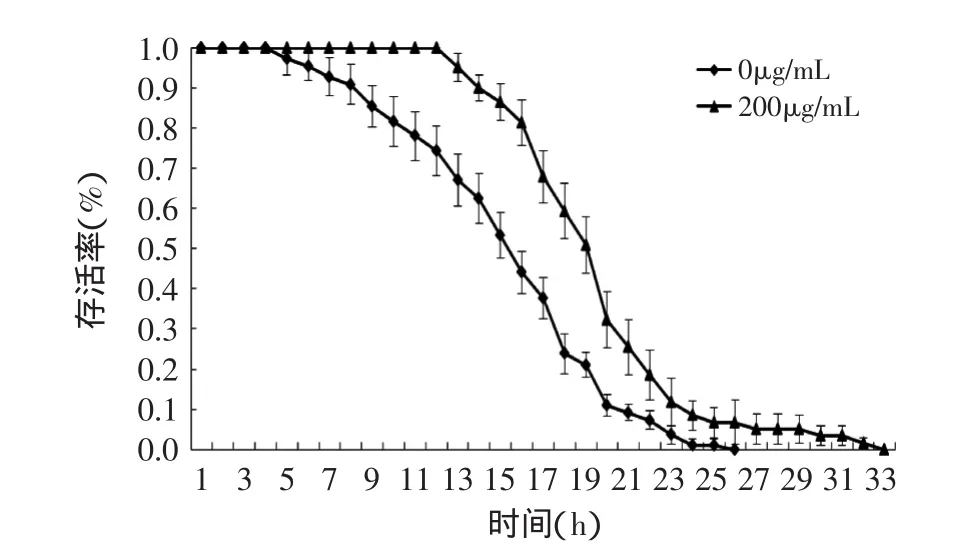
图5 热应激条件下线虫的生存曲线Fig.5 Survival curves of C.elegans in thermotolerance assays
线虫的生存曲线见图6。在百草枯诱导的氧化胁迫条件下,在含有10mmol/L百草枯的NGM培养基(10mmol/L Paraquat)中培养的秀丽隐杆线虫的平均存活时间为(64.9±2.6)h,在含有10mmol/L百草枯和200μg/mL原花青素的NGM培养基(10mmol/L Paraquat+200μg/mL GSP)中培养的线虫的平均存活时间为(72.2±2.8)h,平均生存时间较含10mmol/L百草枯组延长了11.2%(p<0.05),由此可见,在氧化应激胁迫条件下葡萄籽原花青素能够很好的保护秀丽隐杆线虫,缓解极端氧化条件对线虫的损伤。
寿命的延长与压力应激状态下生存率的提高有很强的正相关性,线虫在胁迫条件下存活率越高,则延长秀丽隐杆线虫寿命越好[20]。Wilson等[14]发现在35℃热应激16h的条件下,饲喂蓝莓多酚,线虫的存活率较对照组增加了2.5倍,但对于百草枯与H2O2所造成的氧化应激胁迫,饲喂蓝莓多酚并没有增加线虫的存活率。Pietsch等[21]发现,槲皮素不仅可以延长秀丽隐杆线虫的寿命,而且增加了线虫在热胁迫和氧化胁迫下的生存率。
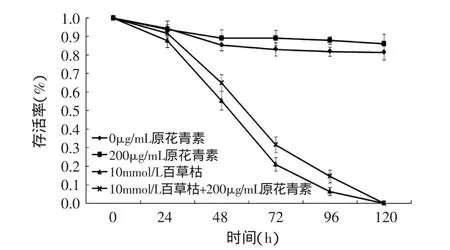
图6 氧化应激条件下线虫的生存曲线Fig.6 Survival curves of C.elegans in oxidative stress assays
3 结论
饲喂葡萄籽原花青素可以显著增加线虫的寿命,增强线虫的运动能力,延缓线虫的衰老过程,且200μg/mL原花青素或许有更好的延缓线虫衰老的效果,这种防止线虫寿命衰老的效果可能是通过改善压力应激条件下的生存率来达到的。
[1]单静敏,曹雁平,肖俊松,等.葡萄籽和苹果原花青素对变形链球菌和金黄色葡萄球菌的抑制作用[J].食品科学,2011,32(17):123-127.
[2]杨玉红,张慧.葡萄原花青素的生物学活性的简介[J].生物学通报,2008,43(9):16-18.
[3]江岩.新疆药桑葚花青素延缓衰老作用的研究[J].卫生研究,2010,39(4):451-453.
[4]Liu Y,Song X,Zhang D,et al.Blueberry anthocyanins:protection against ageing and light-induced damage in retinal pigment epithelial cells[J].The British Journal of Nutrition,2012,108(1):16-27.
[5]Chio MJ,Kim BK,Park KY,et al.Anti-aging effects of cyanidin under a stress-induced premature senescence cellular system[J].Biological and Pharmaceutical Bulletin,2010,33(3):421-426.
[6]Yokozawa T,Lee YA,Zhao Q,et al.Persimmon oligomeric proanthocyanidins extend life span of senescence-accelerated mice[J].Journal of Medicinal Food,2009,12(6):1199-1205.
[7]Wang D,Xing XJ.Assessment of locomotion behavioral defects induced by acute toxicity from heavy metal exposure in nematodeCaenorhabditis elegans[J].Journal of Environmental Sciences,2008,20(9):1132-1137.
[8]EvasonK,Huang C,Yamben I,et al.Anticonvulsant medications extend worm life-span[J].Science,2005,307:258-262.
[9]JohnsonTE.Caenorhabditiselegans2007:Thepremiermodelfor the study of aging[J].Experimental Gerontology,2008,43(1):1-4.
[10]BrennerS.ThegeneticsofCeanorhabditis elegans[J].Genetics,1974,77(1):71-94.
[11]Lakowski B,Hekimi S.The genetics of caloric restriction inCaenorhabditis elegans[J].Proceedings of the National Academy of Sciences of the United States of America,1998,95(22):13091-13096.
[12]Saul N,Pietsch K,Stürzenbaum SR,et al.Diversity of polyphenol action inCaenorhabditis elegans:between toxicity and longevity[J].Journal of Natural Products,2011,74(8):1713-1720.
[13]Sunagawa T,Shimizu T,Kanda T,et al.Procyanidins from apples(Malus pumila Mill.)extend the lifespan ofCaenorhabditis elegans[J].Planta Medica,2011,77(2):122-127.
[14]Wilson MA,Shukitt-Hale B,Kalt W,et al.Blueberry polyphenols increase lifespan and thermotolerance inCaenorhabditis elegans[J].Aging Cell,2006,5(1):59-68.
[15]Partridge L,Gems D,Withers DJ.Sex and death:what is the connection[J].Cell,2005,120(4):461-472.
[16]Kenyon C.The plasticity of aging:insights from long-lived mutants[J].Cell,2005,120(4):449-460.
[17]Saul N,Pietsch K,Menzel R,et al.Catechin induced longevity inC.elegans:From key regulator genes to disposable soma[J].Mechanisms of Ageing and Development,2009,130(8):477-486.
[18]Pietsch K,Saul N,Menzel R,et al.Quercetin mediated lifespan extension inCaenorhabditis elegansis modulated by age-1,daf-2,sek-1 and unc-43[J].Biogerontology,2009,10(5):565-578.
[19]Guha S,Cao M,Kane RM,et al.The longevity effect of cranberry extract inCaenorhabditis elegansis modulated by daf-16 and osr-1[J].Age,2013,35(5):1559-1574.
[20]Lithgow GJ,Walker GA.Stress resistance as a determinate ofC.eleganslifespan[J].Mechanisms Ageing and Development,2002,123(7):765-771.
[21]Pietsch K,Saul N,Chakrabarti S,et al.Hormetins,antioxidants and prooxidants:defining quercetin-,caffeic acid-and rosmarinic acid-mediated life extension inC.elegans[J].Biogerontology,2011,12(4):329-347.
