低盐腌制大头菜腐败菌的分离与初步鉴定
2014-07-25胡怀容鲜欣言张友华蒋梦琳李明元
胡怀容,张 庆,2,鲜欣言,唐 萍,张友华,蒋梦琳,李明元,2,*
(1.西华大学生物工程学院,四川省食品生物技术重点实验室,四川成都 610039;2.西华大学古法发酵(酿造)生物技术研究所,四川成都 610039;3.宜宾戎陈坊食品有限公司,四川宜宾 644000)
大头菜学名芥菜,十字花科二年生草本植物,是中国著名的特产蔬菜。除高寒和干旱地区外,大头菜在我国不存在分布边界,为全国各地栽培的常用蔬菜,其富含VA、胡萝卜素,但由于其组织坚脆且具有刺激舌头和鼻窦的芥辣味,不宜鲜食,常被制成腌制品。腌制大头菜作为我国传统的腌制加工蔬菜,名闻全国,享有较大的声誉,深受广大消费者喜爱,是人们日常生活的消费食品。
目前大头菜生产总体处于粗放作坊式加工状态,以传统自然发酵工艺为主,生产技术相对较落后,劳动密集型产业较多[1]。在传统工艺下,缺乏操作规范,往往造成产品货架期短、腐败变质严重和质量不统一。为满足人们低盐饮食的需求,大量厂家不惜大量加入超过国家标准的防腐剂。袋装酱腌菜,尤其是低盐的酱腌菜在贮、运、销过程中易被有害微生物污染,发生腐败变质[2]。本实验针对3~5月份包装销售的腌制大头菜易变质的现象,多次对不同生产批次的真空包装腌制大头菜感官检测,发现两类情况:第一类,腌制大头菜色泽变暗、脆度降低;第二类,腌制大头菜表面有白色物质且发粘,滋气味发生明显改变,发生胀袋。因此,本研究对上述两类腐败变质腌制大头菜的微生物进行分离鉴定及系统发育分析,确定腐败微生物的种类,以期为低盐腌制大头菜防腐保藏技术研究提供依据。
1 材料与方法
1.1 材料与仪器
原材料 经高温灭菌真空包装后发生腐败变质的腌制大头菜,宜宾戎陈坊食品有限公司;培养基 孟加拉红培养基,营养琼脂培养基,酵母浸出粉胨葡萄糖培养基,营养肉汤;蛋白胨、牛肉膏、酵母膏、琼脂 北京奥博星生物技术有限责任公司;琼脂糖 购自invitrogen;E.Z.N.ATM.Gel Extraction Ki t、E.Z.N.ATM.Plasmid Mini KitⅠ 购自Omegabiotek;Premix TaqTM购自TaKaRa Biotechnology(Dalian)Co.,Ltd.;pGMT Ligation Kit试剂盒(TIANGEN VT202-01) 购自天根生化科技(北京)有限公司。
SGSP-02电热恒温隔水式培养箱 黄石市恒丰医疗器械有限公司;SW-CJ-2F双人双面净化工作台 苏州净化设备有限公司;LDZX-40AI立式自动压力蒸汽灭菌锅 上海三申医疗核子仪器厂;电子天平 北京赛多利斯仪器系统有限公司;Eppendorf PCR扩增仪,PHS-3C酸度计 方舟科技。
1.2 实验方法
1.2.1 实验原材料检测项目
1.2.1.1 pH测定 用PHS-3C型酸度计测定产品pH,参照GB10468-89。
1.2.1.2 总酸测定 采用酸碱滴定法测定产品中的总酸度,参照GB/T12456-2008。
1.2.1.3 含盐量的测定 直接沉淀滴定法,参照GB/T12457-2008。
1.2.1.4 对腐败变质的腌制大头菜感官检查 参照SBT 10439-2007。
1.2.2 腐败微生物的分离和形态学鉴定[3-4]在无菌操作条件下,称取25g样品剪碎后加入到盛有225mL无菌水三角瓶中,振荡混匀,再以无菌水进行梯度稀释。取10-1~10-4稀释液于培养皿中,倒入灭菌且冷却至45℃左右的孟加拉红、营养琼脂培养基,分别在30、37℃恒温箱中培养。细菌培养14h和24h,酵母菌培养48h。选择菌落数合适的平板,挑取单菌落反复划线分离,纯化菌株,获得纯培养物。
1.2.3 腐败微生物基因组DNA的提取[5]采用改进的SDS-CTAB法提取基因组DNA。
1.2.4 16 S rDNA、26S rDNA的D1/D2序列的PCR扩增和产物纯化[6-7]序列如下所示:
16S rDNA序列PCR反应引物:
EU27F:5′-AGAGTTTGATCCTGGCTCAG-3′
1490R:5′-GGTTACCT TGTTACGACTT-3′
反应条件:94℃ 5min;94℃ 1min,56℃ 1min,72℃2min,35个扩增循环;72℃ 10min。
26S rDNA的D1/D2序列的PCR反应引物:
NL1∶5′-GCATATCAATAAGCGGAGGAAAAG-3′
NL4:5′-GGTCCGTGTTTCAAGACGG-3′
反应条件:94℃ 5min;94℃ 1min,52℃ 1min,72℃2min,35个扩增循环;72℃ 10min。
PCR产物经质量分数为0.7%的琼脂糖电泳检测后,回收PCR产物,-20℃保存备用。
1.2.5 测序及构建系统发育树 16S rDNA序列扩增的产物电泳检测回收后,采用pGM-T Ligation Kit试剂盒(TIANGEN VT202-01)与pGM-T载体克隆入E.coli DH5α,挑选阳性克隆子,提取重组质粒。将重组质粒和经电泳检测回收后的26S rDNA D1/D2序列PCR扩增产物送成都博瑞克生物技术有限公司测序,将得到的序列用GenBank中 BLAST进行相似序列检索分析,用Clustal X软件进行多序列比对,采用MEGA 4.0软件的邻接法(Neighbor-joining)构建系统发育树,分析真空包装腌制大头菜腐败微生物的分类学地位。
2 结果与分析
2.1 实验原材料检测
以不发生腐败腌制大头菜为对照,对两类变质腌制大头菜的检查统计结果见表1。
由表1可知,真空包装低盐腌制大头菜在流通贮藏期间,发生腐败变质的腌制大头菜酸度、含盐量都降低,产品外观色泽、滋气味发生改变。
2.2 腐败微生物的分离和形态学鉴定
以10-2的样品稀释液接种平板上计数和观察,细菌在营养琼脂上培养14h和24h,酵母菌在孟加拉红培养基上培养48h。通过微生物学传统培养和划线分离法从色泽变暗、脆度降低的第一类腐败变质腌制大头菜中得到7种细菌,形态学鉴定结果见表2,其中菌株6是在培养24h后分离得到,这可能是吉氏芽孢杆菌适合碱性环境,在略偏酸的环境下,长势较慢;在滋气味明显改变,发粘的第二类腐败变质腌制大头菜中得到3种细菌,2种酵母,形态学鉴定结果见表3。

表1 低盐腌制大头菜感官检查、酸度、糖及盐含量Table 1 Sensory examination,acidity,the content of sugar and salt with Low-salinity Pickled Turnip
2.3 16S rDNA、26S rDNA的D1/D2序列的PCR扩增和产物纯化
用改进的SDS-CTAB法分别提取细菌X1、X2、X3、X4、X5、X6、X7和酵母Y1、Y2共9株菌的基因组DNA,以此为模板,用引物Eu27f和1490R PCR扩增16S rDNA序列,用引物NL1和NL4 PCR扩增26S rDNA的D1/D2序列。PCR产物经质量分数为0.7%的琼脂糖电泳检测,7株细菌进行16S rDNA全长序列的PCR扩增;2株酵母进行26S rDNA的D1/D2序列扩增后,都得到了稳定且清晰的特异条带,片段分别大约1500bp和600bp,结果如图1、图2所示。

图1 菌株的16S rDNA电泳图谱Fig.1 PCR amplification of 16S rDNA

图2 菌株的26S rDNA电泳图谱Fig.2 PCR amplification of 26S rDNA
2.4 系统发育分析
将测序结果经BLAST分析多重比对后,利用MEGA4.0构建系统发育树,得到与测序菌株亲缘关系最近的菌株,结果见图3、图4。Stackebrandt等[8]认为当16S rRNA的序列同源性≥97%时可以认为是一个属,序列同源性≥98%时则可以认为是一个种。从腐败变质的真空包装腌制大头菜中分离得到7株细菌,2株酵母,其中5株为Bacillus属,1株为Lysinibacillus属,2株为Candida属,1株为非培养细菌的同源菌。由图3可知,菌株X5和Lysinibacillus sphaericus相似性为97%,其余菌株的相似性为99%~100%,菌株X1与芽孢杆菌属的Bacillus sp.WPCB 165亲缘关系最近,菌株X2与芽孢杆菌属的枯草芽孢杆菌Bacillus subtilis strain Y J001亲缘关系最近,菌株X3与芽孢杆菌属的巨大芽孢杆菌Bacillus megaterium strain PRE9亲缘关系最近,菌株X4与芽孢杆菌属的嗜硼芽孢杆菌Bacillus boroniphilus strain CM25亲缘关系最近,菌株X5与球形赖氨酸芽孢杆菌Lysinibacillus sphaericus亲缘关系最近,菌株X6与芽孢杆菌属的Bacillus gibsonii strain S-2亲缘关系最近,菌株X7与Uncultured bacterium clone GZ84亲缘关系最近;由图4可知,菌株Y1与念珠菌属的Candida pararugosa strain UWFP-348亲缘关系最近,菌株Y2与念珠菌属的Candida zemplinina strain CEC RMe-S-7亲缘关系最近。

表2 第一类腐败变质低盐腌制大头菜中细菌特征Table 2 The properties of bacteria in the first spoilage Low-salinity Pickled Turnip

表3 第二类腐败变质低盐腌制大头菜中细菌、酵母特征Table 3 The properties of bacteria、yeast in the second spoilage Low-salinity Pickled Turnip
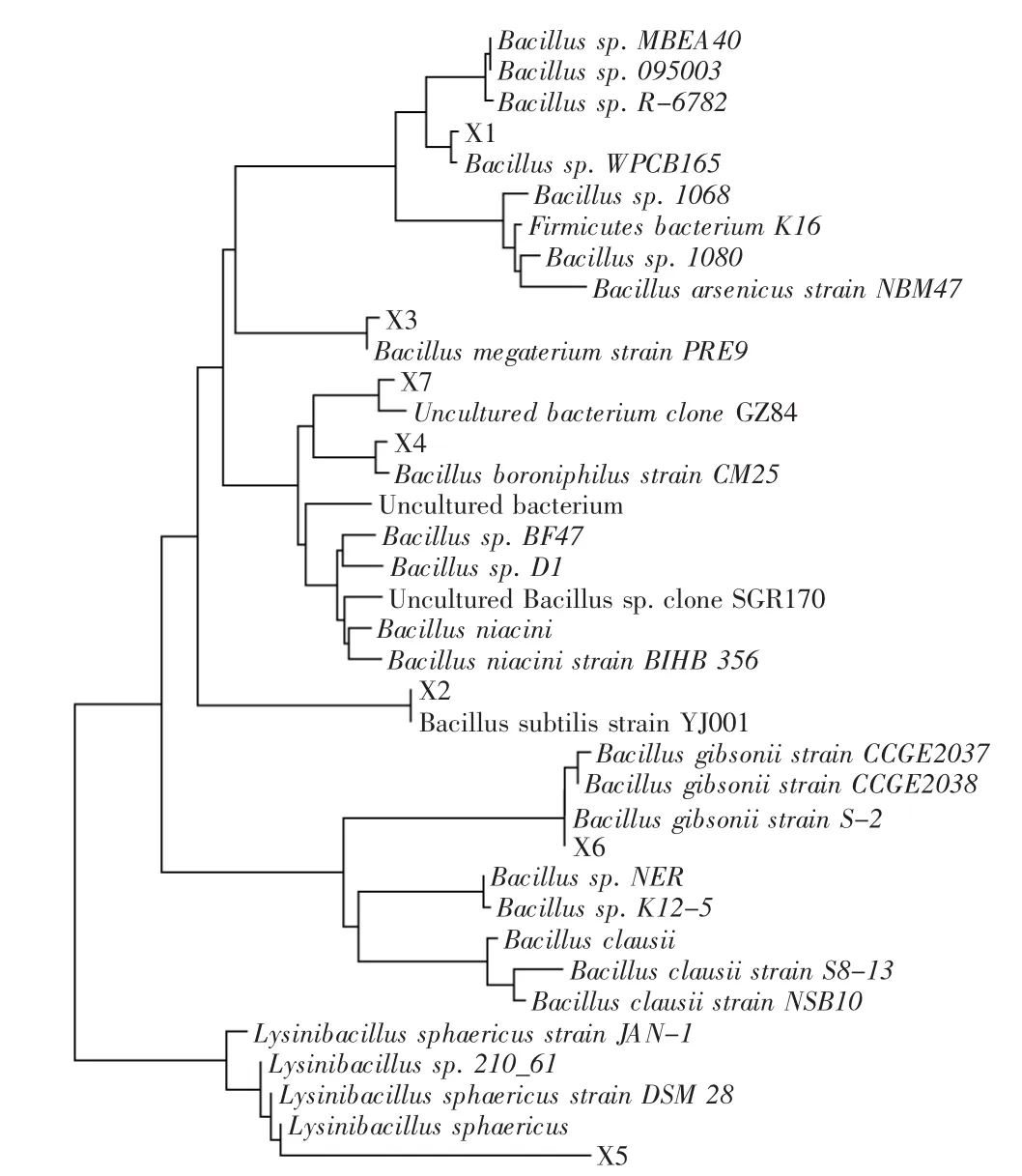
图3 细菌系统发育树Fig.3 Phylogenetic tree of bacteria
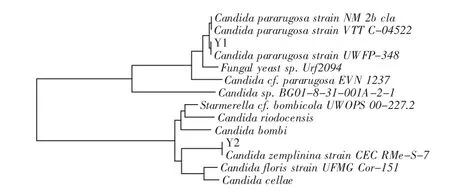
图4 酵母系统发育树Fig.4 Phylogenetic tree of yeast
2.5 腐败微生物分析
对腐败变质腌制大头菜的两类情况进行微生物分布分析,结果见图5、图6。由此可知,在色泽变暗、脆度降低的第一类腐败变质腌制大头菜中,未分离到酵母菌,主要是芽孢杆菌属,其中Bacillus sp.所占比列达到34%;在滋气味明显改变,发粘的第二类腐败变质腌制大头菜中,分离得到3株芽孢杆菌属细菌和2株酵母,且2株酵母所占比列高达88%。
3 结论与讨论
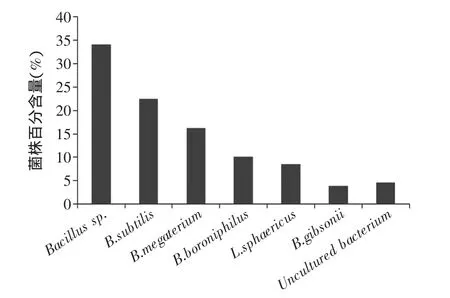
图5 第一类变质腌制大头菜微生物分布Fig.5 The distribution of microorganism in the first spoilage Low-salinity Pickled Turnip
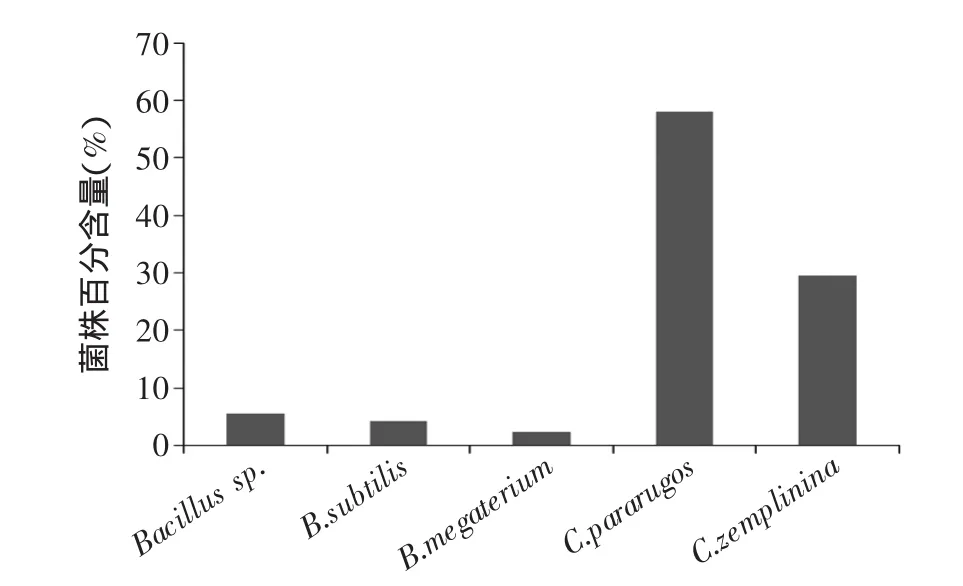
图6 第二类变质腌制大头菜微生物分布Fig.6 The distribution of microorganism in the second spoilage Low-salinity Pickled Turnip
本实验通过微生物学传统分离培养方法,从发生腐败变质的腌制大头菜中,分离得到7株细菌菌株,2株酵母菌株。提取菌株基因组DNA,PCR扩增16S rDNA、26S rDNA D1/D2序列,16S rDNA序列PCR扩增产物经连接转化反应,获得重组质粒。将测序结果用GenBank中BLAST进行相似序列检索分析,构建系统发育树,发现7株细菌以Bacillus属为主,2株酵母都为Candida属。经革兰氏染色,7株细菌全为阳性,其中菌株X1~X3产酸不产气,X4~X7不产酸不产气,菌株Y1、Y2产气不产酸。
相关文献报道,蔬菜腌制品中的腐败微生物主要是芽孢杆菌属和酵母菌,其中大多数为枯草芽孢杆菌、巨大芽孢杆菌、坚强芽孢杆菌[9-11]。本次实验中,分离得到的腐败微生物,与之前的报道相符,同时也存在差异性。Lysinibacillus sphaericus在色泽变暗、脆度降低的第一类腐败变质腌制大头菜中所占比例为9%,是其中的次优势腐败微生物,在以往腌菜制品的文献中未见报道,但刘海等曾在“花壳”干辣椒中分离得到[12];目前,关于腌菜制品中的腐败酵母研究不多[9-10],由酵母引起的再发酵现象,可通过加热至60~70℃即可达到杀菌目的[13],但酵母菌对食盐的耐受力比细菌大得多,能耐受较低的pH[14],本研究在低盐腌制大头菜中分析发现了Candida pararugosa、Candida zemplinina两株酵母,在滋气味明显改变,发粘的第二类腐败变质腌制大头菜中占88%比例,为优势菌株。Candida pararugosa曾在酸粥中分离得到[15],Candida zemplinina是葡萄酒中常见的酿酒酵母菌[16-21]。
低盐腌制大头菜营养丰富、水分活度较高,腐败微生物极容易生长和繁殖,加上生产加工所用辅料种类多、来源复杂,源头污染和二次污染难以控制。如只采用传统的高温水浴法处理,部分耐热微生物和产品因受热不均遗留的微生物仍然能残存,极容易导致腌制大头菜发生微生物性腐败。在工厂化的批量生产中,袋装量、高温灭菌温度与时间影响灭菌效果,冯作山等[22]曾研究过,腌制大头菜高温灭菌温度和时间受产品质量控制、受热不均可能是腌制大头菜中有酵母残存的主要原因。本研究从腌制大头菜分离得到的腐败微生物主要是芽孢菌和酵母,可作为低盐腌制大头菜的防腐保鲜处理中的目标菌,为下一步进行灭菌工艺和防腐剂的筛选结合应用研究提供指导方向。
[1]刘达玉,董凯锋,王卫,等.发酵大头菜产业化生产工艺与技术[J].中国蔬菜,2012(23):47-49.
[2]王向阳,姜丽佳.真空包装腌萝卜干中腐败微生物的抑制研究[J].中国调味品,2009,34(7):68-72.
[3]孙磊.腌制蔬菜中复合防腐剂的开发和应用研究[D].合肥:合肥工业大学,2010.
[4]东秀珠,蔡妙英.常见细菌系统鉴定手册[M].北京:科学出版社,2001.
[5]奥斯伯.精编分子生物学实验指南[M].北京:科学出版社,2001.
[6]田伟,张琦,邓珍珍,等.利用 16S rRNA分析传统四川发酵泡菜中的细菌多样性[J].食品科学,2013,34(17):215-218.
[7]Kurtzman C P,Robnett C J.Identification and phylogeny of ascomycetous yeasts from analysis of nuclear large subunit(26S)ribosomal DNA partial sequences[J].Antonie van Leeuwenhoek,1998,73(4):331-371.
[8]Stackebrandt E,Goebel B M.Taxonomic note:a place for DNA-DNA reassociation and 16S rRNA sequence analysis in the present species definition in bacteriology[J].International Journal of Systematic Bacteriology,1994,44(4):846-849.
[9]吴丹,陈健初,叶兴乾,等.榨菜腐败微生物的分离,鉴定及生物学特性研究[J].浙江大学学报:农业与生命科学版,2009,35(2):135-140.
[10]王敏,张耀相,肖翔.高盐酱腌菜坯致腐微生物的分离鉴定[J].中国调味品,2003(5):19-26.
[11]付晓红,杨迎伍,邓伟,等.腌制萝卜腐败微生物的分离及其特性研究[J].食品工业科技,2008,29(8):132-134.
[12]刘海,丁筑红,郑文宇,等.辣椒“花壳”主要致变细菌的分离及鉴定[J].食品科学,2013,34(1):160-165.
[13]张爽.酱腌菜防腐保鲜技术研究进展[J].安徽农业科学,2011,39(11):6538-6539.
[14]肖凯军,郭祀远.酱腌菜保鲜的初步研究[J].中国食品添加剂,1998(2):13-16.
[15]白梅,王娟,卿蔓君,等.内蒙古西部区酸粥中酵母菌的分离鉴定及优势菌分析[J].微生物学通报,2010,37(9):1299-1304.
[16]Li S S,Cheng C,Li Z,et al.Yeast species associated with winegrapesinChina[J].InternationalJournalofFoodMicrobiology,2010,138(1):85-90.
[17]Alessandria V,Giacosa S,Campolongo S,et al.Yeast population diversity on grapes during on-vine withering and their dynamics in natural and inoculated fermentations in the production of icewines[J].Food Research International,2013,54(1):139-147.
[18]Tofalo R,Schirone M,Torriani S,et al.Diversity ofCandida zemplinina strainsfrom grapes and Italian wines[J].Food Microbiology,2012,29(1):18-26.
[19]Kraková L,Chovanová K,Ženišová K,et al.Yeast diversity investigation of wine-related samples from two different Slovakian wine-producing areas through a multistep procedure[J].LWTFood Science and Technology,2012,46(2):406-411.
[20]王泽举,王汝瑱,杨莹.几株酵母菌的分子系统学鉴定[J].食品科学,2012,33(15):195-200.
[21]李艳,卢君,张利中,等.沙城龙眼葡萄自然发酵过程相关酵母生物多样性研究[J].食品科学,2009(21):237-240.
[22]冯作山,热合曼.袋装酱腌菜的防腐保藏技术研究[J].新疆农业大学学报,2000,23(2):60-62.
