Bevacizumab对视网膜色素上皮细胞纤维化相关因子表达的影响△
2014-07-25张敏储三军曾繁星徐海峰
张敏 储三军 曾繁星 徐海峰
Bevacizumab对视网膜色素上皮细胞纤维化相关因子表达的影响△
张敏 储三军 曾繁星 徐海峰
Bevacizumab;视网膜色素上皮细胞;纤维化;细胞因子
目的观察Bevacizumab 对人视网膜色素上皮细胞纤维化相关因子基因及蛋白表达的影响,探讨Bevacizumab 在新生血管纤维化中的作用。方法用含终浓度0.25 g·L-1Bevacizumab 的DMED/F12培养液培养ARPE-19细胞,按Bevacizumab 处理的时间分为0 h、6 h、12 h、24 h和48 h共5组,0 h为对照组。不同时间点收集细胞及上清。用逆转录聚合酶链反应检测ARPE-19细胞中结缔组织生长因子(connective tissue growth factor,CTGF)、碱性成纤维细胞生长因子(basic fibroblast growth factor,bFGF)、转化生长因子-β2(transforming growth factor β2,TGF-β2)和基质金属蛋白酶-2(matrix metalloproteinase 2,MMP-2)的mRNA相对表达量。采用ELISA检测上清中CTGF、bFGF和 TGF-β2的蛋白浓度,应用免疫蛋白印迹法 (Western blotting)检测MMP-2蛋白的表达。结果Bevacizumab 作用后6 h、12 h、24 h和48 h,CTGF、 bFGF、TGF-β2及MMP-2 的mRNA相对表达量分别为CTGF:1.694±0.160、1.994±0.221、1.733±0.057、1.397±0.075,bFGF:1.720±0.068、2.144±0.080、1.893±0.068、1.372±0.076,TGF-β2:1.356±0.070、1.737±0.515、1.576±0.098、1.439±0.050,MMP-2:1.414±0.115、1.644±0.094、1.435±0.075、1.285±0.024,与对照组相比均升高,差异均有统计学意义(均为P<0.05)。ELISA结果显示Bevacizumab 作用后6 h、12 h、24 h和48 h,CTGF 、bFGF、TGF-β2蛋白的表达量与对照组相比均升高,差异均有统计学意义(均为P<0.05);对照组及各时间组蛋白浓度分别为CTGF:(31.949±0.388)ng·L-1、(48.697±0.863)ng·L-1、(56.847±0.499)ng·L-1、(51.753±1.395)ng·L-1、(43.085±1.240)ng·L-1,bFGF:(26.660±1.360)ng·L-1、(46.529±3.297)ng·L-1、(55.883±1.705)ng·L-1、(47.937±1.303)ng·L-1、(36.894±2.532)ng·L-1,TGF-β2:(26.982±2.404)ng·L-1、(35.452±1.360)ng·L-1、 (46.787±0.896)ng·L-1、(43.683±1.630)ng·L-1、(38.008±1.110)ng·L-1。Western blotting结果显示,Bevacizumb处理后6 h、12 h、24 h、48 h MMP-2蛋白含量升高,组间比较差异有统计学意义(F=2620.429,P=0.000)。结论Bevacizumab 能够上调人RPE细胞中CTGF、bFGF、TGF-β2及MMP-2的表达,可能有促纤维化形成的作用。
[眼科新进展,2014,34(4):318-321]
Bevacizumab 是人源化抗血管内皮生长因子(vascular endothelial growth factor,VEGF)的IgG单克隆抗体,被美国食品药品安全局批准用于治疗结肠癌,现在被广泛用于脉络膜新生血管(choroidal neovascularization,CNV)性疾病的治疗[1],其疗效及安全性均得到确认。然而,研究发现湿性年龄相关性黄斑变性(age-related macular degeneration,AMD)患者接受抗VEGF治疗后可发生严重的黄斑部视网膜下纤维膜增殖,这些患者均无明显的黄斑部视网膜下出血,因而排除了局部出血导致纤维化的可能[2]。视网膜色素上皮(retinal pigment epithelium,RPE)细胞能够分泌多种细胞因子,参与多种病理改变的过程,在CNV的发生发展中发挥着重要作用。其分泌的结缔组织生长因子(connective tissue growth factor,CTGF)、碱性成纤维细胞生长因子(basic fibroblast growth factor,bFGF)、转化生长因子-β2(transforming growth factor β2,TGF-β2)和基质金属蛋白酶-2(matrix metalloproteinase 2,MMP-2)能够促进纤维化发生[3]。Bevacizumab治疗后黄斑下纤维膜的发生机制不清,是否与RPE细胞功能改变有关尚不得而知。因此,本研究将在体外观察Bevacizumab是否影响RPE细胞表达上述与纤维化相关的细胞因子,从而探究Bevacizumab促纤维化的发生机制。
1 材料与方法
1.1材料人RPE细胞系ARPE-19 (美国ATCC公司,CRL-2302),DMEM/F12培养基(美国Invitrogen公司),胎牛血清(美国Invitrogen公司),胰蛋白酶(美国Invitrogen公司),总RNA提取试剂盒(美国Macherey-nagel公司),反转录试剂盒(日本TaKaRa公司),Real Master Mix(SYBR Green)试剂盒(北京天根生化科技有限公司),人CTGF、bFGF、TGF-β2ELISA试剂盒(美国R&D公司)。MMP-2抗体(兔抗人抗体,美国Abcam公司),羊抗兔荧光二抗(北京中杉金桥生物技术有限公司)。
1.2方法
1.2.1细胞培养及实验分组ARPE-19细胞按说明复苏、培养(DMEM/F12 培养液含体积分数10%胎牛血清、100×103U·L-1青霉素、0.1 g·L-1链霉素,于37 ℃、含体积分数5%CO2培养箱内培养)、传代。细胞达足够数量后以每孔400×103接种于6孔板。按Bevacizumab处理的时间分为0 h、6 h、12 h、24 h和48 h 5组,0 h为对照组。Bevacizumab终浓度为0.25 g·L-1。
1.2.2RT-PCR检测CTGF、bFGF、TGF-β2及MMP-2的mRNA表达水平在不同时间点收集细胞,按照试剂盒说明提取各组细胞mRNA。根据反转录试剂盒说明书对提取的VEGF、CTGF、bFGF、TGF-β2及MMP-2的mRNA进行反转录。引物由大连宝生物有限公司设计并合成,引物序列见表1。 PCR反应条件:95 ℃预变性10 s,95 ℃变性15 s,60 ℃退火60 s,共50个循环。获取各组样品的标准曲线,以GAPDH为内参分析其Ct值。根据公式2-(ΔCt GAPDH-ΔCt 样品)算出待测样品相对值。实验重复3次。
1.2.3ELISA法检测CTGF、bFGF、TGF-β2蛋白表达不同时间点收集细胞培养的上清。高速冷冻离心机(温度设定为4 ℃)1000 r·min-1离心5 min,小心留取上清液,于4 ℃保存,按照R&D公司提供的试剂盒说明书进行操作。
1.2.4Westernblotting测定MMP-2蛋白的表达不同时间点收集细胞,提取各组细胞总蛋白。BCA蛋白定量试剂盒测定蛋白浓度,按每个样本50 μg总蛋白上样,100 g·L-1SDS-聚丙烯酰胺凝胶电泳;4 ℃,100 mA电转膜3 h,50 g·L-1脱脂奶粉室温封闭1 h,滴加MMP-2一抗(浓度为1800)4 ℃过夜。第2天滴加辣根过氧化物酶标记的二抗(山羊抗兔IgG,浓度为 13000)室温孵育1 h。免疫反应结束后用Western blotting荧光剂发光、显影。Gel-Del凝胶成像系统照相,应用Image J图像分析软件,通过目的基因与内参条带的吸光度值比值进行目的蛋白的相对含量分析。

表1 RT-PCR SYBR Green法引物序列Table 1 Primer sequence of SYBR Green RT-PCR

2 结果
2.1RT-PCR检测不同时间点CTGF、bFGF、TGF-β2和MMP-2的mRNA表达CTGF、bFGF、TGF-β2和MMP-2 的mRNA表达量在对照组、6 h组、12 h组、24 h组和48 h组五组间总体比较差异均有统计学意义(均为P<0.01)。6 h组、12 h组、24 h组和48 h组的CTGF、bFGF、TGF-β2和MMP-2 的mRNA表达量高于对照组,差异均有统计学意义(均为P=0.000,见表2)。
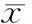
表2 Bevacizumab对ARPE-19细胞CTGF、bFGF、TGF-β2和MMP-2的mRNA表达的影响Table 2 Effects of Bevacizumab on expressions of CTGF, bFGF, TGF-β2 and MMP-2 mRNA in ARPE-19 cells(±s)
2.2ELISA检测Bevacizumb对ARPE-19细胞CTGF、bFGF、TGF-β2蛋白表达的影响CTGF、bFGF、TGF-β2蛋白表达量在对照组、6 h组、12 h组、24 h组和48 h组5组间总体比较差异均有统计学意义(均为P<0.01)。6 h组、12 h组、24 h组和48 h组的CTGF、bFGF、TGF-β2的蛋白表达量高于对照组,差异均有统计学意义(表3)。
2.3Westernblotting检测各组MMP-2蛋白表达Bevacizumb处理6 h、12 h、24 h和48 h后,MMP-2蛋白相对表达量分别为2.18±0.03、2.81±0.01、2.20±0.01和1.80±0.01,均较对照组(1.46±0.03)升高,差异均有统计学意义(均为P<0.01;见图1)。
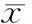
表3 Bevacizumab对ARPE-19细胞CTGF、bFGF、TGF-β2蛋白表达的影响Table 3 Effects of Bevacizumab on expressions of CTGF, bFGF and TGF-β2 protein in ARPE-19 cells(±s,ρ/ng·L-1)
3 讨论
玻璃体腔注射VEGF单克隆抗体被越来越多地用于眼部新生血管性疾病的治疗[4-7]。Bevacizumab可以与VEGF-A所有亚型结合,使内源性的VEGF失去活性,有效减少血管渗漏、使新生血管萎缩。然而随着抗VEGF制剂的广泛应用及随访时间延长,人们发现抗VEGF治疗后无论是CNV还是视网膜新生血管均可发生严重的纤维化,接受玻璃体腔注射Bevacizumab 后,AMD的患者可发生纤维膜增殖,增生性糖尿病视网膜病变(proliferative diabetic retinopathy,PDR)患者可发生新生血管纤维化而导致牵拉性视网膜脱离[8-9]。虽然纤维化是新生血管的必然结局,但抗VEGF治疗与纤维化的因果关系尚不清楚。在糖尿病患者的纤维血管膜中CTGF、bFGF、TGF-β2以及MMP-2的表达量是明显升高的[10-13]。我们推测这些因子可能也参与AMD中CNV纤维化的形成,因此本研究监测了Bavacizumab对RPE细胞的影响,结果表明Bevacizumab 可改变RPE细胞纤维化相关细胞因子的表达,上调CTGF、bFGF、TGF-β2、MMP-2的表达水平,从而促进纤维化形成。
CTGF是目前有关纤维化研究最多的因子之一,研究发现多种组织细胞都可表达CTGF,而且在组织过度纤维化、创伤修复、血管形成、肿瘤生长、发育分化等方面有着重要的作用[14],Van Geest等[8]发现PDR患者玻璃体腔注射Bevacizumab 后CTGF/VEGF的比值升高,认为CTGF是促纤维化形成的重要因子,将来有可能成为新生血管治疗的新的靶点。我们的研究结果也显示了Bevacizumab 可以上调CTGF的表达,这一结果进一步说明了抗VEGF治疗同时采取抗纤维化治疗的必要性。TGF-β2是转化TGF-β中一员,是CTGF的上游信号,对单核细胞和成纤维细胞有趋化作用,促进炎症反应和纤维形成,并可以刺激成纤维细胞分泌纤连蛋白参与细胞外基质的形成,Forooghian等[15]发现糖尿病视网膜病变的患者在玻璃体内注射抗VEGF药物后玻璃体腔中TGF-β2的含量会增加。我们的体外实验研究也证实了Bevacizumab 可以促进RPE细胞分泌TGF-β2,与上述结果相符。
MMP-2与bFGF也是与纤维化密切相关的细胞因子。研究证实PDR患者视网膜前膜中MMP-2大量分布于视网膜纤维血管膜的RPE细胞和神经胶质细胞中,说明MMP-2可能参与了纤维血管膜的形成[16]。MMP-2可以降解明胶、IV型胶原、V型胶原、VⅡ型胶原、纤维连接蛋白和弹性蛋白,使RPE细胞等失去了原有的生存环境,在异常环境中,RPE细胞可以产生新的细胞外基质,进而诱导纤维血管膜的形成。bFGF 可以调节细胞生长与分化,促进细胞分裂使其大量增生并可诱导血管内皮细胞上调CTGF的表达。在增生性玻璃体视网膜病变中bFGF的表达量也明显增加[10]。玻璃体腔注射抗VEGF药物后新生血管膜纤维化是否有 bFGF和 MMP-2的参与尚未见报道。本研究的体外实验结果表明Bevacizumab 使得RPE细胞中bFGF和 MMP-2的 mRNA及蛋白表达均增加,证实了Bevacizumab也有可能通过上调bFGF和 MMP-2的表达参与纤维化的形成。
本研究观察了Bevacizumab对人RPE细胞分泌的纤维化相关因子表达的影响,证明Bevacizumab有促纤维化形成的作用,而这一作用是通过调控一系列细胞因子的表达来实现的。但这些因子之间的具体相互作用以及是否还有其他因子,如炎症因子的参与,都有待进一步深入研究。
1 Group CR,Martin DF,Maguire MG,Ying GS,Grunwald JE,Fine SL,etal.Ranibizumab and bevacizumab for neovascular age-related macular degeneration[J].NEnglJMed,2011,364(20):1897-1908.
2 Hwang JC,Del Priore LV,Freund KB,Chang S,Iranmanesh R.Development of subretinal fibrosis after anti-VEGF treatment in neovascular age-related macular degeneration[J].OphthalmicSurgLasersImaging,2011,42(1):6-11.
3 戎慧丰,颜华.增生型糖尿病视网膜病变纤维化相关因子的研究进展[J].中华实验眼科杂志,2011,29(5):473-476.
4 Martin DF,Maguire MG,Fine SL,Ying GS,Jaffe GJ,Grunwald JE,etal.Ranibizumab and bevacizumab for treatment of neovascular age-related macular degeneration:two-year results[J].Ophthalmology,2012,119(7):1388-1398.
5 Lynch SS,Cheng CM.Bevacizumab for neovascularocular diseases[J].AnnPharmacother,2007,41(4):614-625.
6 Erdurmus M,Fotan Y.Subconjunctival bevacizumab for corneal neovascularization[J].GraefesArchClinExpOphthalmol,2007,245(10):1577-1579.
7 Live ME,Domig D,Wolf-Schnurrbursch U,Wolf S,Sarra GM.Intravitreal bevaeizumab (Avastin)in the treatment of neovascular glaucoma[J].AmJOphthalmol,2006,142(6):1054-1056.
8 Van Geest RJ,Lesnik-Oberstein SY,Tan HS,Mura M,Goldschmeding R,Van Noorden CJ,etal.A shift in the balance of vascular endothelial growth factor and connective tissue growth factor by bevacizumab causes the angiofibrotic switch in proliferative diabetic retinopathy[J].BrJOphthalmol,2012,96(4):587-590.
9 Heier JS.Pathology beyond neovascularization:new targets in age-related macular degeneration[J].Retina,2009,29(6):39-41.
10 Hueber A,Wiedemann P,Esser P,Heimann K.Basic fibroblast growth factor mRNA,bFGF peptide and FGF receptor in epiretinal membranes of intraocular proliferative disorders (PVR and PDR)[J].IntOphthalmol,1996,20(6):345-350.
11 Pattwell DM,Stappler T,Sheridan C,Heimann H,Gibran SK,Wong D,etal.Fibrous membranes in diabetic retinopathy and bevacizumab[J].Retina,2010,30(7):1012-1016.
12 Kubota T,Morita H,Tou N,Nitta N,Tawara A,Satoh H,etal.Histology of fibrovascular membranes of proliferative diabetic retinopathy after intravitreal injection of bevacizumab[J].Retina,2010,30(3):468-472.
13 Kalluri R,Neilson EG.Epithelial-mesenchymal transition and its implications for fibrosis[J].JClinInvest,2003,112(12):1776-1784.
14 Blom IE,Goldschmeding R,Leask A.Gene regulation of connective tissue growth factor:new targets for antifibrotic therapy[J].MatrixBiol,2002,21(6):473-482.
15 Forooghian F,Kertes PJ,Eng KT,Agron E,Chew EY.Alterations in the intraocular cytokine milieu after intravitreal bevacizumab[J].InvestOphthalmolVisSci,2010,51(5):2388-2392.
16 Noda K,Ishida S,Inoue M,Obata KI,Oguchi Y,Okada Y,etal.Production and activation of matrix metalloproteinase-2 in proliferative diabetic retinopathy[J].InvestOphthalmolVisSci,2003,44(5):2163-2170.
date:Nov 25,2013
Science and Technology Project of Qingdao(No:13-1-3-69-nsh)From theSchoolofMedecineandLifeScience,UniversityofJinan,ShandongAcademyofMedicalSciences,ShandongEyeInstitute(ZHANG Min),Jinan250022,ShandongProvince,China;QingdaoEyeHospital,ShandongEyeInstitute(ZHANG Min,CHU San-Jun,ZENG Fan-Xing,XU Hai-Feng)Qingdao266071,ShandongProvince,China
Effects of Bevacizumab on fibrosis associated cytokines expression in human retinal pigment epithelial cells
ZHANG Min,CHU San-Jun,ZENG Fan-Xing,XU Hai-Feng
Bevacizumab; retinal pigment epithelial cells; fibrosis; cytokines
Objective To evaluate the effects of Bevacizumab on expressions of cytokines associated with fibrosis in gene and protein levels in human retinal pigment epithelial cells, and further investigate the possible role of Bevacizumab in the process of new vascular fibrosis. Methods Human retinal pigment epithelial cells were incubated in DMEM/F12 medium containing 0.25 g·L-1Bevacizumab. Cells were divided into 5 groups according to incubation period: 0 hour, 6 hours, 12 hours, 24 hours and 48 hours, 0 hour served as control. The cells and supernatant were collected at different time points. The mRNA and protein levels of connective tissue growth factor (CTGF), basic fibroblast growth factor (bFGF), transforming growth factor-β2 (TGF-β2)and matrix metalloproteinase-2 (MMP-2)were evaluated by RT-PCR and ELISA or Western blotting, respectively.Results The mRNA levels at 6 hours, 12 hours, 24 hours and 48 hours were as following, CTGF: 1.694±0.160, 1.994±0.221, 1.733±0.057, 1.397±0.075; bFGF: 1.720±0.068, 2.144±0.080, 1.893±0.068, 1.372±0.076; TGF-β2: 1.356±0.070, 1.737±0.515, 1.576±0.098, 1.439±0.050; MMP-2: 1.414±0.115, 1.644±0.094, 1.435±0.075, 1.285±0.024. Compared with control group, the mRNA levels were increased at all time points after incubation with Bevacizumab (allP<0.05). ELISA and Western blotting analysis showed that the protein levels of CTGF, bFGF, TGF-β2 and MMP-2 increased after treatment with Bevacizumab and the differences were statistically significant (allP<0.05).The protein concentrations of each group were as following, CTGF: (31.949±0.388)μg·L-1, (48.697±0.863)μg·L-1, (56.847±0.499)μg·L-1,(51.753±1.395)μg·L-1,(43.085±1.240)μg·L-1; bFGF: (26.66±1.36)μg·L-1, (46.529±3.297)μg·L-1,(55.883±1.705)μg·L-1,(47.937±1.303)μg·L-1,(36.894±2.532)μg·L-1; TGF-β2: (26.982±2.404)μg·L-1,(35.452±1.360)μg·L-1, (46.787±0.896)μg·L-1, (43.683±1.630)μg·L-1, (38.008±1.110)μg·L-1. MMP-2 protein levels at 6 hours, 12 hours, 24 hours and 48 hours after incubation with Bevacizumab were all increased, the differences were statistically significant among different groups(F=2620.429,P=0.000).Conclusion Bevacizumab can up-regulate both mRNA and protein expression of CTGF, bFGF, TGF-β2 and MMP-2 in human retinal pigment epithelial cells, which indicates hat Bevacizumab may have pro-fibrotic effects.
张敏,女,1987年4月出生,山东德州人,硕士。研究方向:眼底病。联系电话:18765979700;E-mail:zm4126067@163.com
AboutZHANGMin:Female,born in April,1987.Master degree.Tel:18765979700; E-mail:zm4126067@163.com
2013-11-25
青岛市科技计划项目(编号:13-1-3-69-nsh)
250022 山东省济南市,济南大学,山东省医学科学院医学与生命科学学院,山东省眼科研究所(张敏);266071 山东省青岛市,山东省眼科研究所青岛眼科医院(张敏,储三军,曾繁星,徐海峰)
徐海峰,E-mail:chxhf@126.com
张敏,储三军,曾繁星,徐海峰.Bevacizumab对视网膜色素上皮细胞纤维化相关因子表达的影响[J].眼科新进展,2014,34(4):318-321.
��
10.13389/j.cnki.rao.2014.0086
修回日期:2013-12-13
本文编辑:董建军
Accepteddate:Dec 13,2013
Responsibleauthor:XU Hai-Feng,E-mail:chxhf@126.com
[RecAdvOphthalmol,2014,34(4):318-321]
