MiR-182模拟物提高1型糖尿病小鼠的心脏功能
2014-07-25孟哲颖王玉南淑良林艳端徐卫平胡兵申锷
孟哲颖,王玉,南淑良,林艳端,徐卫平,胡兵,申锷
(上海交通大学附属第六人民医院超声医学科;上海超声医学研究所,上海 200233)
糖尿病心肌病 (diabetic cardiomyopathy,DC)[1]是由高血糖直接作用心肌细胞引起的心肌组织原发性损害,病理表现不具有特异性。在糖尿病心肌病的发生发展过程中,心肌细胞呈现不同程度的心肌细胞凋亡、心肌细胞肥大及心肌组织胶原成分累积导致心肌纤维化,逐渐加重并最终致心力衰竭,如何减轻、阻止、逆转糖尿病心肌病的病理变化及其分子机制是目前研究的热点。MicroRNA(miRNA)是一类内源性、具有22个左右核苷酸大小的非编码RNA分子,在进化中呈现高度保守性,通过碱基匹配原则识别靶基因3'非翻译区(3'UTR)的靶位点,从而抑制编码蛋白靶基因的翻译和(或)降解靶基因[2]。本文拟用 miR-182 模拟物[3](正义链:5'-uuuggcaaugguagaacucacacu-3',反义链:5'-agugugaguucuaccauugccaaa-3')治疗1型糖尿病小鼠,探索miR-182与糖尿病心肌病发生发展的关系,及miR-182模拟物是否影响小鼠心脏功能和可能机制。
1 材料与方法
1.1 糖尿病动物模型建立及实验分组
SPF级C57 BL/6J小鼠40只,雄性,鼠龄5~6周,体重18~20 g,购自上海斯莱克实验动物有限公司【SCXK(沪)2007-0005】,实验于上海交通大学附属第六人民医院动物实验中心进行【SYXK(沪)2011-0128】。随机分为4组:正常对照组(normal control,n=5),miR-182 模拟物对照组(mir-182 control,n=5),1型糖尿病组 (DM,n=15),1型糖尿病+miR-182模拟物治疗组(DM+miR-182,n=15)。鼠龄8周时通过腹腔注射链脲佐菌素(STZ)建立1型糖尿病动物模型,注射剂量为150 mg/kg,一次性注射,当天即让小鼠自由进食饮水。注射STZ后48 h经鼠尾静脉釆血,血糖大于16.7 mmol/L定为糖尿病诊断标准,血糖升高后DM+miR-182组小鼠每3 d经尾静脉注射中性脂肪乳剂和miR-182模拟物合成的载药系统,剂量为1 mg/kg,连续给药8周至实验结束[3]。miR-182对照组只注射中性脂肪乳剂,给药剂量及时间同DM+miR-182组。
1.2 主要试剂及仪器
Streptozotocin(STZ,Sigma公司,美国),Onetouch II血糖仪(强生公司,美国);透射电镜(l200Ex,日本);小动物用高分辨超声仪(Vevo 2100,VisualSonics公司,加拿大);中性脂肪乳剂和miR-182模拟物合成的寡核苷酸载药系统及Trizol试剂(Sigma公司,美国)。
1.3 超声心动图测量心脏功能
实验达终点时,通过小动物用高分辨超声仪检测小鼠心脏功能:按照高分辨小动物超声成像系统的操作说明,麻醉采用1.5%戊巴比妥钠按0.1 mL/20 g腹腔注射,然后将其置于37℃的恒温垫上,用4个电极连接小鼠四肢末端并固定。获取胸骨旁长轴切面M型超声图像,测定左心室舒张末期内径LVIDd,左室收缩末期内径LVIDs,每组原始数据取连续3个心动周期的平均值,软件自动测算出左室射血分数(ejection fraction,EF),左室短轴缩短率(fractional shortening,Fs)。
1.4 透射电镜检测
小鼠心脏剪去心房、右室及大血管组织,取左室心肌组织,切成大小约为1 mm3组织块,放入3%戊二醛固定液固定2 h,l% 锇酸固定2 h,逐级酒精、丙酮脱水后,环氧树脂包埋,超薄切片,经铀、铅双重染色后,透射电镜观察心肌超微结构的变化。余心脏组织迅速冻于液氮中并转存在-80℃冰箱,后续试验待用。
1.5 Real-time RT-PCR检测
用Trizol试剂抽提总RNA,进行浓度和纯度检测,取2 μg总RNA按照M-MLV逆转录酶进行反转录(RT),合成 cDNA,加入 SYBR Premix ExTaq,行PCR循环。检测目的基因β-肌球蛋白重链(β-myosin heavy chain,β-MHC)、α-肌球蛋白 重链 (α-MHC),心房钠尿肽(ANP),I型(Col I)和III型胶原(Col III)。甘油醛-3-磷酸脱氢酶(glyceraldehyde-3·phosphate dehydrogenase,GAPDH)作为内参照,检测miR-182 mRNA,U6为内参,具体引物序列见表1。总反应体积20 μL,扩增条件:94℃预变性5 min,94℃ 60 s,62℃ 40 s,72℃ 60 s,最后延伸10 min,目的基因扩增32个循环,内参扩增27个循环。以目的基因 β-MHC、α-MHC、ANP、Col I、Col III与 GAPDH比率进行定量分析。
1.6 统计学处理
采用SPSS 16.0统计软件包完成,计量资料以均数±标准差表示,组间比较采用单因素方差分析(One-way ANOVA),两两比较采用 q检验。P<0.05及P<0.01为差异有显著性。

表1 β-MHC,α-MHC,ANP,Col I,Col III,miR-182及 U6,GAPDH 的 PCR 扩增引物序列Tab.1 Primer sequences of β-MHC,α-MHC,ANP,Col I,Col III,miR-182,U6 and GAPDH
2 结果
2.1 糖尿病小鼠心脏功能变化
与正常对照组比较,DM组小鼠心脏功能参数EF和Fs明显降低(P<0.01);而DM+miR-182组较DM组EF和FS明显升高(P<0.01);但miR-182对照组与正常对照组差异无显著性(P>0.05),见图1、表2。各组小鼠体重及血糖变化,见表3。
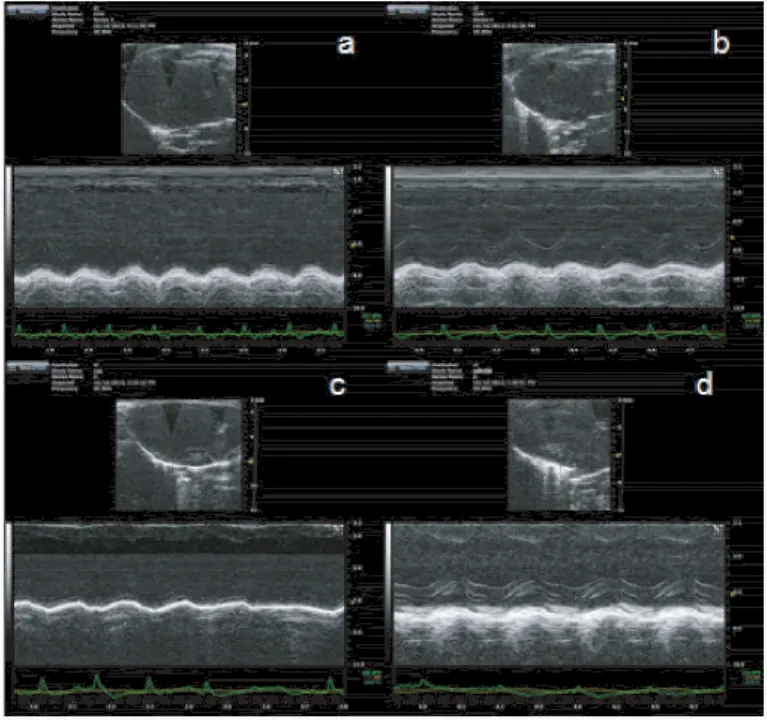
图1 小鼠心脏超声表现Fig.1 Echocardiography performance of the mice
表2 小鼠心脏功能变化(±s,%)Tab.2 Cardiac function of the mice in each group
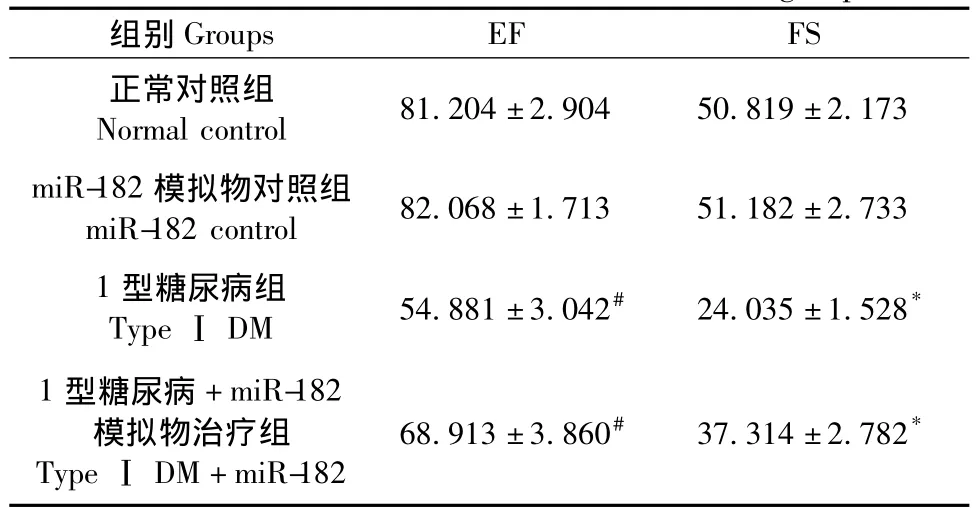
表2 小鼠心脏功能变化(±s,%)Tab.2 Cardiac function of the mice in each group
注:#P<0.01 vs正常对照组;*P<0.01 vs1型糖尿病组。Note:#P<0.01 vs.normal control group;*P<0.01 vs.DM group.
组别Groups EF FS正常对照组Normal control 81.204±2.904 50.819±2.173 miR-182模拟物对照组miR-182 control 82.068±1.713 51.182±2.733 1型糖尿病组TypeⅠDM 54.881±3.042# 24.035±1.528*1型糖尿病+miR-182模拟物治疗组TypeⅠDM+miR-182 68.913±3.860# 37.314±2.782*
2.2 小鼠心肌组织miR-182 mRNA的表达
与正常对照组比较,DM组心肌组织内miR-182 mRNA表达水平降低(P<0.01)见图2;小鼠心肌组织的β/α-MHC比值及 ANP,Col I,Col III表达变化,与正常对照组比较,DM组心肌组织内 β/α-MHC比值及ANP、Col I、Col III表达水平均明显升高(P<0.01);DM+miR-182组较DM组显著降低(P<0.01);但miR-182组与正常对照组差异无显著性(P>0.05),见图3。
2.3 小鼠心肌超微结构改变
电镜结果显示miR-182对照组与正常对照组呈现心肌纤维丰富呈纵向平行紧密排列,Z线和M线清晰,线粒体呈圆形或椭圆形,基质浓密、嵴完整且丰富,延长轴有序排列在肌丝束之间;DM组呈现心肌纤维排列紊乱,心肌间质纤维增生;心肌细胞间出现较多脂滴,线粒体排列聚集紊乱,形态异常,线粒体明显肿胀,嵴溶解或消失,心肌细胞间出现自噬体(见图4-e,箭头所示);DM+miR-182组呈现线粒体改变有所改善,体现在线粒体嵴溶解断裂较少,嵴稍肿胀,未见明显自噬体,见图4。
表3 各组小鼠体重及血糖变化(±s)Tab.3 Changes of body weight and blood glucose of the mice in each group
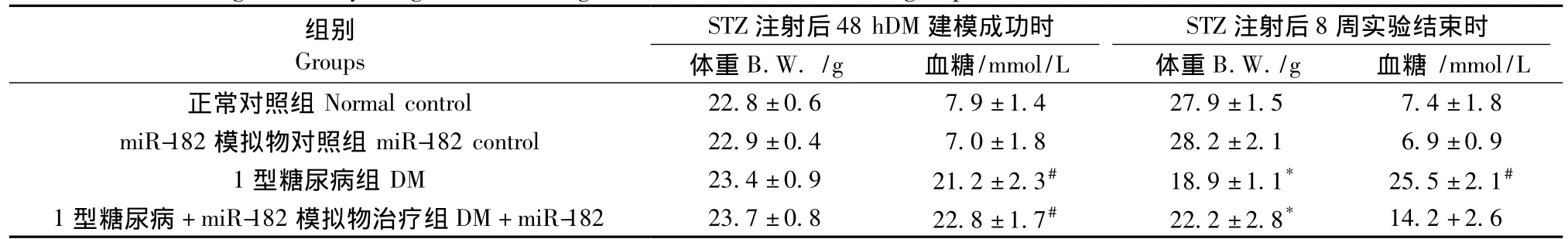
表3 各组小鼠体重及血糖变化(±s)Tab.3 Changes of body weight and blood glucose of the mice in each group
注:#P<0.01 vs.正常对照组血糖值;*P<0.01 vs.STZ注射8周后正常对照组体重。Note:#P<0.01 vs.blood glucose of normal control group;*P<0.01 vs.body weight of the normal control group at 8 weeks after STZ injection.
组别STZ注射后48 hDM 建模成功时 STZ注射后8周实验结束时体重B.W./g 血糖/mmol/L 体重B.W./g 血糖/mmol/L正常对照组 Normal control 22.8±0.6 7.9±1.4 27.9±1.5 7.4±1.8 miR-182模拟物对照组 miR-182 control 22.9±0.4 7.0±1.8 28.2±2.1 6.9±0.9 1型糖尿病组DM 23.4±0.9 21.2±2.3# 18.9±1.1* 25.5±2.1#1型糖尿病+miR-182模拟物治疗组DM+miR-182 23.7±0.8 22.8±1.7# 22.2±2.8*Groups 14.2+2.6
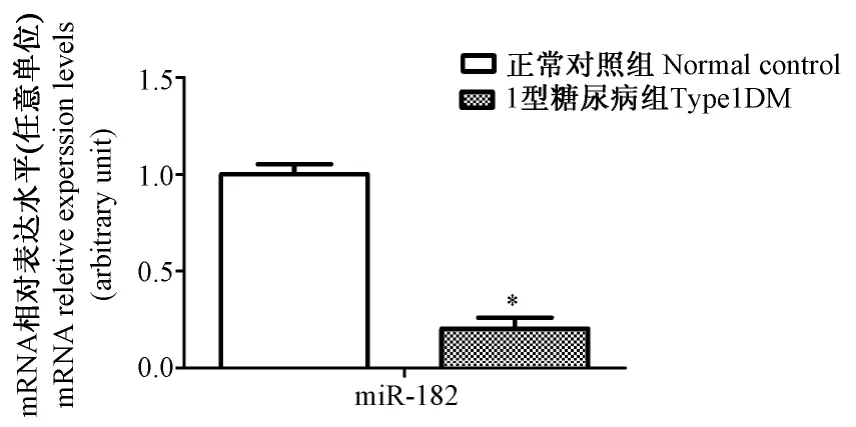
图2 小鼠心肌组织miR-182 mRNA表达变化Fig.2 Changes of miR-182 in the cardiac tissues of mice in normal control group and DM group
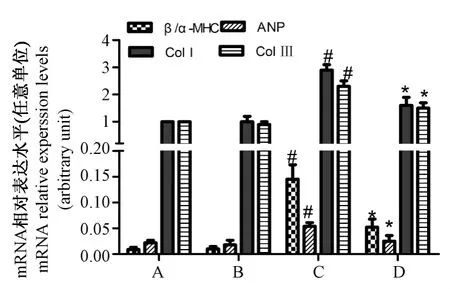
图3 小鼠心肌组织β/α-MHC比值及 ANP,Col I,Col III表达变化Note:#P<0.01 vs.normal control group;*P<0.01 vs.DM group;A:Normal control group;B:miR-182 control group;C:DM group;D:DM+miR-182 groupFig.3 Changes of β/α-MHC ratio,ANP,Col I,Col III in the myocardial tissues of mice in each group
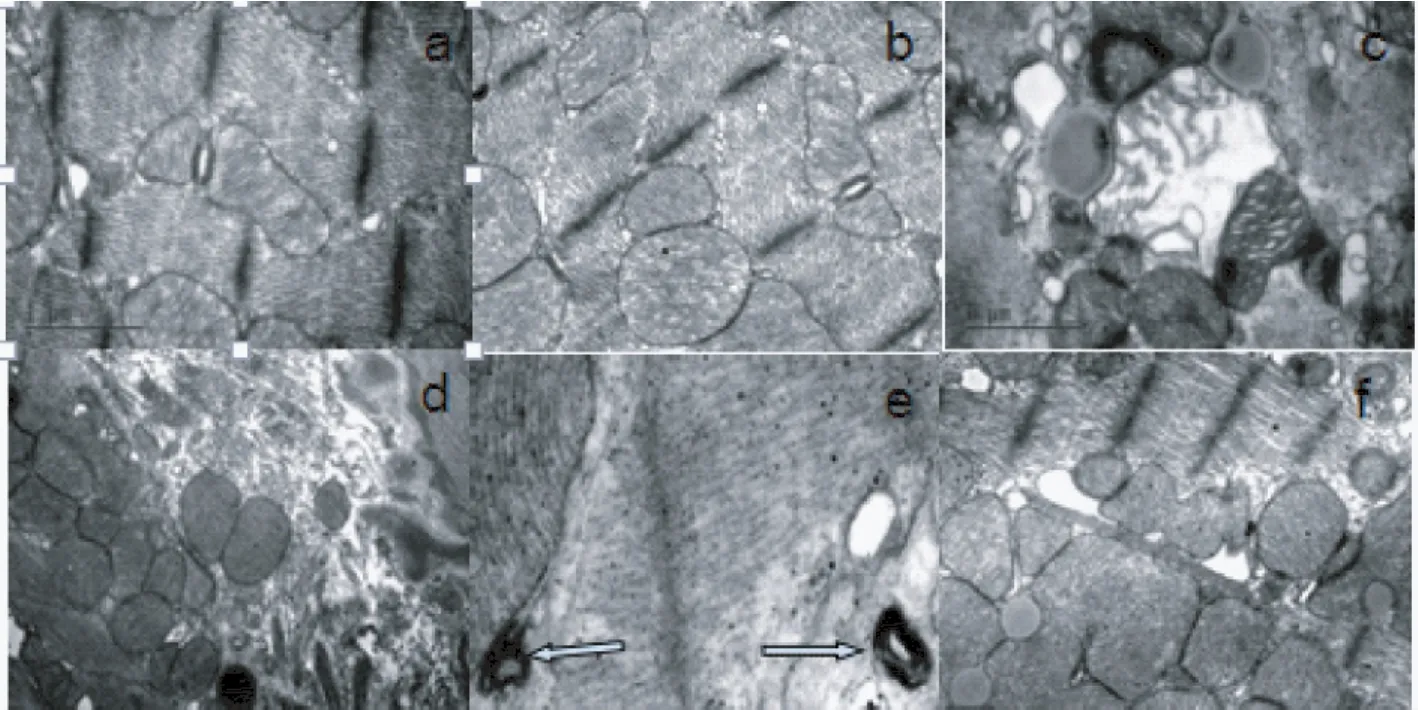
图4 小鼠心肌超微结构变化,各组小鼠心肌组织线粒体及自噬改变Fig.4 Ultrastructural changes in the myocardial tissues of mice
3 讨论
MiRNAs在人类基因中约占3%,却控制着近30%的基因表达,既参与调节组织、器官的形成以及增殖、代谢、造血等细胞生理过程,也在各种疾病的发生和发展过程中发挥重要作用[2,5]。miRNA可以通过调节转录水平影响蛋白的产生从而参与心肌肥大的形成,近来研究表明,miRNAs,如miR-26b、miR-150、miR-27a及 miR-143与心肌肥大的病理生理有密切联系[6]。同时在糖尿病小鼠心肌组织已发现差异表达的 miRNAs[7],提示 miRNA参与 DC的发生发展。
在前期实验中发现2型糖尿病小鼠心肌组织中有miRNAs表达下调,其中mir-182的表达水平减低最具有统计学意义(数据待发表),那么mir-182在1型糖尿病小鼠心肌组织中是否也呈下调表达?调控miR-182是否影响小鼠心脏功能。本实验以1型糖尿病小鼠为动物模型,首先测量糖尿病小鼠的心脏功能,因小鼠心率可高达约600~700次/分钟,即使小鼠进行麻醉后,心率仍可达到300次/分钟(麻药对心脏功能改变没有明显影响),在此情况下医用心超仪器难以对小鼠心脏功能进行准确测量。本实验采用小动物专用高分辨超声仪对小鼠左心室EF、FS进行测量,可以有效检测小鼠整体心脏收缩功能变化[2,9],心脏超声参数 EF、Fs 是反映心脏收缩功能的金指标,结果显示DM组小鼠心脏EF与Fs明显降低,1型糖尿病小鼠给予miR-182模拟物后心脏EF与Fs均有不同程度增高,提示miR-182模拟物可以改善糖尿病心肌病造成的心脏功能损害。
心肌肥大、心肌纤维化是心功能减低的重要原因。ANP和β/α-MHC比值是反映心肌肥大的代表性指标[8]。本实验中DM组心肌组织中ANP表达明显增加、β/αMHC比值明显升高,而 DM+miR-182组心肌ANP表达水平和β/α-MHC比值显著降低,表明miR-182模拟物发挥心脏保护作用与减轻心肌肥大相关。心肌间质纤维化可能是糖尿病心肌病变的特征性表现,其中成纤维细胞和细胞外基质的作用和糖尿病心肌病心室重构的关系备受关注[9,10]。本实验发现DM组心肌间质大量胶原纤维积累,同时DM组心肌组织内Col I及Col III胶原显著增加,而DM+miR-182组明显降低,提示miR-182参与DC发病,其模拟物可以降低心肌组织中胶原的含量,减轻糖尿病心肌病造成的心脏结构损害,提示miR-182模拟物改善糖尿病小鼠心功能与其减轻心肌肥大,心肌纤维化有关。
自噬(autophagy)[11是机体处于物质与能量代谢障碍时由细胞初级溶酶体处理内容性底物的重要生理过程,是机体主要的防御机制之一,以胞质中出现大量包裹胞质、细胞器的具有双层膜结构的自噬体为主要特征。糖尿病心肌能量障碍会诱导自噬,但是糖尿病心肌病变时如何诱导心肌细胞产生自噬以及自噬在细胞存活与死亡中的作用尚存在争议。有学者[12]认为糖尿病小鼠腺苷酸活化蛋白激酶AMPK活性降低,自噬减少是导致糖尿病心肌病的原因之一;然而相反的观点[13]认为高糖导致胰岛素抵抗所致超氧化物过多,上调自噬,可能会诱导糖尿病心肌病。高糖诱导的心肌细胞死亡与ROS产生增多、促进内质网应激、激活自噬有关[14]。在本实验中我们观察到DM组小鼠心肌中自噬体较正常对照组明显增多,而给予mir-182模拟物治疗后自噬小体明显减少。最近的文献表明[15]miR-34可通过抑制ATG9A的表达,抑制心肌自噬参与调节心肌细胞肥大,提示心肌自噬对于心肌肥大的影响,因此miR-182模拟物减轻心肌自噬的分子机制值得进一步研究。
实验显示miR-182模拟物可以提高1型糖尿病小鼠心脏EF、Fs从而改善心脏功能,主要是通过减低心肌细胞肥大相关基因、致心肌纤维化胶原基因的表达,减低细胞线粒体改变、减少心肌组织自噬小体数量而实现,因而上调miR-182有望成为改善糖尿病心脏功能以及防治糖尿病心肌病的治疗靶点。
[1]Rubler S,Dlugash J,Yuceoglu YZ,et al.New type of cardiomyopathy associated with diabetic glomerulosclerosis[J].Am J Cardiol,1972,6(30):595-602.
[2]Filipowicz W,Bhattacharyya SN,Sonenberg N.Mechanisms of post-transcriptional regulation by microRNAs:are the answers in sight?[J].Nat Rev Genet,2008,9(2):102-114.
[3]Small EM,,Olson EN.Pervasive roles of microRNAs in cardiovascular biology[J].Nature,2011,469(7330):336-342.
[4]Trang P,Wiggins JF,Daige CL,et al.Systemic delivery of tumor suppressor microRNA mimics using a neutral lipid emulsion inhibits lung tumors in mice[J].Mol Ther,2011,19(6):1116-1122.
[5]Lee RC,Feinbaum RL,Ambros V.The C.elegans heterochronic gene lin-4 encodes small RNAs with antisense complementarity to lin-14 [J].Cell,1993,75(5):843-854.
[6]Martinelli NC,Cohen CR,Santos KG,et al.An analysis of the global expression of microRNAs in an experimental model of physiological left ventricular hypertrophy [J].PLoS ONE,2014,9(4):e93271.
[7]刁雪红,申锷,胡兵,等.糖尿病小鼠心肌组织microRNA表达谱分析[J].上海交通大学学报(医学版),2010,30(10):1194-1198.
[8]Patrizio M,Musumeci M,Stati T,et al.Propranolol causes a paradoxical enhancement of cardiomyocyte foetal gene response to hypertrophic stimuli[J].Br J Pharmacol,2007,152(2):216-222.
[9]Asbun J,Villarreal FJ.The pathogenesis of myocardial fibrosis in the setting of diabetic cardiomyopathy [J].J Am Coll Cardiol,2006,47(4):693-700.
[10]Yang B,Li M,Shi ZG,et al.Bosentan ameliorates the expression of fibrotic related growth factors and collagen-1 in diabetic mice[J].Anadolu Kardiyol Derg,2012,12(8):621-627.
[11]Zhu H,Tannous P,Johnstone JL,et al.Cardiac autophagy is a maladaptive response to hemodynamic stress[J].J Clin Invest,2007,117(7):1782-1793.
[12]Xie Z,Lau K,Eby B,et al.Improvement of cardiac functions by chronic metformin treatment is associated with enhanced cardiac autophagy in diabetic OVE26 mice[J].Diabetes,2011,60(6):1770-1778.
[13]Mellor KM,Bell JR,Young MJ,et al.Myocardial autophagy activation and suppressed survival signaling is associated with insulin resistance in fructose-fed mice[J].J Mol Cell Cardiol,2011,50(6):1035-1043.
[14]Younce CW,Wang K,Kolattukudy PE.Hyperglycaemia-induced cardiomyocyte death is mediated via MCP-1 production and induction of a novel zinc-finger protein MCPIP [J].Cardiovasc Res,2010,87(4):665-674.
[15]Huang J,Sun W,Huang H,et al.miR-34a modulates angiotensin II-induced myocardial hypertrophy by direct inhibition of ATG9A expression and autophagic activity [J].PLoS One,2014,9(4):e94382.
