钙蛋白酶抑制蛋白转基因小鼠的构建和鉴定
2014-02-07叶廷巧马双陶李丹郑曦王强苏立男张彦杨芸杨永健
叶廷巧,马双陶,李丹,郑曦,王强,苏立男,张彦,杨芸,杨永健
(成都军区总医院心血管内科,成都 610083)
钙蛋白酶抑制蛋白(calpastatin,CAST)是一种内源性钙蛋白酶(calpain)抑制剂,广泛存在于哺乳动物细胞内,分子量大小约130 ×103,与钙蛋白酶共同组成钙蛋白酶系统,二者相互协调。CAST 抑制钙蛋白酶的催化活性,以保证钙蛋白酶只对底物局部的特定位点进行水解,防止细胞发生自溶[1]。在各种心血管疾病发生过程中,钙蛋白酶系统被认为发挥着重要作用。此外,钙蛋白酶系统还参与信号转导,细胞增殖、分化、凋亡和膜融合等生理过程。国外有报道通过注射外源性钙蛋白酶抑制剂可以抑制小鼠心肌梗死后心肌重构的发生[2]。但是,内源性CAST 的作用国内外报道甚少。因此,本研究拟构建CAST 过表达的转基因小鼠,这将为钙蛋白酶系统的研究提供有用的工具。
1 材料与方法
1.1 材料
1.1.1 实验动物
SPF 级C57BL/6J 小鼠,购自成都达硕实验动物有限公司【SCXK(川)2013-24】,共300 只,8 ~10 周龄,体重22 ~25 g,雌雄各半。
1.1.2 试剂
Gateway® BP ClonaseTMII Enzyme Mix(invitrogen 公司),Gateway® LR ClonaseTMII Plus Enzyme Mix(Invitrogen 公司),QIAquick Gel Extraction Kit(Qiagen 公司),质粒小提试剂盒(Tiangen 公司),Taq DNA polymerase(美国Fermentas 公司),dNTP Mix(美国Fermentas 公司),PrimeSTARTMHS DNA Polymerase(Takara 公司),GeneRulerTM1kb DNA ladder(Fermentas 公 司),LA Taq (Takara 公 司),PMD18-T Simple Vector(Takara 公司),引物(Sangon Biotech 公司),鼠尾基因组DNA 提取试剂盒(成都福际生物技术有限公司),Premix Taq(Takara 公司),RT-PCR 试剂盒(Takara 公司),calpastatin 羊抗鼠的一抗(sc-7561,Santa 公司)。
1.2 方法
1.2.1 载体pRP. EX3d-EF1A-CAST-IRES-eGFP 的构建及线性化DNA 片段的制备
含有attB 重组位点的目的片段与含有attP 重组位点的供体载体之间通过BP 反应获得含有“attL1-目的基因-attL2”的入门载体;含有“attL1-目的基因-attL2”的入门载体再与含有attR 重组位点的目的载体之间通过LR 反应获得“attB1-目的基因-attB2”的表达载体(图1)。
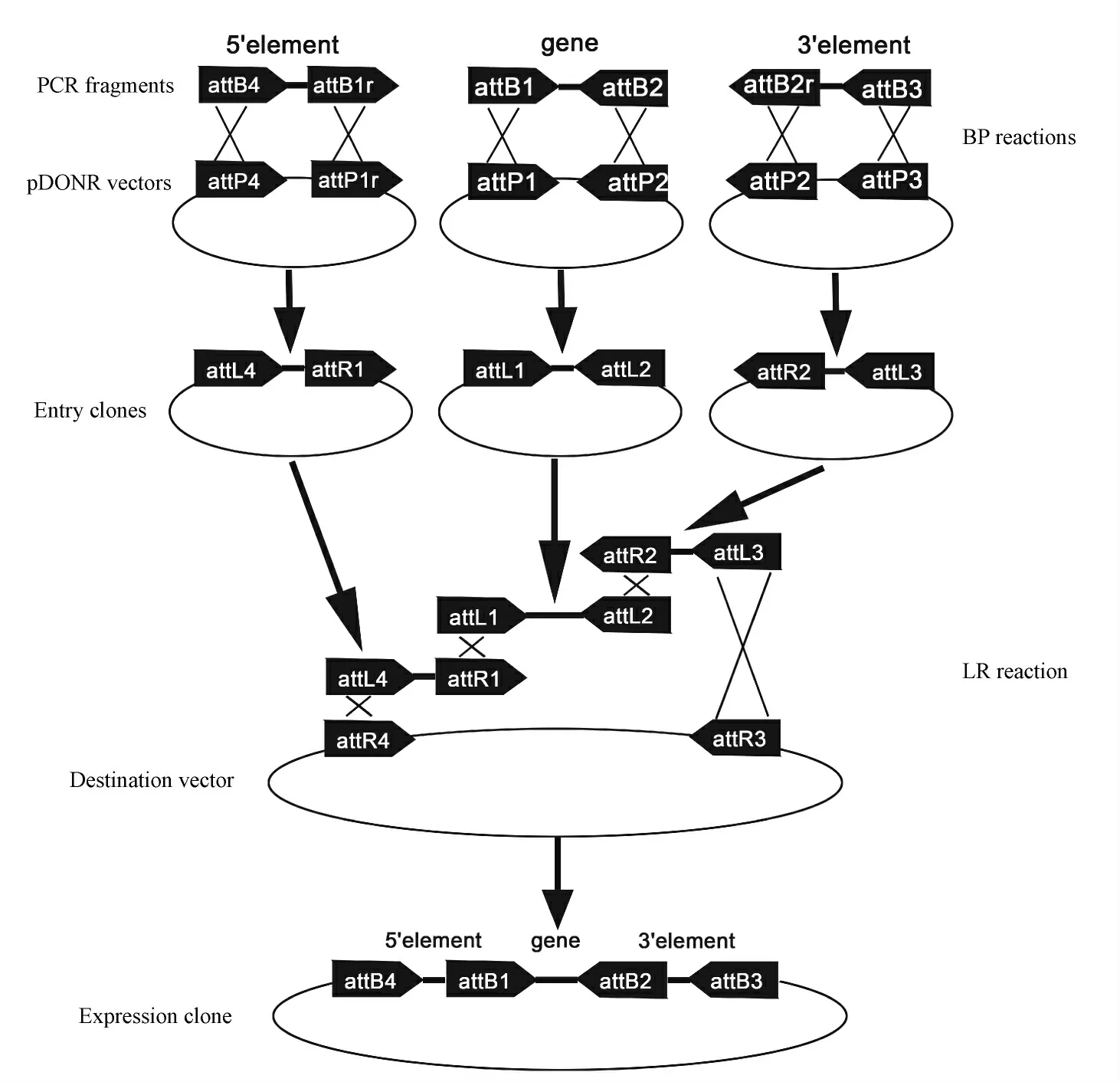
图1 载体构建模式图Fig.1 Pattern diagram of the construction of recombinant vectors
针对CAST 基因的CDS 序列设计相应的引物(引 物 attB1-Kozak-CAST-F:5′-GGGGACAAGTTTG TACAAAAAAGCAGGCTGCCACCATGTCCCAGCCCG GCCAGA-3′;引 物 attB2-CAST-R:5′-GGGGACCA CTTTGTACAAGAAAGCTGGGTTTAGTCATCTTTTGG CTTGGAAGTTTCC-3′),以正常人基因组DNA 为模板,由重叠PCR 扩增、合成含有attB1-Kozak-CAST -attB2 目的基因的片段。利用Gateway clone 技术,经BP 反应将CAST 基因插入到载体pDown 上,合成pDown-CAST 目的基因的入门克隆;再 与pUp-EF1A,pDown-CAST,pTail-IRES-eGFP 和PRP.Des3d经过LR 反应形成pRP.Ex3d-EF1A-CAST-IRES-eGFP 表达载体。产物进行1.2%琼脂糖凝胶电泳,用QIAquick Gel Extraction Kit 试剂盒纯化、回收目的片段,并溶于显微注射缓冲液(microinjection buffer,pH 7.4)中,至终浓度为3 ng/ μL。
1.2.2 显微注射及子代小鼠F0的产生
将纯化后的线性pRP. EX3d-EF1A-CAST-IRESeGFP 片段通过显微注射法注入C57BL/6J 小鼠的受精卵雄原核中,挑选注射后状态良好的受精卵,移植到假孕母鼠的输卵管内,待F0代小鼠出生[3]。所有实验用小鼠均在SPF 级动物房中饲养和繁殖,温度控制在21℃,相对湿度55%,自动光控(12 h 明/12 h 暗)。
1.2.3 转基因小鼠的基因型鉴定
小鼠在出生14 d 后用剪趾法标记,并剪取0.5~1 cm 尾巴,采用鼠尾基因组DNA 提取试剂盒提取小鼠DNA,利用特异性的引物进行PCR 扩增,筛选出目的片段阳性的小鼠[4]。针对插入目的基因片段的上游引物为:5′-ACGTAAACGGCCACAAGTTC-3′,下游引物为:5′-GATCTTGAAGTTCACCTTGATGC-3′,产物的长度:440 bp。在50 μL PCR 体系中分别加入:Premix Taq 25 μL,引物各1 μL,模板DNA 8 μL,灭菌蒸馏水15 μL。反应条件:94℃变性5 min,进人循环(94℃变性30 s,55℃退火30 s,72℃延伸27 s),共30 个循环,最后一个循环在72℃延伸10 min,4℃保存。取5μL PCR 产物进行1.2%的琼脂糖凝胶电泳,经凝胶图像分析系统观察结果。pRP.EX3d-EF1A-CAST-IRES-eGFP 作为阳性对照,野生型C57BL/6J 小鼠鼠尾DNA 作为阴性对照,并设立空白对照。
1.2.4 转基因小鼠繁殖
首建鼠分别与野生型的C57BL/6J 交配,所产的子代通过PCR 法鉴定筛选出阳性小鼠,分别建系。种鼠与C57BL/6J 回交2 代以上(最好7 代),使遗传背景趋于稳定,同窝的阳性小鼠相互交配建立稳定的转基因小鼠系。
1.2.5 转基因小鼠组织中CSAT mRNA 表达的检测
选取转基因阳性小鼠的心脏、肝脏、脾脏、肺脏、肾脏、脑和骨骼肌组织,采用Trizol 试剂提取组织总RNA。对提取的RNA 在反转录前进行DNaseI 处理,并用酚、氯仿抽提以去除残留的基因组DNA。采用RT-PCR 试剂盒进行反转录得到cDNA 及PCR扩增,经1.2%琼脂糖凝胶电泳分析结果[5]。
1.2.6 转基因小鼠心脏组织中CAST 蛋白表达水平的检测
采用免疫印迹法(Western blotting)检测小鼠心脏中CAST 蛋白的表达。按照蛋白提取试剂盒提取转基因阳性小鼠和同窝阴性小鼠的心脏总蛋白,经SDS-PAGE 凝胶电泳后转移至PVDF 膜上,以CAST抗体为一抗,4℃孵育过夜,加入二抗后在37℃摇床中孵育1 h,将化学发光剂滴至PCDF 膜上,暗室曝光。用UVP 成像系统对结果进行半定量分析,以GAPDH 作为内参。
1.2.7 统计分析
2 结果
2.1 载体pRP.EX3d-EF1A-CAST-IRES-eGFP 的构建及鉴定
重叠PCR 融合attB1-Kozak-CAST -attB2 片段理论大小为2317 bp,切胶回收电泳图条带与理论大小相符(图2)。结果表明:PCR 扩增attB1-Kozak-CAST -attB2 基因片段成功。载体pRP.EX3d-EF1ACAST-IRES-eGFP 经PCR 鉴定理论大小为440 bp,电泳图中与理论大小相符的克隆即为阳性克隆(图3)。结果表明:通过Gateway 技术成功构建载体pRP.EX3d-EF1A-CAST-IRES-eGFP。
2.2 首建鼠的产生及基因型鉴定
共获得存活的90 枚注射卵,分别移植到3 只假孕母鼠的输卵管中,其中3 只母鼠均怀孕,移植成功率100%,产下23 只小鼠,经PCR 鉴定,其中2 只小鼠为阳性,阳性率9%。阳性小鼠再次通过剪鼠尾提取基因组DNA,进行PCR 检测,确认2 只为转基因均为阳性小鼠(图4)。
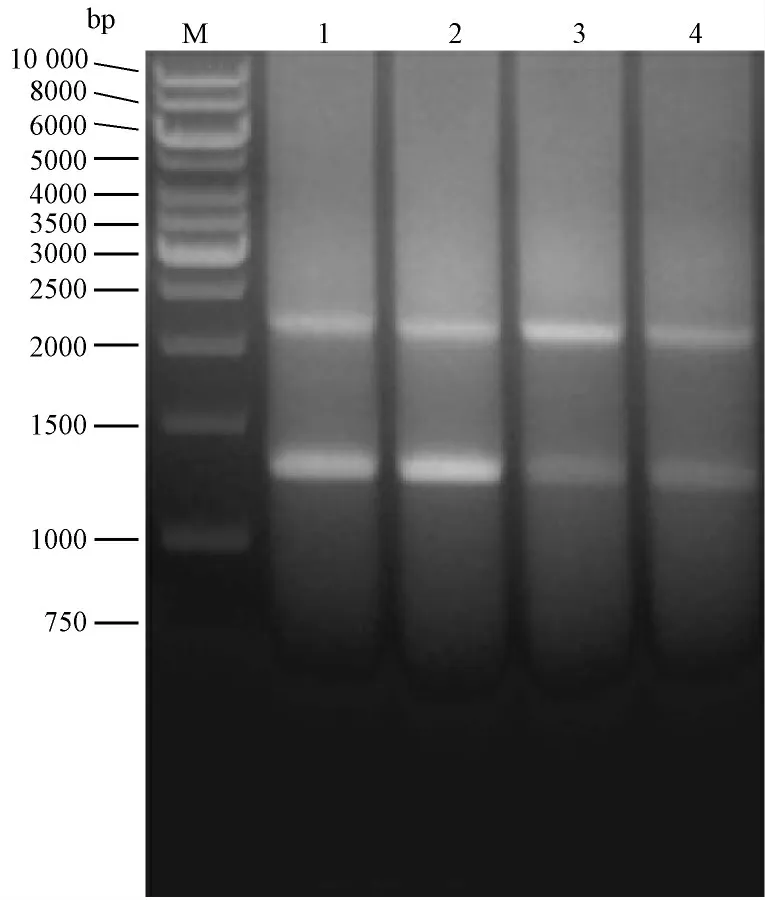
图2 重叠PCR 融合目的片段attB1-Kozak-CAST -attB2 切胶回收结果Fig.2 PCR showing the recombinant fragments:attB1-Kozak-CAST-attB2
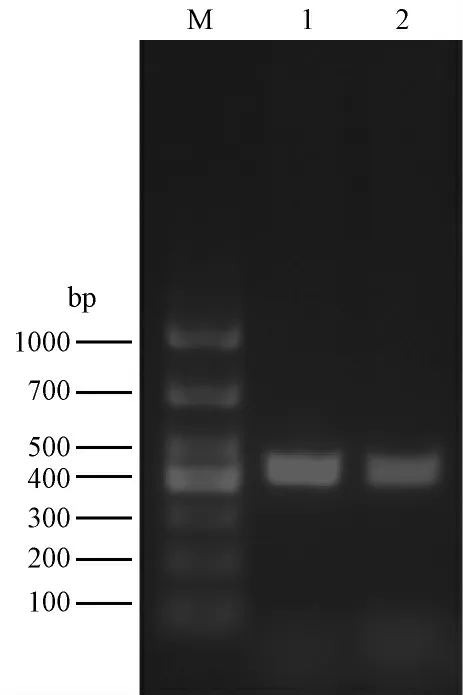
图3 载体pRP.EX3d-EF1A-CAST-IRES-eGFP 的构建结果Fig.3 Enzyme digestion showing the recombinant vector pRP.EX3d-EF1A-CAST-IRES-eGFP
2.3 转基因小鼠繁殖
2 只性成熟的首建鼠分别与C57BL/6J 小鼠回交,分别繁殖及建立相应的转基因小鼠品系,建系情况如表1 所示。
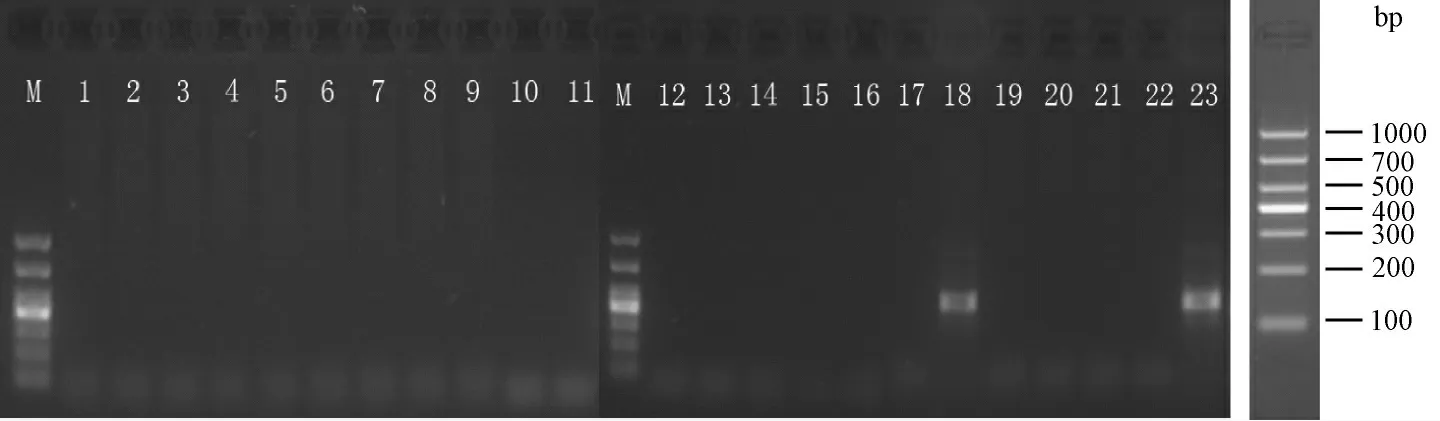
图4 CSAT 转基因小鼠基因型鉴定结果Fig.4 Genotyping the CAST transgenic mice with PCR

表1 CAST 转基因小鼠谱系的建立Tab.1 Construction of CAST transgenic mice lines
2.4 转基因小鼠组织中CAST mRNA 的水平
经RT-PCR 结果显示:CAST mRNA 在转基因阳性小鼠的心脏、肝脏、脾脏、肺脏、肾脏、脑和骨骼肌组织中均有表达(图5)。
2.5 转基因小鼠心脏组织中CAST 蛋白的表达
Western blotting 结果显示:转基因阳性小鼠中CAST 蛋白表达水平明显高于同窝阴性小鼠(图6)。
3 讨论
本研究通过Gateway 技术成功构建载体pRP.EX3d-EF1A-CAST-IRES-eGFP,与传统的克隆技术相比,该方法仅需两步(入门克隆和表达克隆)便能达到目的,大大地简化了基因克隆和亚克隆的步骤,能够快速、高效地将异源DNA 片段克隆到不同的载体中[6]。利用经典的显微注射法将线性化的pRP.EX3d-EF1A-CAST-IRES-eGFP 片段导入C57BL/6J 小鼠的受精卵中,并移植到假孕母鼠的输卵管内,成功建立了2 只转基因小鼠,且利用双盲法对2 只转基因小鼠再次通过剪鼠尾提取基因组DNA,进行PCR 检测,确保2 只为阳性转基因小鼠。在转基因动物构建过程中,外源性蛋白是否表达以及表达的蛋白是否具有生物学活性是技术的关键。我们进一步通过RTPCR 检测到CAST 基因在转基因阳性小鼠的心脏、肝脏、脾脏、肺脏、肾脏、脑和骨骼肌组织中均有表达,且免疫印迹结果显示转基因小鼠较同窝野生型小鼠的心脏组织中CAST 蛋白表达水平显著增加。综上所述,通过Gateway 技术、显微注射的方法能成功构建CAST 转基因小鼠,且能够稳定传代,即CAST 转基因小鼠在转录和蛋白表达水平构建成功。
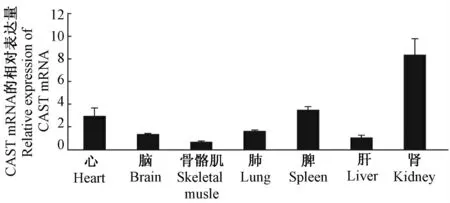
图5 转基因阳性小鼠各组织中CAST mRNA 表达情况Fig.5 Expression of CAST mRNA in organ tissues from the transgenic mice
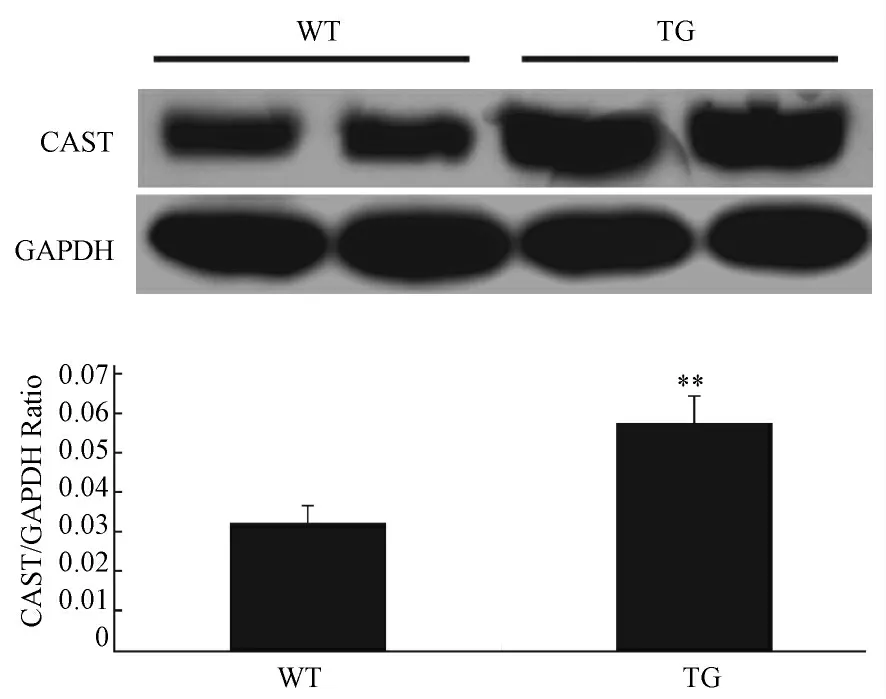
图6 Western blotting 检测转基因小鼠及同窝阴性小鼠心脏中CAST 蛋白的表达Fig.6 Expression of CAST protein in the heart of the transgenic mice and wild type littermates by Western blotting analysis
CAST 最早是在肌肉中分离、纯化m-calpain 时发现的,并于1979年由Takashi Murachi 命名[7],作为钙蛋白酶的抑制蛋白,对calpain 的活性调控具有重要意义,且小鼠和人的基因具有高度同源性。研究发现钙蛋白酶系统中calpain 小部分活化后通过作用于不同的底物在细胞内发挥重要的生理作用,例如:细胞骨架的重构、细胞周期性的凋亡、细胞信号的传导[8]。当细胞内Ca2+浓度增加,calpain 过度活化产生一系列的病理变化,例如:在心肌梗死后的心肌重构过程中,calpain 过度活化会水解心肌细胞骨架、改变心肌纤维蛋白的组成、促进心肌细胞凋亡、降低肌浆网的钙调节能力[9]。Yang 等人在对瓣膜病所致的不同程度心力衰竭病人研究中发现,随着心功能的恶化,calpain 的表达不断升高[10],类似的在肝硬化、帕金森病、缺血性脑损伤、糖尿病、癌症等许多疾病中发现calpain 的活性均异常增高[11]。而CAST 作为calpain的抑制蛋白,提示我们,临床上治疗这些疾病时时,通过CAST 阻断或抑制calpain 的活性可能是一个新的治疗突破口。本研究成功构建过表达的CAST 转基因小鼠,为进一步探讨钙蛋白酶系统在各种疾病中作用及机制提供了有用的工具。
[1]Momeni HR. Role of calpain in apoptosis[J]. Cell J. 2011,13(2):65 -72.
[2]Mani SK,Balasubramanian S,Zavadzkas JA,et al. Calpain inhibition preserves myocardial structure and function following myocardial infarction[J]. Am J Physiol Heart Circ Physiol. 2009,297(5):H1744 -751.
[3]马双陶,曹廷兵,马丽群,等. 瞬时受体电位通道家族M8 型受体转基因小鼠模型的建立[J]. 中国医科大学学报. 2010,39(04):251 -254.
[4]郑志红,高峰,杨葳,等. Dicer1 转基因小鼠模型的建立[J]. 中国实验动物学报. 2008,16(04):258 -260.
[5]史君,王静,王星,等. 肿瘤坏死因子-α、白细胞介素-6在高血压心肌肥厚大鼠实验中的意义[J]. 中国医药导报.2012,(06):23 -25.
[6]Liang X,Peng L,Baek CH,et al. Single step BP/LR combined Gateway reactions[J]. Biotechniques. 2013,55(5):265 -268.
[7]Taylor RG,Geesink GH,Thompson VF,et al. Is Z-disk degradation responsible for postmortem tenderization?[J]. J Anim Sci. 1995,73(5):1351 -1367.
[8]Goll DE,Thompson VF,Li H,et al. The calpain system[J].Physiol Rev. 2003,83:731 -801.
[9]Letavernier E,Zafrani L,Perez J,et al. The role of calpains in myocardial remodelling and heart failure[J]. Cardiovasc Res.2012,96(1):38 -45.
[10]杨永健,周兴文,张鑫,等. 血管紧张素II 受体和钙蛋白酶在心肌重构中的作用[J]. 中国应用生理学杂志. 2005,21(3):315 -318.
[11]Carragher NO. Calpain inhibition:a therapeutic strategy targeting multiple disease states[J]. Curr Pharm Des. 2006,12(5):615-638.
