高效产芽孢除磷菌株的筛选鉴定及影响其除磷的因素
2014-07-24石俭李红亚李术娜朱宝成
石俭,李红亚,李术娜,朱宝成
(河北农业大学 生命科学学院,河北 保定 071001)
水体富营养化已经成为全球普遍存在的环境问题,而引起水体富营养化的关键因素是磷[1-2],所以有效防治水体污染和富营养化的主要途径就是降低废水中磷的含量.特别是近年来,除磷工艺研究有了很大进展[3-5],当前废水除磷的方法主要包括:生物法、膜技术处理法、化学沉淀法、物理吸附法等.我国现在多数的污水处理主要是有机磷的去除,而去除率只有10%~20%,和国家二级排放标准相差还很大.生物除磷具有处理低能耗、效率高、运行成本低、不使用化学药剂、避免二次污染等优点,因而生物除磷成了当前的研究热点[6],并且具有很好的应用前景.
现已报道的生物除磷菌株主要包括:脱氮微球菌属、假单胞菌属、棒杆菌属、肠杆菌属、气单胞菌属等[7],菌株除磷能力一般为60%~90%,但这些菌株大多存在对自然环境耐受性差、不易繁殖培养、活性易于衰退等弊端,在实际使用中活菌数量不高,造成使用效果难以保证.
产芽孢菌株的强抗逆性可以避免以上弊端[8],因此本研究拟分离筛选出具有较高除磷能力的产芽孢菌株,以期为高效除磷菌株在实际污水生物除磷中的应用推广提供新的菌种资源、理论依据和技术支持.
1 材料与方法
1.1 样品采集
采自保定郊区、河北农大西校区以及竞秀公园附近的河流、湖泊底污泥共5份样品,编号后放入瓶中封口置于4 ℃冰箱备用,3d内处理完毕.
1.2 培养基
1)NA 培养基(g/L):牛肉膏5.0,蛋白胨10.0,NaCl 5.0,琼脂20,pH 7.2~7.4.
2)NB培养基:不加琼脂的NA 培养基.
3)富集培养基:在NB培养基中加入20mg/L的KH2PO4[9].
4)初筛培养基——无机磷培养基(g/L):葡萄糖10,(NH4)2SO40.5,NaCl 0.3,KCl 0.3,MgSO4·7H2O 0.3,Fe-SO4·7H2O 0.03,MnSO4·7H2O 0.03,Ca3(PO4)25.0,琼脂20,蒸馏水1 000mL,pH 7.0~7.5.
5)缺磷培养基(g/L):CH3COONa 2.00,Na2HPO4·2H2O 0.023,CaCl2·2H2O 0.011,NH4Cl 0.152 8,MgSO4·7H2O 0.08,K2SO40.02和2mL的微量元素,pH 7.2.
6)富磷培养基(g/L):CH3COONa 2.00,K2HPO40.025,NH4Cl 0.305 52,MgSO4·7H2O 0.091 26,CaCl2·2H2O 0.025 68和2mL的微量元素.
7)微量元素溶液(g/L):FeCl30.904 4,H3BO30.15,CuSO4·5H2O 0.03,KI 0.18,MnCl2·4H2O 0.06,ZnSO4·7H2O 0.12,CoCl2·7H2O 0.15,Na2MoO4·2H2O 0.06,乙二胺四乙酸10.
8)LB培养基(g/L):酵母提取物5.0,胰蛋白胨10.0,NaCl 10.0,pH 7.2.
9)菌种生理生化鉴定培养基:参见《常见细菌系统鉴定手册》[10].
1.3 试剂的配置
1)过硫酸钾溶液:将5g K2S2O8(分析纯)溶解于水,稀释至100mL.
2)抗坏血酸溶液:将10g C6H8O6(分析纯)溶解于水,稀释至100mL.在4 ℃下,储存于棕色试剂瓶.
3)钼酸盐溶液、磷标准储备溶液及磷标准使用溶液的配制见参考文献[11].
4)生理生化实验所需试剂参照《常见细菌系统鉴定手册》[10]配制.
1.4 工业污水
取自保定市西鲁岗污水处理厂,磷的质量浓度为3.6mg/L.
1.5 实验方法
1.5.1 菌株的富集培养
称取10g样品于100mL无菌水中,充分振荡后将菌悬液80 ℃水浴15min,取5mL 热处理后菌悬液接种于富集培养基中,30 ℃,180r/min摇床培养24h后取5mL 培养液转接于新鲜的富集培养基中,按以上方法重复3次.
1.5.2 菌株的分离纯化
将最终的富集培养液进行系列梯度稀释后涂布于NA 平板,在30 ℃条件下培养24h,将菌落形态不同的单菌落转接至NA 平板中划线检测[12]纯度后于4 ℃条件下保存备用.
1.5.3 除磷菌株的筛选及除磷率的测定
将分离到的菌株点接到无机磷培养基的固体平板上,30 ℃培养3d,观察并记录,将具有水解圈[11]的菌株进入后续研究,其他菌株则淘汰.
将具有水解圈的菌株接入NB培养基中活化,然后按4%接种量接入到缺磷培养基中,30 ℃,180r/min预培养24h 后,按6%的接种量转接入富磷液体培养基中,30 ℃,180r/min 摇床培养48h,将培养液5 000r/min离心10min,采用钼锑分光光度法[13]测定培养基上清液中的磷(PO3-4)含量,同时以不接菌且做同样处理的培养基作为对照.
除磷率=(空白培养基中磷的含量-接菌后培养基上清液中磷的含量)/空白培养基磷的含量×100%.
1.5.4 菌株异染粒的观察
选择除磷能力最高的复筛菌株进行异染颗粒染色实验,具体方法参见文献[10].
1.5.5 除磷菌株的应用条件研究
以富磷培养基作为基础培养基,将培养基pH 值分别调整为5.0,6.0,7.0,8.0,9.0,测定不同pH 值对菌株除磷能力的影响.
在最适pH 值条件下,在富集培养基中分别加入0.05g/L 的辅助碳源(葡萄糖、乳糖、可溶性淀粉、蔗糖、麦芽糖)和0.05g/L的辅助氮源(豆饼粉、蛋白胨、大豆蛋白胨、胰蛋白胨、玉米粉),调整成最适pH 值,按6%接种量接入种龄为12h的3-6菌株的种子液,30℃,180r/min摇床培养24h后对发酵液上清测定除磷效果,考察辅助碳、氮源对除磷菌株除磷能力的影响,以不接菌的培养基作对照.
1.5.6 菌株对工业污水的实际除磷能力的测定
将200mL工业废水加入500mL的三角瓶,添加最适的辅助碳氮源,调制最适pH 值,按6%接种量接菌,30 ℃,180r/min摇床培养48h,测定其中磷含量的变化.以上处理3个平行,以不接菌且加入同等碳氮源的污水作为对照.
1.5.7 菌株的种属鉴定
1)将供试菌株活化后在NA培养基平板上进行划线,观察菌株培养24h后的菌落形态,参照《常见细菌系统鉴定手册》将活化好的供试菌种进行革兰氏及结晶紫染色,利用光学显微镜观察供试菌株的菌体和芽孢的形态.
2)参照常见的细菌鉴定手册[10,14-17]进行生理生化实验.
3)DNA 的提取及16SrDNA 的扩增:提取细菌基因组DNA 采用试剂盒(康为世纪生物技术公司)进行,用琼脂糖凝胶电泳检测DNA 质量.
PCR 反应体系:DNA 模板2.5μL,10×Taq Buffer(含Mg2+)4.5μL,dNTP 3.5μL,27F1.5μL,1 495F1.5μL,Taq DNA 聚合酶0.5μL,ddH2O 35μL.
PCR 条件为:94 ℃预变性5min;94 ℃变性40s,58 ℃退火30s,72 ℃延伸90s,共进行31个循环;之后72 ℃延伸10min.PCR 产物经试剂盒纯化后,送上海生工生物工程技术公司进行测序.
4)16SrDNA 序列分析及系统发育树的构建:利用BLAST 的方式将供试菌株测定的16SrDNA 序列在GenBank中进行比对,获得与供试菌株相应16SrDNA 序列,构建系统发育树[18].
2 结果与分析
2.1 除磷菌株的分离与筛选
采集的5份样品经加热处理与富集培养,分离纯化后得到64株细菌,其中28株具有除磷能力,其初筛磷水解圈见图1.
2.2 除磷菌株除磷率的测定
2.2.1 磷标准曲线的测定
通过对波长600nm 下不同磷质量浓度的OD 值的测量,以磷质量浓度为横坐标,OD 值为纵坐标作图得到了磷的标准曲线即磷质量浓度与OD 值对应关系(图2),由此进行线性分析得出线性回归方程y=0.018 x.由R2=0.999可知此标准曲线的线性关系良好,达到了实验计算的要求.
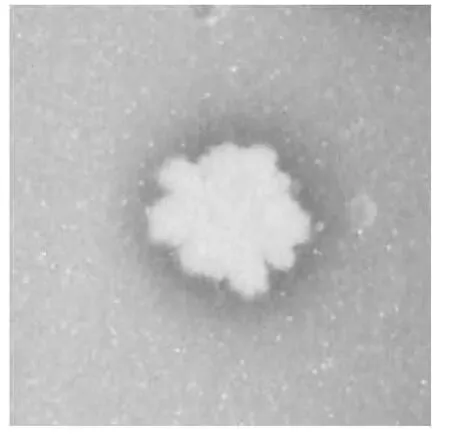
图1 初筛水解圈Fig.1 Hydrolysis circle of preliminary screening

图2 磷标准曲线Fig.2 Standard curve of preliminary
2.2.2 各菌株除磷率的测定
对初筛所得菌株进行缺磷与富磷连续培养,然后测定各菌株的除磷率,结果见表1.结果表明,28株菌中3-6的除磷率最高,达到34.63%.
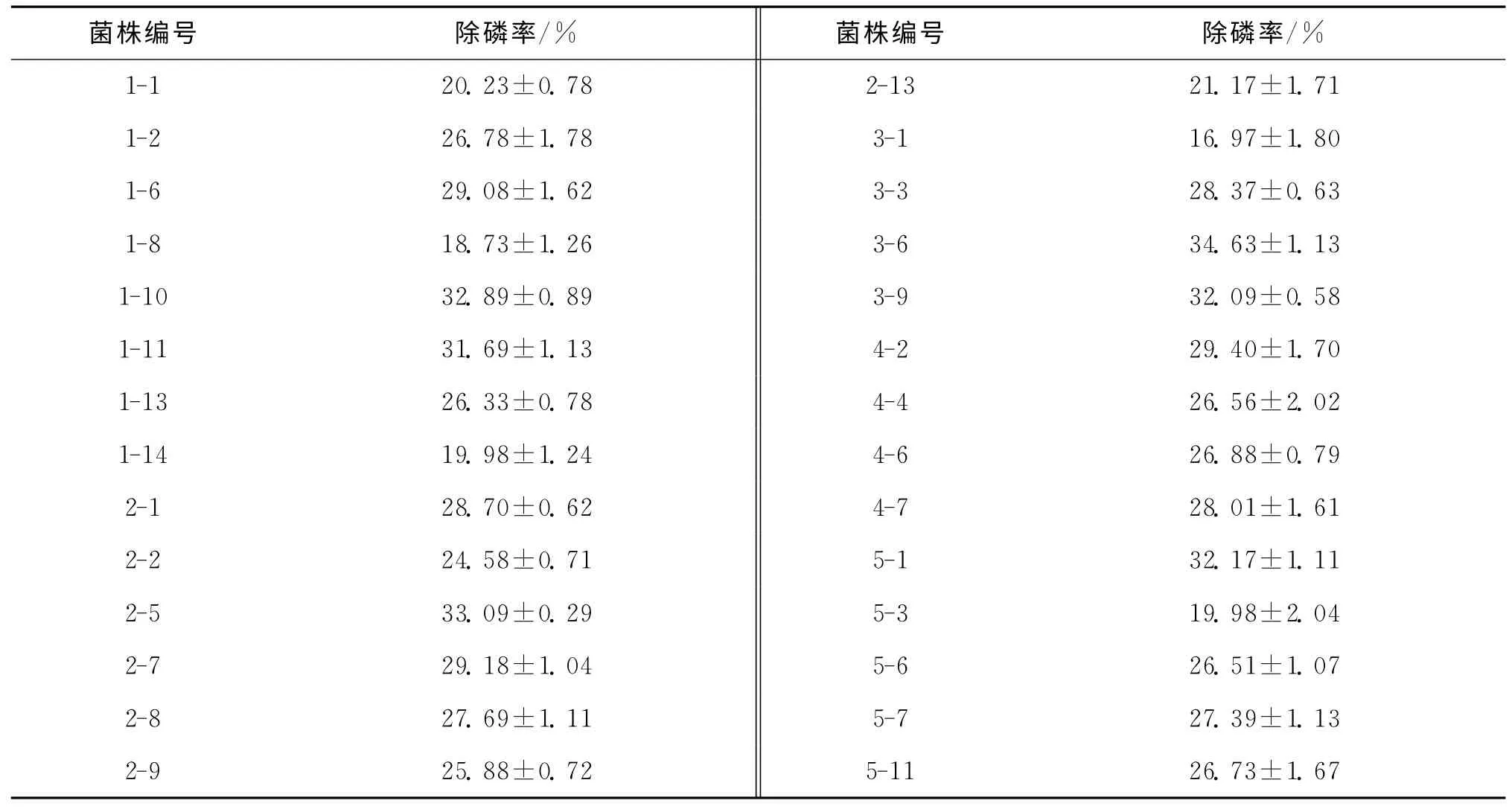
表1 菌株的除磷率Tab.1 Phosphorus removal rate of strains
2.3 菌株3-6异染粒的观察
经涂片显微观察,菌株3-6具有异染粒(图3).
异染粒是一种多除磷酸盐颗粒,是一种磷酸盐储藏物,是与脂类和蛋白质相结合的多聚偏磷酸盐.相关文献报道[19],异染粒和菌株的除磷特性密切相关.以上结果表明,菌株3-6 不仅表现出较高的除磷能力,而且经染色观察含有异染粒,因此将其作为后续研究的菌株.
2.4 除磷菌株的应用条件研究
通过测定不同pH 值对菌株的除磷能力的影响,结果表明6.0为最佳pH 值(图4).

图3 异染粒染色观察Fig.3 Observation of metachromatic granule

图4 不同pH 值对除磷率的影响Fig.4 Influence on phosphorus removal ability of different pH value
在最适pH 条件下,在富集培养基中分别添加不同的辅助碳氮源后接入菌株3-6,培养48h,以不接菌的培养基作为对照,测定各组除磷率如图5所示,实验结果表明:淀粉为最佳的辅助碳源,蛋白胨为最佳的辅助氮源.

图5 不同的辅助碳、氮源对除磷能力的影响Fig.5 Influence on phosphorus removal ability of different auxiliary carbon and nitrogen sources
碳源和氮源是异养微生物进行新陈代谢的重要影响因素,已有研究表明[7],碳源的种类和结构对生物除磷工艺中微生物的生长和除磷有着重要调节作用.由以上结果可见,加入辅助碳、氮源后菌株除磷能力与加入之前相比明显提高,辅助氮源为蛋白胨时除磷率可达92.21%,玉米粉组中除磷率为91.03%,相差不大.但玉米粉的价格要明显低于蛋白胨,因此选用玉米粉.玉米粉与淀粉均属于工业副产物,价格低廉,来源广泛.加入辅助碳氮源虽然成本略有增加,但可以大幅度提高磷的去除能力,综合评价此方法还是值得引荐的.
2.5 菌株对工业污水实际除磷能力的测定
在最佳辅助碳氮源及pH 值条件下,测定菌株3-6对工业废水的除磷效果(表2).结果表明,当处理时间为48h时除磷率为96.86%,且48h后由于营养物质的耗尽及pH 值等条件的变化致使除磷率不再增大.菌株3-6在废水中的除磷率高于一般文献报道的化学吸附除磷率[20],本研究采用的污水所含的磷主要为无机磷,较容易被菌株分解、吸收、利用等,才使除磷率比较高.但是本论文研究是在实验室内模拟进行的,因此在污水处理厂或实际应用时还需进一步研究.

表2 不同时间菌株对工业废水的除磷效果Tab.2 Phosphorus removal of industrial wastewater effect by strain of different time
2.6 菌株3-6的种属鉴定
2.6.1 形态观察
菌株3-6在NA 培养基平板上培养24h后的菌落形态呈圆形,表面湿润、光滑,边缘整齐而无皱褶,不透明,不产生色素,如图6.经染色后在油镜下观察,革兰氏染色呈阳性,菌体大小为(0.5~0.7)μm ×(1.7~2.0)μm,长杆状,芽孢呈椭圆形,中生,大小为(0.6~0.8)μm ×(1.0~1.5)μm,胞内基质染色均匀(图7).

图6 菌株3-6在NA平板上的菌落形态Fig.6 Colonial morphology of the strain 3-6

图7 菌株3-6菌体形态Fig.7 Morphology of the strain 3-6
2.6.2 生理生化实验结果
供试菌株3-6的生理生化实验结果见表3.

表3 菌株3-6生理生化实验结果Tab.3 Physiological and biochemical characteristics of the strain 3-6
根据以上实验结果,与《常见细菌系统鉴定手册》和《伯杰氏细菌鉴定手册》[9]中的标准菌株进行对比,可知3-6菌株与芽孢杆菌属(Bacillus sp.)中的蜡状芽孢杆菌(Bacillus cereus)很相近,初步鉴定为蜡状芽孢杆菌(B.cereus).
2.6.3 菌株3-6的16SrDNA 基因序列分析及同源性比较
以菌株3-6的DNA 为模板进行16SrDNA 序列的扩增,将PCR 产物送去测序,将测定的序列进行比对后建立其系统发育树.将3-6菌株与相关的标准菌株进行相似度比较,与蜡状芽孢杆菌的同源相似度最高(表4),为98.65%.综合以上3-6菌株的形态、生理生化特征鉴定及16SrRDNA 序列分析结果,鉴定菌株3-6为蜡状芽孢杆菌(B.cereus).

表4 3-6菌株与相关参比标准菌株的相似度比较Tab.4 Comparison of the similarities between several related reference standard stains and the stain 3-6

续表4Continue tab.4

图8 以菌株3-6的16SrDNA序列为基础的系统发育树Fig.8 Phylogenetic tree base on the 16SrDNA sequence of the strain 3-6
3 讨论
本研究分离筛选出的高效除磷菌株3-6蜡状芽孢杆菌(B.cereus)用于污水除磷在国内外文献还未见报道,研究结果为修复废水磷污染发现了新菌株.芽孢杆菌具有较强的抗逆性,易于实现大工业发酵生产,且生产菌剂及应用过程中仓储期更长,活性稳定性更好,可在使用过程中保持较高的生物量,从而保证使用效果.
菌株充分发挥其除磷能力,需要菌株的大量繁殖以及正确充分的代谢途径,因此,为菌株提供合适的营养与外部环境条件,对于促进其除磷能力的提高很有必要.研究明确了辅助营养成分和起始pH 等环境因子对3-6菌株除磷能力的影响,在成本允许的范围内使菌株除磷能力有了质的提高,探明了其适用条件和应用效果,为水体磷污染的微生物修复途径奠定了科学基础,此思路对于其他菌株除磷能力的提高具有借鉴意义.
[1] SEVIOUR R J,MINO T,ONUKI M.The microbiology of biological phos-phorus removal inactivated sludge systems[J].FEMS Microbiology Re-views,2003,27:99-127.
[2] TOERIEN D F,GERBER A,LOTTER L H,et al.Enhanced biological phos-phorus removal in activated sludge[J].Adv Microb Ecol,1990,11:173-230.
[3] REINER A,NORTHCUTT R G.An immunohistochemical study of the telencephalon of the senegalbichir(Polypterus senegalus)[J].J Comp Neurol,1992,319:359-386.
[4] MORITA Y,MURAKAMI T.Cytoarchitecture and topographic projections of the gustatory centers in a teleost,Carassius carassius[J].J Comp Neurol,1983,218:378-394.
[5] MEEK J.Functional anatomy of the tectum mesencephali of the goldfish.An explorative analysis of the functional implications of the laminar structural organisation of the tectum[J].Brain Res,1983,287(3):247-297.
[6] 吴海林,杨开,王弘,等.废水除磷技术的研究与发展[J].环境污染治理技术与设备,2003,4(1):53-57.WU Hailin,YANG Kai,WANG Hong,et al.Research and development technology of phosphorus removal from wastewater[J].Environmental Pollution Control Technology and Equipment,2003,4(1):53-57.
[7] 傅宏兵,吴涓.两株高效除磷菌的筛选及其除磷特性的研究[J].生物学杂志,2009,26(6):23.FU Hongbing,WU Juan.Study on separation and screening of strainswith high capability of phosphate accumulating and characteristics of phosphorus removal[J].Journal of Biology,2009,26(6):23.
[8] 王倩,李术娜,朱宝成,等.兰花炭疽病拮抗细菌Bacillus megaterium 1-12菌株的产芽孢条件优化[J].河北大学学报:自然科学版,2008,28(5):523-528.WANG Qian,LI Shuna,ZHU Baocheng,et al.To optimize spore formation conditions of antagonistic strain 1-12of Bacillus megaterium against colletoichum gloeosporioides[J].Journal of Hebei University:Natural Science Edition,2008,28(5):523-528.
[9] 刘亚男,于水利,薛罡,等.除磷菌PAO1-1的筛选及除磷特性[J].中国给水排水,2005,21(10):13-17.LIU Yanan,YU Shuili,XUE Gang,et al.Study on separation and screening of phosphate accumulating Bacterial Strain PAO1-1and characteristics of phosphorus removal[J].China Water & Waste Water,2005,21(10):13-17.
[10] 东秀珠,蔡妙应.常见细菌系统鉴定手册[M].北京:科学出版社,2001.
[11] 苏丹.低温除磷菌的筛选[J].内蒙古石油化工,2010,10:35-36.SU Dan.Screening phosphorus accumulating bacteria at low temperature[J].Petroleum Chemical Industry of Nei Menggu,2010,10:35-36.
[12] 张爱民,张双凤,赵钢勇,等.PGPR 芽孢杆菌B-1 菌株的鉴定及其应用效果[J].河北大学学报:自然科学版,2011,31(3):295.ZHANG Aimin,ZHANG Shuangfeng,ZHAO Gangyong,et al.PGPR bacillus the B-1strain identification and its application effect[J].Journal of Hebei University:Natural Science Edition,2011,31(3):295.
[13] GB 11893—89水质总磷的测定 钼锑铵分光光度法[S].
[14] 布南坎R E,吉布斯N E.伯杰氏细菌学鉴定手册[M].9版.北京:科学出版社,1995.
[15] 张纪忠.微生物分类学[M].上海:复旦大学出版社,1990.ZHANG Jizhong.Microbial taxonomy[M].Shanghai:Fudan University Press,1990.
[16] 卢振祖.细菌分类学[M].武汉:武汉大学出版社,1994.
[17] 丁新化,严复.固定化德氏乳杆菌发酵乳酸及其微环境对细胞的影响[J].高校化学工程学报,1990,1(4):16.DING Xinhua,YAN Fu.Immobilized DE's lactobacillus fermentation lactic acid,and the influence of the microenvironment for cell[J].Journal of Chemical Engineering Colleges and Universities,1990,1(4):16.
[18] THOMPSON J D,GIBSON T J,PLEWNIAK F,et al.The CLUSTAL_X windows interface:flexible strategies for multiple sequence alignment aided by quality anal-ysis tools[J].Nucleic Acids Research,1997,25:4876-4882.
[19] 张兆君.生物除磷机理及除磷微生物[J].安徽农业科学,2010,38(8):4205-4207.
[20] 侯芳,卫世乾.富营养化水体中磷的去除研究[J].许昌学院学报,2010,28(2):109-110.HOU Fang,WEI Shiqian.Summarization of removing phosphorus from eutrophic water[J].Journal of Xuchang University,2010,28(2):109-110.
