生长调节物质对楸树花粉萌发及花粉管生长的影响
2014-07-24王改萍朱雪晨彭方仁
王改萍 朱雪晨 彭方仁 鲍 林
(南京林业大学森林资源与环境学院,江苏 南京 210037)
生长调节物质对楸树花粉萌发及花粉管生长的影响
王改萍 朱雪晨 彭方仁 鲍 林
(南京林业大学森林资源与环境学院,江苏 南京 210037)
采用离体花粉液体培养法研究4种植物生长调节物质对不同来源楸树花粉萌发及花粉管生长的影响。结果表明:较低浓度的赤霉素促进花粉萌发及花粉管生长,高浓度则表现为明显的抑制作用,最适浓度为300 mg/L;吲哚乙酸和2,4-D对花粉的作用效果与楸树的种源有关,总体上均呈低浓度促进,高浓度抑制的规律;花粉萌发率均在吲哚乙酸为15 mg/L时达到最大值,只有2个种源与对照间差异极显著,花粉萌发率在2,4-D为200 mg/L时均达到最大值,超过最适浓度后,吲哚乙酸和2,4-D均对花粉萌发及花粉管生长表现为抑制作用;各个浓度的萘乙酸均抑制花粉萌发及花粉管生长,且抑制程度随浓度增加而加强。
楸树;植物生长调节物质;花粉萌发率;花粉管生长
楸树(CatalpabungeiC.A.Mey.)属紫葳科梓属高大落叶乔木,其材质优良、用途广泛,自古就有“木王”之美称[1]。楸树自交不育,往往开花不结实,种子发芽率低,加之营养繁殖困难,导致其资源匮乏,阻碍了楸树的大面积发展[2-4]。因此,研究楸树杂交育种,实现有性繁殖,通过提高人工授粉率获得种子是解决这一问题的有效途径。
植物生长调节物质是人工合成的、具有调节控制植物体内物质代谢或生理功能的微量有机化合物,它们能改变植物体内源激素间的相互平衡关系,对调节树木的生长发育及授粉结实有重要作用[5-6]。近年来,很多学者通过研究植物生长调节剂对花粉萌发和花粉管生长的影响[7-9],确定了促进花粉受精的植物生长调节物质种类及其使用浓度,为提高人工授粉效率提供了理论依据。目前,植物生长调节剂在楸树花粉萌发及花粉管生长上的研究较少,为此,本文探讨不同浓度的4种生长调节物质对不同来源的3种楸树花粉离体萌发的影响,以期为楸树花粉的生殖生物学研究、植物的杂交育种提供理论依据。
1 材料与方法
1.1 材料采集
供试材料为成年健壮的楸树,分别位于连云港后云台山国家森林公园内(简称连楸)、南京老山林场内(简称老楸)和南京林业大学校内(简称南楸),均不能自花结实。
4月中旬至5月上旬盛花期,在上述3个区域内选择3~5株生长较一致的楸树,采集大花或即将开放的花蕾,用小镊子取出花药充分混合,置于垫有硫酸纸的培养皿中,室温(24 ℃左右)下放置约2 d,待花药自然开裂翻卷散出花粉后,收集花粉,置于4℃冰箱中保存备用。
1.2 试验方法
本试验共选用4种生长调节物质,均在基本培养基(含0.02 g/L MgSO4、0.01 g/L KNO3、0.03 g/L Ca(NO3)2和0.01 g/L H3BO3,pH 5.6)基础上,根据试验设定调配液体培养基。4种生长调节剂浓度参照张绍铃等[8]浓度设定标准,略有调整。分别为:赤霉素:0(对照)、100、200、300、400、500 mg/L;吲哚乙酸:0(对照)、5、15、25、50、100 mg/L;2,4-D:0(对照)、50、100、200、300、500 mg/L;萘乙酸:0(对照)、2、5、10、25、50 mg/L。
花粉的培养方法参照王改萍等的花粉液体培养法[4]进行。在恒温(24 ℃)暗光条件下培养6 h后,用Nikon YS100光学显微镜观察花粉萌发及花粉管生长状况,以花粉管长度超过花粉粒直径作为判定花粉萌发的标准。每处理统计100粒花粉和20个花粉管长度,重复3次。
应用 DT2000 图像分析软件统计花粉总数和花粉萌发数。数据用Excel 统计,采用SPSS 16.0软件进行方差分析(one-way AVOVA)及多重比较(Duncan)。
2 结果与分析
2.1 赤霉素对花粉萌发率及花粉管生长的影响
不同浓度的赤霉素对楸树花粉萌发率和花粉管生长均有明显的影响,其结果见表1。

表1 不同浓度赤霉素处理下各种源楸树花粉 萌发率及花粉管长度
注: 大写字母为α=0.05,小写字母为α=0.01,相同字母表示差异不显著。
由表1可看出,当赤霉素在低浓度时,可促进不同种源楸树的花粉萌发,且随浓度的增加,花粉萌发率升高,在300 mg/L时达到最大值,不同产地楸树均比对照上升了10%左右。当赤霉素浓度继续增加时,花粉萌发率受到明显抑制,赤霉素浓度达到500 mg/L时,各产地楸树花粉萌发率均表现为最低,下降最多的是老楸,萌发率为对照的30%。
对不同种源楸树的花粉萌发率进行方差分析结果见表2。
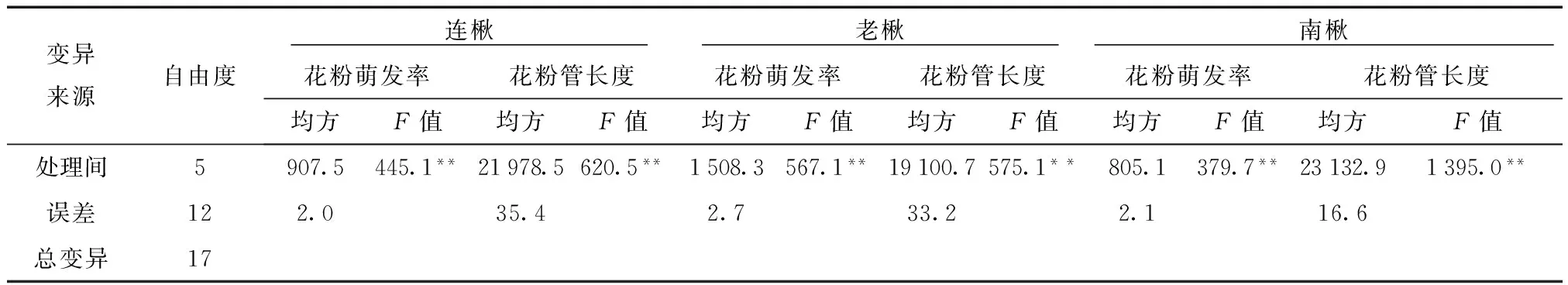
表2 不同浓度赤霉素处理各种源楸树花粉萌发率及花粉管长度方差分析
注:**和*分别表示差异极显著和差异显著。
由表2可知,不同浓度处理间存在极显著差异(F>F0.01)。进一步分析不同处理之间的差异性,发现赤霉素浓度为100 mg/L和200 mg/L时与对照差异不显著。300~500 mg/L之间各处理与对照有极显著差异,表明赤霉素在此浓度区间下对花粉萌发率有显著影响。
不同浓度赤霉素对花粉管生长的影响规律与花粉萌发率相似。在低浓度条件下,赤霉素能够显著促进花粉管的生长,而高浓度时表现为抑制。楸树花粉管长度的最大值也出现在赤霉素浓度300 mg/L的条件下,连楸和南楸比对照增加了近2倍,老楸增加了1.3倍。当赤霉素浓度达到500 mg/L时则表现为明显的抑制作用,各种源楸树均比对照下降近50%。对花粉管长度进行方差分析,结果见表2。由表2发现,不同处理间存在极显著差异(F>F0.01),进一步分析可知(表1),赤霉素浓度在100~400 mg/L时极显著促进了花粉管生长。
赤霉素对花粉管生长的抑制作用有滞后性,当赤霉素浓度达到400 mg/L时,其显著抑制花粉萌发,各种源楸树花粉萌发率均低于对照,降幅最大的老楸仅为对照的50%左右。但其却促进花粉管生长,不同种源楸树均高于对照,促进作用最大的为连楸,其花粉管长度为对照的1.5倍。综合考虑赤霉素对花粉生活力的促进作用,可认为300 mg/L为最适浓度。
2.2 吲哚乙酸对花粉萌发及花粉管生长的影响
不同浓度吲哚乙酸处理下各种源花粉萌发率及花粉管长度见表3。
由表3可知,不同浓度的吲哚乙酸对各种源楸树花粉萌发率及花粉管生长存在明显的影响。低浓度的吲哚乙酸对花粉萌发有促进作用,各种源楸树均在15 mg/L时达到最大值,但增幅较小,增加最多的老楸也仅比对照增加约12%。当其浓度继续增加时,明显抑制楸树花粉萌发,在100 mg/L时,各种源楸树花粉萌发率低于10%,几乎不再萌发。
对不同处理的萌发率进行方差分析,结果表明,不同处理间存在极显著差异(F>F0.01)(表4)。而各浓度间的差异性分析也表明,连楸和老楸在吲哚乙酸浓度为5 mg/L时与对照没有差异,但超过15 mg/L时与对照有显著差异。当其浓度大于 15 mg/L 后则有明显的抑制作用。而南楸在15 mg/L时与对照没有差异,其他浓度处理与对照存在显著差异,表现为抑制花粉萌发。
不同浓度处理吲哚乙酸对不同种源楸树花粉管长度的影响与其对花粉萌发率的影响近似,结果见表3。由表3可知,低浓度吲哚乙酸对花粉管生长略有促进作用,增幅最大的为老楸,但浓度15 mg/L时也仅比对照提高9%。吲哚乙酸浓度为25~100 mg/L时,随浓度的增加花粉管长度大幅下降,在100 mg/L时达到最小值,老楸仅为对照的37%,而连楸和南楸为对照的55%左右。

表3 不同浓度吲哚乙酸处理下各种源楸树 花粉萌发率及花粉管长度
注: 大写字母为α=0.05,小写字母为α=0.01,相同字母表示差异不显著。
对花粉管长度结果进行方差分析,结果发现,不同处理间存在极显著差异(F>F0.01)(表4)。进一步分析显示,不同浓度间的差异在各种源间表现不同。连楸在5、15 mg/L处理时与对照无显著差异,而老楸和南楸则在15 mg/L处理时与对照存在显著差异。但只要达到25 mg/L及以上浓度处理,所有种源均与对照存在极显著差异。这表明吲哚乙酸与花粉萌发和花粉管生长之间关系较为复杂,在进行相关处理选择时要综合考虑,这样才能提高选择效果。

表4 不同浓度吲哚乙酸处理各种源花粉萌发率及花粉管长度方差分析
注:**和*分别表示差异极显著和差异显著。
2.3 2,4-D对花粉萌发及花粉管生长的影响
不同浓度2,4-D处理各种源楸树花粉萌发率及花粉管长度见表5。
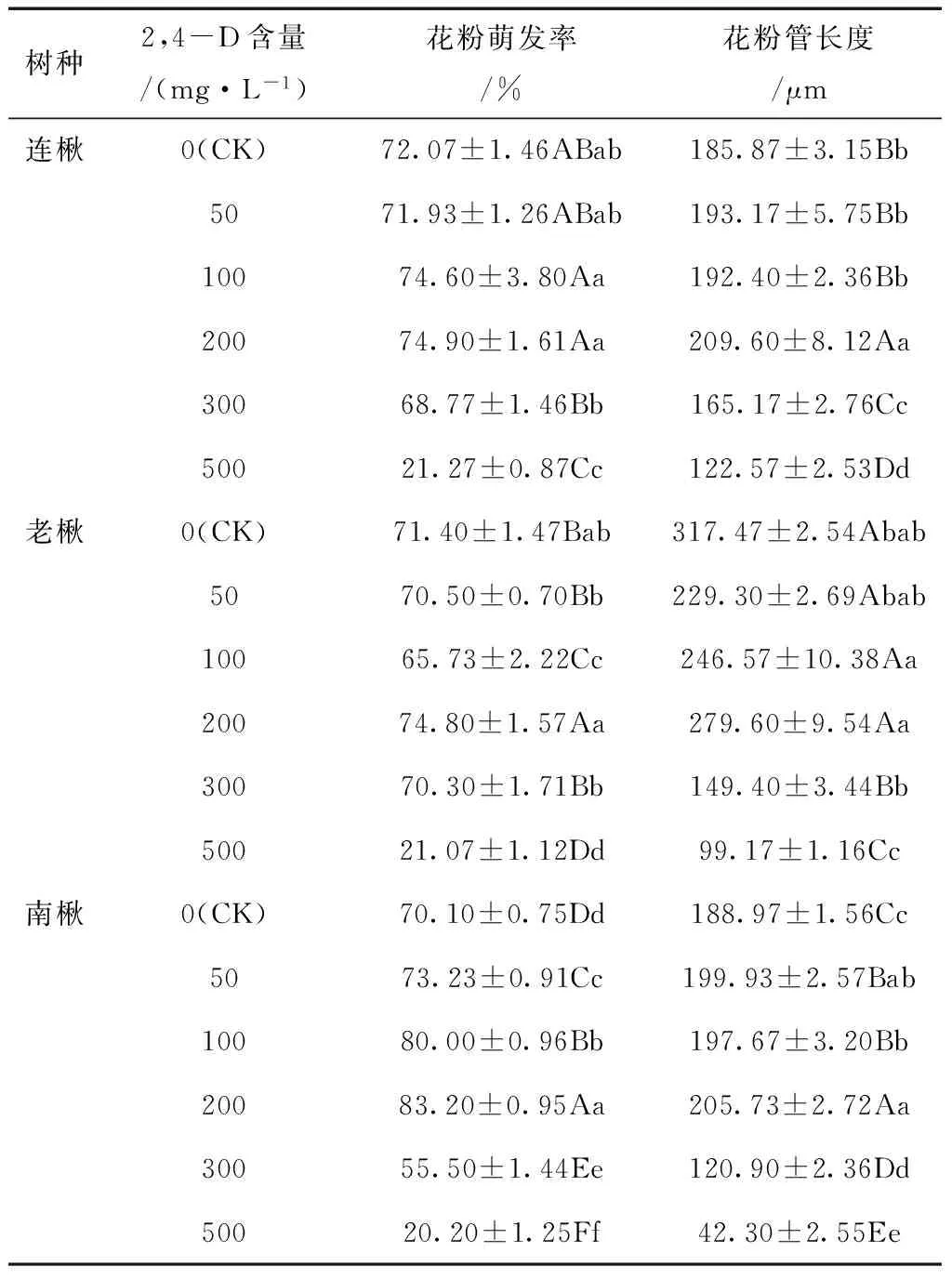
表5 不同浓度2,4-D处理下各种源楸树花粉 萌发率及花粉管长度
由表5可知,不同浓度2,4-D对各种源楸树花粉萌发率及花粉管生长均有一定影响,但在不同种源的楸树间存在差异。各种源楸树花粉萌发率在2,4-D浓度为200 mg/L时达到最大值,南楸增幅最大,比对照增加18.7%。连楸在2,4-D浓度为50 mg/L时花粉萌发率有所降低,老楸花粉萌发率则在2,4-D浓度为50 mg/L和100 mg/L时均受到抑制。当2,4-D浓度升至300~500 mg/L后,所有种源楸树花粉萌发均受到抑制,且随其浓度的增加抑制作用增强,2,4-D浓度升至500 mg/L时花粉萌发率急剧下降,萌发率比对照下降了近70%。
对花粉萌发率结果进行方差分析,结果表明,不同处理间存在极显著差异(F>F0.01)(表6)。但不同浓度在不同种源楸树上产生的影响不同。2,4-D浓度在50~200 mg/L时,连楸表现为与对照之间差异不显著,而南楸和老楸(除50 mg/L外)则表现为差异显著。当2,4-D浓度继续上升至500 mg/L时,各种源楸树均与对照存在显著差异。反映出2,4-D在不同种源楸树中的作用不同,在较低浓度下,对南楸花粉萌发起促进作用,但对连楸和老楸花粉萌发率影响不大。浓度太高时,则抑制各种源楸树花粉萌发。
2,4-D对花粉管生长的影响也随楸树种源而异。在较低浓度范围(50~200 mg/L)时,连楸和南楸的花粉管长度高于对照,并在200 mg/L时达到最大值,分别比对照增加13%和9%,而老楸则全部表现为抑制作用。当2,4-D浓度达到较高范围时(300~500 mg/L),各种源楸树花粉均受到抑制,且随浓度增加抑制程度增强,南楸在2,4-D浓度为500 mg/L时花粉管长度仅为对照的20%左右。方差分析也表明,不同处理间存在极显著差异(F>F0.01)(表6)。而处理间的差异则表现为:连楸在2,4-D浓度为200 mg/L时与对照差异极显著,但在50、100 mg/L时虽高于对照,但差异不显著;在50~200 mg/L时,南楸各处理间与对照差异均显著,但老楸则与对照差异不显著。
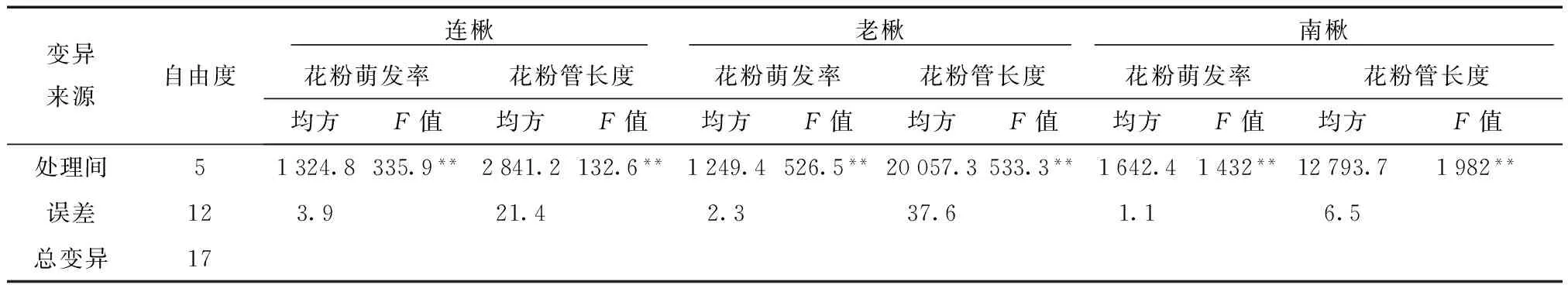
表6 不同浓度2,4-D处理各种源楸树花粉萌发率及花粉管长度方差分析
注:**和*分别表示差异极显著和差异显著。
2.4 萘乙酸对花粉萌发及花粉管生长的影响
不同浓度萘乙酸处理各种源楸树花粉萌发率及花粉管长度见表7。
由表7可知,萘乙酸对楸树花粉萌发率及花粉管生长均存在明显的抑制作用。低浓度的萘乙酸对花粉萌发率和花粉管生长影响较小,除老楸在萘乙酸浓度2 mg/L时花粉萌发率略有提高外,其他种源楸树则略有下降。当其浓度大于2 mg/L后,随萘乙酸浓度的增加,抑制作用增强。花粉萌发率及花粉管长度均受到明显抑制,萘乙酸浓度达到50 mg/L时,老楸花粉的萌发率仅为对照的14%,连楸是对照的23%,南楸为对照的18%,此时花粉管长度在13~22 μm之间。
方差分析结果表明,不同处理间存在极显著差异(F>F0.01)(表8)。进一步的分析也显示,除连楸在萘乙酸浓度2 mg/L处理下与对照差异不显著,其他处理均与对照差异极显著。
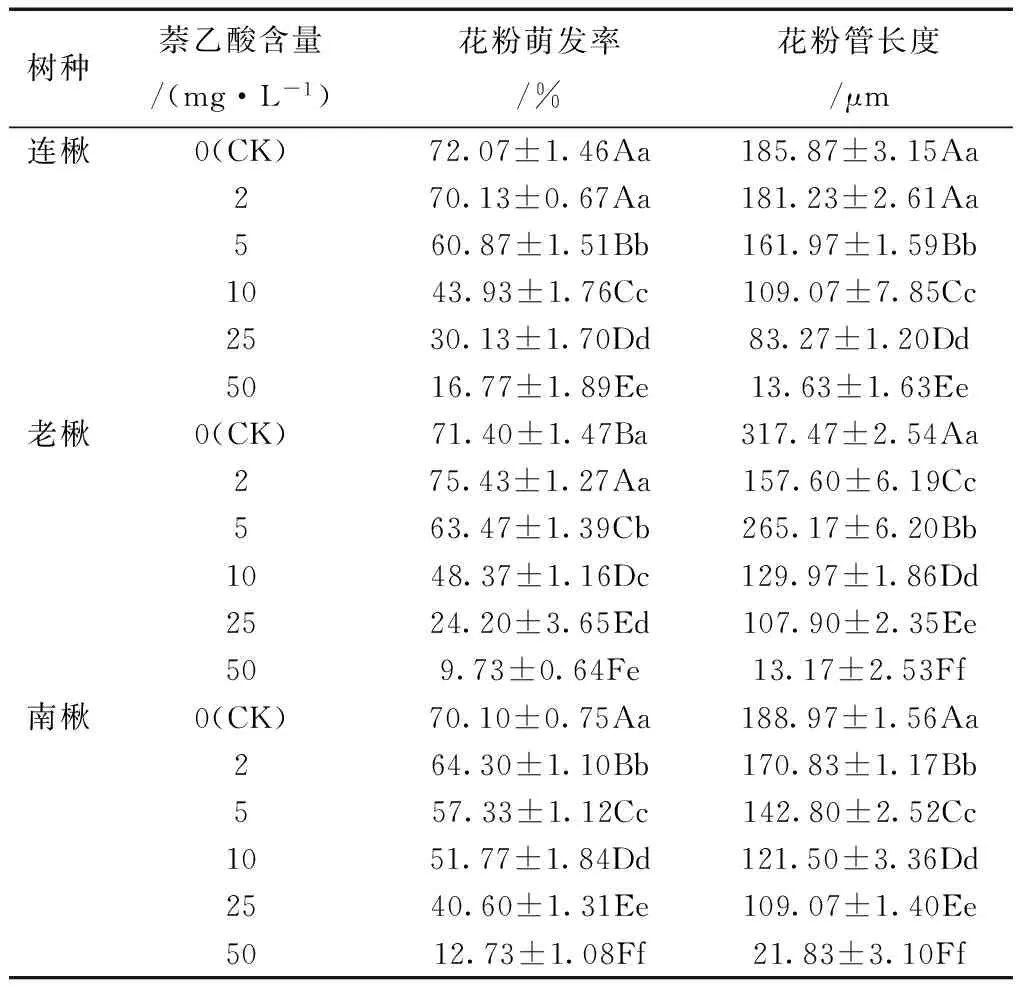
表7 不同浓度萘乙酸处理各种源楸树花粉 萌发率及花粉管长度
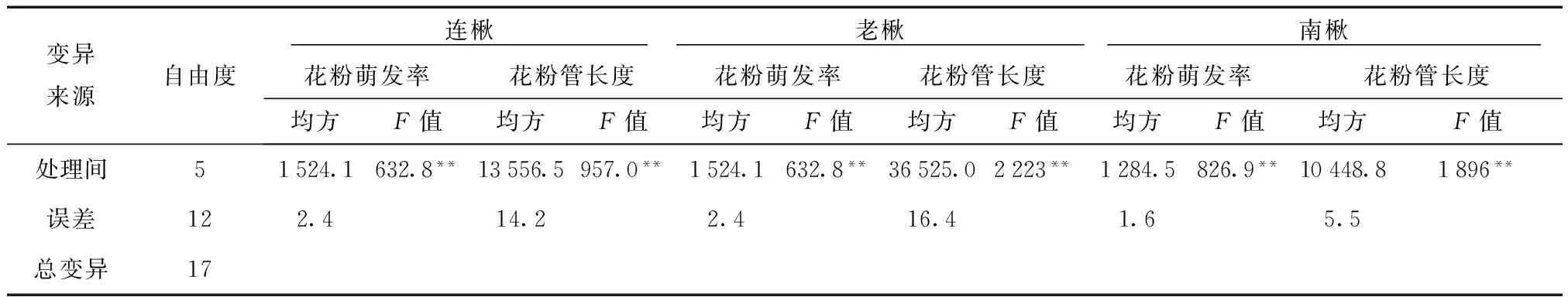
表8 不同浓度萘乙酸处理各种源楸树花粉萌发率及花粉管长度的方差分析
注:**和*分别表示差异极显著和差异显著。
3 结论与讨论
植物生长调节物质通过影响植物体内源激素的平衡,实现对植物体内物质代谢或生理功能的控制。相关的研究报道表明,一些生长调节物质有利于花粉的萌发及花粉管的生长,从而缩短授粉及受精时间,达到提高坐果率的目的。刘雪莲等对紫丁香(Syringaoblata)花粉的研究中,认为赤霉素、NAA在较低浓度范围内能促进花粉的萌发及花粉管生长,但2,4-D则起抑制作用[10]。Voyiatzis等的研究也认为,赤霉素在50~200 mg/L时对花粉萌发及花粉管生长起促进作用,但浓度高时则抑制[11]。王忠等研究则表明,赤霉素无论浓度高低均抑制花粉萌发[12]。谭晓风等的研究则认为,适当浓度的吲哚乙酸、萘乙酸、2,4-D、赤霉素均可促进油茶(Camelliaoleifera)花粉的萌发[9]。张绍铃等对丰水梨(Pyrusserotina)的研究则表明,赤霉素、2,4-D、吲哚乙酸在低浓度时促进花粉萌发及花粉管的生长,当浓度超过一定范围后,反而起抑制作用;而萘乙酸则抑制花粉萌发及花粉管生长,且随着浓度的增加抑制作用增强[8]。之后对金光杏梅(Prunusmumevar.bungo)及桃(Amygdaluspersica)树等的研究中也有类似发现[13-14]。目前尚不清楚这些生长调节物质在花粉萌发及花粉管生长过程中的作用机理,但可能与植物体本身的激素有关。本研究中发现,低浓度的赤霉素促进楸树花粉的萌发及花粉管的生长,高浓度时则起抑制作用,最适楸树花粉萌发及花粉管生长的浓度为300 mg/L。而吲哚乙酸在15 mg/L时萌发率及花粉管长度均达到最大值,但其对南楸的萌发率没有明显促进。当浓度继续增加时,则表现为显著的抑制。2,4-D对楸树花粉的作用效果与不同种源有关。在50~200 mg/L处理下,显著促进了南楸的花粉萌发和花粉管生长,并在200 mg/L时达到最大值,而对老楸和连楸的萌发率影响不大。当2,4-D浓度超过200 mg/L后,明显抑制各种源楸树的花粉萌发率及花粉管长度。而萘乙酸对花粉萌发的效应表现与张绍铃等的结果相似,即无论萘乙酸浓度高低,均抑制花粉萌发及花粉管生长,且抑制作用整体上表现为随浓度的增加而加强[8]。
相关研究表明,花粉的萌发及花粉管的生长是一个极其复杂的生理过程,生长调节物质由于作用浓度、作用时间及作用方式不同,在不同植物中产生出不同的效果,其对不同种源楸树的作用效果存在差异,可能与植物体内该相关激素的含量等有关。本次研究中,仅进行了调节物质的单因素试验,而不同的调节物质之间可能存在交互效应,因此,在以后的研究中要进行多因素试验设计,寻找到适合不同楸树生长的最适条件,为提高楸树授粉受精及结实率提供理论基础。
[1] 郭从俭,钱士金,王连卿,等.楸树栽培[M].北京:中国林业出版,1988.
[2] 彭方仁,郝明灼,梁有旺,等.我国楸树种质资源现状及开发利用策略[J].林业科技开发,2011,25(6):1-5.
[3] 郝明灼,彭方仁,王改萍,等.楸树人工杂交授粉试验及种实分析[J].南京林业大学学报:自然科学版,2008,32(5):131-134.
[4] 王改萍,杨红宁,倪果果,等.楸树等4种梓属树种花粉离体培养条件的研究[J].植物资源与环境学报,2009,18(2):34-42.
[5] 郑凯,丁久玲,俞禄生.不同植物生长调节物质对2种空气凤梨生长的影响[J].浙江农业科学,2012(10):1416-1419.
[6] 高超,袁德义,袁军,等.花期喷施营养元素及生长调节物质对油茶坐果率的影响[J].江西农业大学学报,2012,34(3):505-510.
[7] 杨谷良,秦仲麒,陈娟.植物生长调节物质对黄金梨花粉萌发和花粉管生长的影响[J].种子,2010,29(7):39-41.
[8] 张绍铃,高付永,陈迪新,等.植物生长调节物质对丰水梨花粉萌发和花粉管生长的影响[J].西北植物学报,2003,23(4):586-591.
[9] 谭晓风,袁德义,袁军,等.维生素C及植物生长调节物质对油茶花粉萌发率的影响[J].浙江林学院学报,2010,27(6):941-944.
[10] 刘雪莲,杨晴晴,秦佳梅,等.植物生长调节剂对紫丁香花粉离体萌发的影响[J].东北林业大学学报,2011,39(10):54-55.
[11] Voyiatzis D G, Paraskevopoulou-Paroussi G. Factors affecting the quality and in vitro germination capacity of strawberry pollen[J]. Journal of Horticultural Science & Biotechnology, 2002, 77(2): 200-203.
[12] 王忠,廖康.植物生长调节剂对全球红葡萄花粉活力的影响[J].新疆农业大学学报,2004,27(4):43-46.
[13] 米银法,王进涛,胡海渴.几种植物生长调节物质对桃花粉萌发效应的影响[J].西南农业学报,2012,25(3):1023-1026.
[14] 周瑞金,彭兴芝,张丽丽,等.植物生长调节物质对杏梅花粉萌发及花粉管生长的影响[J].广东农业科学,2010,37(4):70-73.
(责任编辑 张 坤)
Effects of Plant Growth Regulating Substances onCatalpabungeiPollen Germination and Pollen Tube Growth
WANG Gai-ping, ZHU Xue-chen, PENG Fang-ren, BAO Lin
(College of Forest Resources and Environment, Nanjing Forestry University, Nanjing Jiangsu 210037, China)
The effect of four types of plant growth regulating substances on pollen germination and pollen tube growth of differentCatalpabungeiprovenances was studied by in-vitro pollen cultivation in liquid media. The results showed that low concentration of GA3stimulated pollen germination and pollen tube growth, whereas the high concentration of GA3had inhibition effect. The most suitable concentration to stimulate the pollen germination and pollen tube growth was 300 mg/L. The effect of IAA and 2,4-D varied with theC.bungeiprovenances, but the general law was that the low concentrations could promote but the high concentrations would inhibit the pollen germination and pollen tube growth. The maximum pollen germination rate was obtained by 15 mg/L IAA concentration, there was significant difference in the pollen germination rate among two provenances and the control. Regarding to 2,4-D, the maximum pollen germination rate was obtained by 200 mg/L concentration. When the concentrations of both IAA and 2,4-D were over the most suitable values, these two types of plant growth regulators would inhibit the pollen germination and pollen tube growth. NAA had an inhibition effect on the pollen germination and pollen tube growth ofC.bungeiat different concentrations, the higher NAA concentration was, the sronger the inhibition effect would be.
Catalpabungei;plant growth regulators; pollen germination rate; pollen tube growth
2013-10-11
国家“十二五”科技支撑计划项目子课题(2012BAD21B03)资助;江苏省高技术项目(BG2006319)资助;江苏省普通高校研究生科研创新基金资助。
彭方仁(1963—),男,教授。研究方向:用材林及经济林的栽培及利用。Email:frpeng@njfu.edu.cn。
10.3969/j.issn.2095-1914.2014.02.003
S722.3
A
2095-1914(2014)02-0013-06
第1作者:王改萍(1970—),女,博士,副教授。研究方向:林木培育及林木生理生化。Email:wanggaiping@njfu.edu.cn。
