从生活走进化学
2014-07-24李德前
李德前

一、教学思路
本活动案例取自沪教版九年级《化学》第5章第3节《金属防护和废金属回收》,以其第一部分“钢铁锈蚀及其防护”为基础,适当增加了钢铁锈蚀正面利用的实例,如暖宝宝、铁系食品脱氧剂、用铁粉测量空气中氧气的体积含量等。
本节课通过“钢铁锈蚀害死人”的情境设计,通过探究钢铁锈蚀的条件,培养学生根据理论知识和生活经验提出合理猜想的能力,以及灵活运用控制变量法解决实际问题的技巧。通过呈现钢铁锈蚀的正面利用,培养学生的辩证唯物主义思想,也使学生认识到化学是一把双刃剑,要合理运用。在教学过程中,通过小组合作、猜想假设、设计实验、动手操作等一系列学习活动,充分发挥学生的潜能,培养学生的探究意识;通过联系实际,培养学生学以致用的能力,同时体现“从生活走进化学,从化学走向社会”的课程理念。
另外,考虑到课堂时间的局限性,为了提高实验效率和课堂效益,探究钢铁锈蚀条件的实验装置提前5天组装好,在本节课上学生设计好实验方案后再适时展示,以使学生及时观察到明显的实验现象。为增加学生动手操作的机会,又安排了2个分组实验:检验铁系脱氧剂的主要成分,利用钢铁锈蚀原理测量空气中氧气的体积分数。
二、学习目标
1.知道钢铁锈蚀的条件,认识金属防护的简单方法。
2.知道合理利用钢铁锈蚀能够趋利避害。
3.初步学会利用控制变量法探究钢铁锈蚀的条件。
4.体验测量空气中氧气体积分数的又一种方法。
5.激发学习化学的兴趣,保持探究身边物质的兴趣。
三、教学过程
1.创设情境,引入探究的主题。
教师:某化工厂有一个存放MgCl2溶液的钢铁容器,使用久了容器已锈迹斑斑,亟需维修。一天,2名维修工刚进入容器就晕倒了。被发现时,一名操作工已不幸遇难,另一位经抢救脱险。事故调查组对钢铁容器内的气体成分进行了检测,发现并不存在有毒气体,但容器中氧气的含量却非常低。
为什么钢铁容器内会严重缺氧呢?杀害维修工人的“凶手”是谁呢?
教师板书:有关钢铁锈蚀的探究
2.设计实验,探究钢铁锈蚀的条件。
教师:钢铁是应用普遍而又极易锈蚀的金属材料。铁锈的化学成分是Fe2O3·xH2O,它是疏松的红色固体。为了减少损失,我们需要探究钢铁锈蚀的原因和防护措施。
教师提问:根据铁锈的化学成分、我们的生活经验等,猜想钢铁锈蚀需要哪些条件。
学生:钢铁锈蚀肯定需要水,因为铁锈中就含有化合态的水。
学生:我发现阴雨天钢铁的锈蚀很严重,所以我也认为钢铁锈蚀需要水。
学生:因为钢铁锈蚀发生在空气中,而且氧气的化学性质比较活泼,所以我认为钢铁锈蚀还需要氧气。
学生:在淮海战役纪念馆里,我发现放置在氮气密封箱里的文物很难生锈,所以我也认为钢铁锈蚀需要氧气。
学生:我觉得钢铁锈蚀只需要水就可以了,因为水中既有氢元素,又有氧元素,可以满足铁锈的需求。
教师小结:这些猜想都有一定的道理。要验证我们的猜想,该如何去设计实验装置呢?
学生:至少需要设计3个对比实验。
学生:对比实验还需控制变量,分别控制:钢铁仅与氧气接触,仅与水接触,既接触水又接触氧气。
教师小结:控制变量法是研究多因素问题的常用方法。
(因为钢铁锈蚀属于缓慢氧化,所以教师提前5天按照学生的设计思路,组装好了实验装置。)
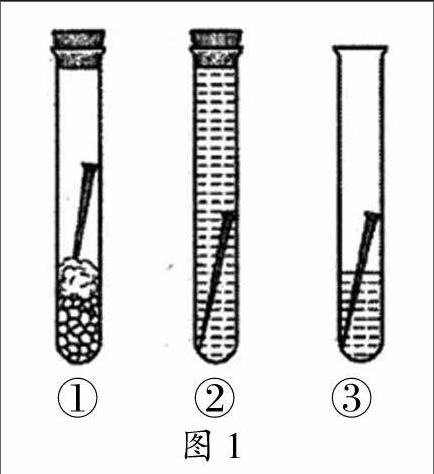
展示图1实验装置(试管①中的铁钉处于干燥的空气中,试管②中的铁钉完全浸没在冷却的沸水中,试管③中的铁钉既接触水又接触氧气)。学生观察实验现象,然后汇报。
学生:试管①②中的铁钉没有生锈,试管③中的铁钉生锈了。
学生:试管③中,铁钉在空气与水的交界处铁锈最多。
教师小结、板书:钢铁锈蚀是铁与氧气、水共同作用的结果。
教师提问:为什么海边的铁制品极易生锈?为什么化工设备、化学实验室的铁制品更易发生锈蚀?
展示图2实验装置(试管④中的铁钉5天前用酸溶液浸过,试管⑤中的铁钉5天前放在氯化钠溶液中)。
学生观察后,汇报实验现象。
学生:试管④⑤中的铁钉锈蚀严重。
学生:试管④⑤中产生的铁锈,远远多于试管③。
学生:试管⑤的底部还有少量黑色固体,可能是铁钉中原有的杂质碳。
教师小结、板书:酸、盐的存在会加速钢铁的锈蚀。
教师提问:现在我们再来回答,为什么开头说的那个钢铁容器害死了人?
学生:钢铁生锈会消耗氧气,容器中残存的氯化镁加快了铁生锈,因而造成钢质容器内严重缺氧。
学生:杀害维修工的“凶手”是钢铁锈蚀造成的缺氧环境。
3.逆向思考,探寻金属防护的措施。
教师:钢铁锈蚀危害巨大,全世界每年有将近1/4的钢铁制品由于生锈而报废。
学生讨论:防止钢铁锈蚀的方法有哪些。
教师巡视、参与、释疑,讨论结束师生小结。
教师小结、板书:金属防护的措施:保持洁净干燥、表面覆盖保护膜、制成合金等。
教师:不同的钢铁制品所采取的防锈措施有所不同。展示自行车实物(或投影自行车图片)。
教师提问:自行车上的钢铁零部件采取了哪些防锈措施。
学生回答后,教师小结:支架——喷漆;链条——烤蓝、涂油;车把——镀铬;螺丝钉——镀锌。
4.趋利避害,巧妙利用钢铁锈蚀。
教师:钢铁锈蚀不仅缓慢放热,还消耗氧气,人们巧妙利用这些性质和特征,发明了暖宝宝、铁系脱氧剂等,从而使铁生锈趋利避害、扬长避短。
板书:巧妙利用铁生锈能趋利避害。
教师提问:暖宝宝包装袋上标注的化学成分有哪些?
学生讨论:暖宝宝中铁粉、活性炭、食盐、水等分别具有的作用。教师巡视、参与、点拨,讨论结束学生汇报。
学生:铁粉是发热剂的主体物质,水是铁生锈的必备条件之一。
学生:食盐的存在能加快铁的锈蚀,使暖宝宝在短时间里放出大量的热。
学生:活性炭是一种载体,能使各种成分均匀混合,从而使暖宝宝发热均匀,以免局部过热,烫伤身体。
教师:铁生锈不仅消耗氧气,而且生成固态的铁锈。因此,可以利用铁粉测量空气中氧气的体积分数。那如何设计这个实验装置呢?
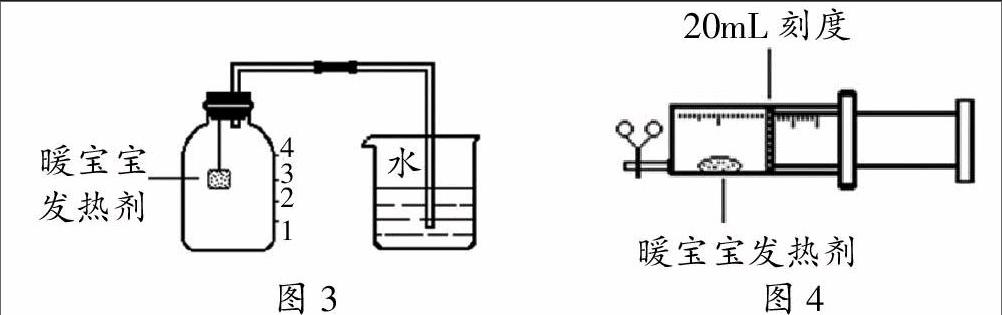
实验:学生回忆燃磷法测量空气中氧气体积分数的实验装置,并根据教师提供的实验用品,设计出如图3和图4所示的实验装置。
分组实验:剪开几袋没有开封的暖宝宝,立即取出足量的发热剂;然后按图3或图4连好装置,进行实验。教师巡视、指导,5-7分钟后学生汇报实验现象。
学生:在图3装置中,刚开始水较快地流入集气瓶里,等一会儿水的流速逐渐减慢。
学生:在图4装置中,刚开始活塞较快地向前推进,几分钟后速度减慢。
教师提问:若实验比较成功,进入集气瓶里的水最终处于哪个刻度?注射器中的活塞最终处于哪个刻度?
学生:图3中,最终进入集气瓶中的水约在刻度1处。
学生:图4中,最终活塞约停留在16mL刻度处。
教师:本实验还需要一段时间才能结束,下面我们利用这段时间来了解铁系食品脱氧剂。
展示:几种不同包装的铁系食品脱氧剂。
学生思考:食品脱氧剂中的铁粉具有怎样的作用。
教师小结:铁粉在食品包装盒里会缓慢生锈使食品缺氧,从而达到保质保鲜的效果。据测定,1g铁的除氧能力为300mL,因此铁系脱氧剂的除氧效果非常好。
教师:如何检验脱氧剂中的铁粉是否完全变质?
实验:学生根据教师提供的实验用品,设计出几种检验方法,如使用稀硫酸或硫酸铜溶液检验,或利用磁铁吸引等。
分组实验:学生剪开几袋用过的铁系食品脱氧剂,进行实验。教师巡视、指导,实验结束后学生汇报。
学生:我们组的脱氧剂中稍微夹杂一点红色粉末,大量的黑色粉末能被磁铁吸引,说明绝大部分铁粉没有变质。
学生:我们组的脱氧剂明显变红,加入稀硫酸且微热,只冒出很少的气泡,说明绝大部分铁粉已经变质。
学生:我们组的脱氧剂几乎没有变红,加入硫酸铜溶液后,出现了大量红色固体,说明大部分铁粉没有变质。
教师:请学生再来观察前面测量空气中氧气体积分数实验的结果。
各小组根据实验现象,推算出氧气的体积分数约为1/6。
测量值偏小,请学生在课后思考造成误差的一些原因。
5.新课结束,交流学习收获。
教师:请同学用最简要的语言,说一说本节课自己最大的收获。
学生:我搞清了钢铁锈蚀的条件,以及影响铁生锈速率的因素。
学生:我明白了钢铁锈蚀也有有利的一面,我们要学会利用化学知识扬长避短。
学生:我知道了,测量空气中氧气的体积分数还可以使用铁粉。
学生:我深深地体会到,解决身边的化学问题要有扎实的基础知识、熟练的实验操作。
教师小结、评价:这节课学生积极参与、大胆发言、及时交流,收获很多。课后,请利用墙报、博客、QQ等形式继续交流探究成果、贡献学习疑惑。
6.布置作业,延伸探究活动。
(1)观察校园里的篮球架、国旗竿、自行车棚、楼层围栏、门锁等采用了哪些防锈措施。
(2)利用铁粉测量空气中氧气的体积分数时,测量值偏小的可能原因有哪些。
(3)设计实验证明,为什么夏天铁制品更容易锈蚀。
(4)给自己的自行车做一次防锈保障。
(作者单位:江苏省徐州市西苑中学)
