酶法辅助超声波法提取类球红细菌辅酶Q10条件优化
2014-07-23李祖明高丽萍惠伯棣白志辉
李祖明,常 平,高丽萍,惠伯棣,白志辉
(1.北京联合大学应用文理学院,北京 100191;2.中国科学院生态环境研究中心,北京 100085)
辅酶Q10是一种脂溶性的类维生素物质,广泛存在于生物体细胞的线粒体上,主要结合在线粒体内膜上,构成呼吸链中的重要递氢体[1-2]。具有清除自由基、维持细胞膜的通透性和提高机体自身免疫力的功能,在临床医药、营养保健品及化妆品等方面具有广阔的应用前景[3-7]。资料显示,目前全球辅酶Q10年消费量高达500多t,而我国年需求量约为60多t[3]。但由于辅酶Q10是微生物发酵所得的细胞内产物,故其提取过程中首先需要进行细胞破壁,因此细胞破碎是提取辅酶Q10的关键步骤之一,直接影响着辅酶Q10的生物活性、收率和成本[1,6]。燕玮婷等[8]采用了4种机械破壁方法对稻曲病菌厚垣孢子进行破碎,结果表明液氮研磨-超声波处理破壁效果最好。杨新辉等[9]采用皂化法辅助超声波优化了三孢布拉霉菌番茄红素的提取条件。超声波作用于含酶溶液时,能产生空化、振荡等作用,并可使酶分子构象及催化部位微环境发生变化,深刻地影响催化活性;人们对超声波影响酶催化过程新的深入认识,将对酶化工领域产生积极的影响,其结果有可能创造一种安全、价廉和靠外力场强化酶催化过程的新方法,给酶法生产工业化带来新的飞跃[10]。在天然生产辅酶Q10的微生物中,类球红细菌(Rhodobacter sphaeroides)被认为是其潜在的良好生产菌[11-13]。类球红细菌属细菌域中紫色细菌群的α亚群,具广泛代谢方式,可在多种生长条件下生长;大量研究文献表明,类球红细菌已成为一种非常有工业化开发潜力的微生物[14-15]。本研究采用酶法辅助超声波法提取类球红细菌辅酶Q10,通过单因素和正交实验得到较优提取条件,为深入研究和开发应用提供科学依据。
1 材料与方法
1.1 材料
1.1.1 菌株 类球红细菌(Rhodobacter sphaeroides)3757菌株,保藏于中国微生物菌种保藏管理委员会普通微生物中心,编号CGMCC NO.3757。
1.1.2 培养基 种子培养基(%):葡萄糖2.0,胰蛋白胨1.0,酵母粉1.0,NaCl 0.5,pH 7.2;固体培养基在种子培养基中添加2.0%琼脂;基础发酵培养基(g/L)[14]:乳酸钠4.0,硫酸铵1.0,磷酸氢二钾0.9,磷酸二氢钾0.6,硫酸镁0.2,无水氯化钙0.075,硫酸亚铁0.012,EDTA 0.02,微量元素溶10 mL,生长因子溶液10 mL,pH 7.2。其中,微量元素溶液配方(g/L):硼酸2.8,硫酸锰1.6,钼酸钠0.76,硫酸锌0.24,硫酸铜0.04;生长因子溶液配方(g/L):维生素B1 1.0,烟酰胺(VPP)1.0,生物素0.016,对氨基苯甲酸1.0。
1.2 方法
1.2.1 菌体制备 将活化的类球红细菌3757接种于装有种子培养基的三角瓶中,于32℃、180 r/min培养24 h,得液体种子。按5%接种量将液体种子接种到盛有基础液体培养基的三角瓶中,于32℃、180 r/min培养24 h,6 000 r/min离心10 min,用蒸馏水洗涤菌体2次备用。
1.2.2 超声波处理初始条件 用甲醇∶氯仿(1∶2)溶液按料液比1∶10将菌体制成菌悬液,超声波振幅20%,辐射时间间歇时间1 min/1 min,超声波总时间(包括辐射和间歇时间)6 min。超声波破处理后静置30 min,6 000 r/min离心20 min,上清液即为辅酶Q10提取液。
1.2.3 酶法辅助超声波法初始条件 用pH 7.2的磷酸缓冲液按料液比1∶10将菌体制成菌悬液。将溶菌酶用蒸瘤水配成5 mg/mL的酶液,5 mL菌悬液中加入300 μL酶液,酶解温度37℃,酶解时间2 h。酶处理后,6 000 r/min离心20 min,收集菌体;然后采用超声波法较优条件处理菌体。
1.2.4 辅酶Q10测定 采用紫外分光光度计测定辅酶Q10[1,16]。取辅酶Q10标准品,用甲醇∶氯仿(1∶2)溶液配成不同浓度的标准溶液,于275 nm测定其吸光值,绘制标准曲线。然后于275 nm测定样品的吸光值,对照标准曲线计算出样品中辅酶Q10的提取率。样品中辅酶Q10提取率计算公式:X=C×f×1 000/1 000;式中:X为样品中辅酶Q10的提取率(mg/L);C为从标准曲线查得的辅酶Q10浓度(μg/mL);f为样液稀释倍数。
1.2.5 单因素实验 在超声波法初始条件下,先后改变超声振幅、超声波总时间(工作和间歇时间)、料液比、超声工作/间隔时间进行单因素实验,分别考察其对辅酶Q10提取率的影响。在酶法辅助超声波法初始条件下,先后改变酶添加量、pH、酶解温度和酶解时间进行单因素实验,分别考察其对辅酶Q10提取率的影响。
1.2.6 正交实验 在单因素实验基础上,选择合适的因素和水平,进行正交实验,找出最优的因素和水平,得到较高的辅酶Q10提取率。
1.2.7 对比实验 将优化前超声波法初始提取条件下辅酶Q10的提取率同酶法辅助超声波法优化后提取条件进行比较,考察优化提取条件前后辅酶Q10提取率的变化。
2 结果与分析
2.1 振幅对辅酶Q10提取率的影响
在超声波法初始条件下,改变振幅分别为20%、30%、40%和50%,以最高提取率为100%,考察其对辅酶Q10提取率的影响,结果见图1。可见,当振幅为30%时,辅酶Q10提取率最高。
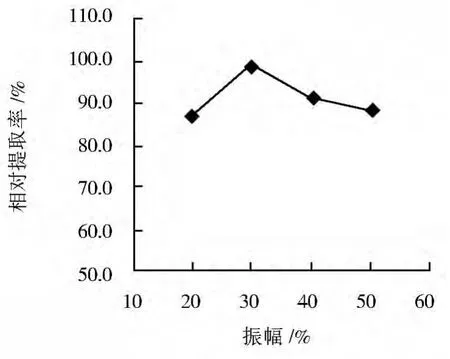
图1 超声波振幅对辅酶Q10相对提取率的影响Fig.1 Effect of vibration amplitude of ultrasonic treatment on relative extraction rate of coenzyme Q10
2.2 超声波总时间对辅酶Q10提取率的影响
在超声波法初始条件下,改变超声波总时间分别为2、6、10、14和18 min,以最高提取率为100%,考察其对辅酶Q10提取率的影响,结果见图2。随超声波总时间的增加,辅酶Q10提取率逐渐上升,当超声波总时间为10 min时,辅酶Q10提取率最高;其后提取率反而降低。这主要是由于破碎时间过长延长了辅酶Q10与氧气、光的接触时间,导致辅酶Q10降解。并且由于作用时间过长使细胞过于粉碎,导致大量蛋白和其他杂质被提取出来,增加了后续提取分离的难度,影响产品的纯度[6]。可见,较优超声波总时间为10 min。
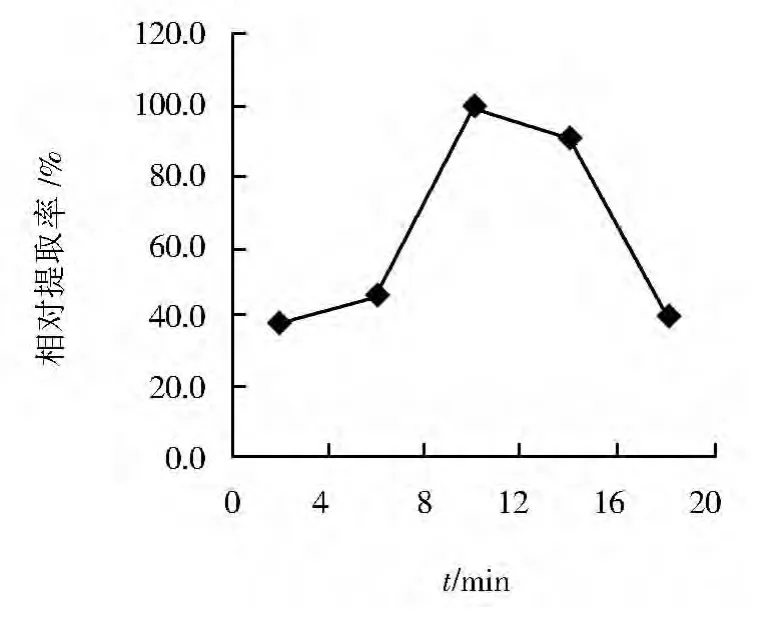
图2 超声波总时间对辅酶Q10相对提取率的影响Fig.2 Effect of total time of ultrasonic treatment on relative extraction rate of coenzyme Q10
2.3 料液比对辅酶Q10提取率的影响
在超声波法初始条件下,改变料液比分别为1∶5、1∶10、1∶15、1∶20、1∶25、1∶30和1∶35,以最高提取率为100%,考察其对辅酶Q10提取率的影响,结果见图3。随提取剂用量的增大,细胞浓度降低,有利于细胞破碎,这是因为细胞浓度越高,液体的粘稠度越大,不利于空化泡的形成及其膨胀和爆炸,导致破碎效果较差。但超过最适料液比1∶20后,当提取剂用量再继续增大时,破损率降低;这可能是由于提取剂用量越大,超声波在提取剂中传递的损失也就越大,破碎效果相应也就越差[6]。可见,较优料液比为1∶20。
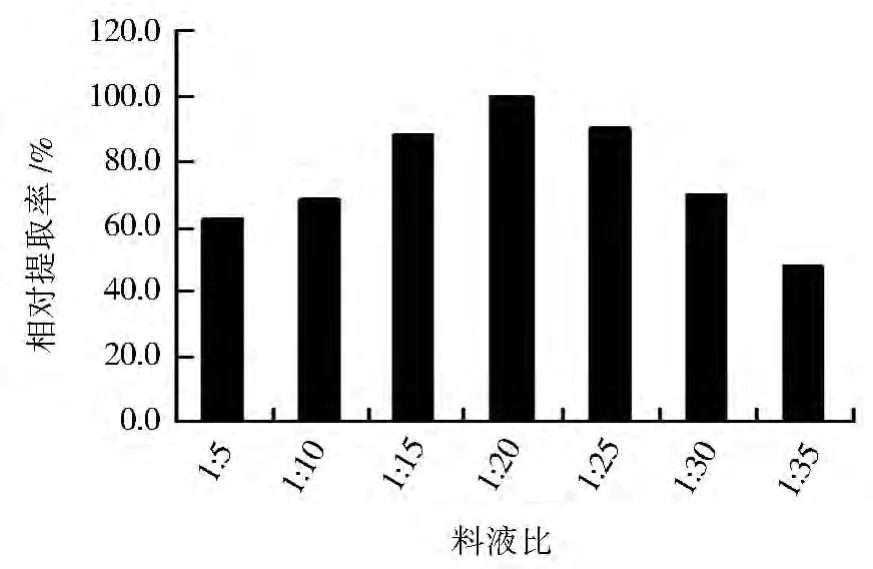
图3 料液比对辅酶Q10相对提取率的影响Fig.3 Effect of ratio of material to liquid on relative extraction rate of coenzyme Q10
2.4 超声波工作/间隔时间对辅酶Q10提取率的影响
超声波法初始条件下,改变工作/间隔时间分别为3 min/1 min、2 min/1 min、1 min/1 min、1 min/2 min和 1 min/3 min,以最高提取率为100%,考察超声波工作/间隔时间对辅酶Q10提取率的影响,结果见图4。超声波通过空化效应破碎细胞的过程实际就是空化泡形成、振动、膨胀、压缩和崩溃闭合的过程,该过程需要一段短暂的时间来完成,短时多次的工作方式能使超声波产生的空化泡,有足够的时间和更多机会完成膨胀和爆炸过程,因此有利于细胞的破碎[6]。可见,当工作/间隔时间为1 min/1 min时,辅酶Q10提取率最高。
2.5 酶添加量对辅酶Q10提取率的影响
在酶法辅助超声波法初始条件下,改变溶菌酶添加量分别为100、300、500、700和900 μL,以最高提取率为100%,考察酶添加量对辅酶Q10提取率的影响,结果见图5。当溶菌酶添加量为300 μL时,辅酶Q10提取率最高,其后随酶添加量的进一步增加,辅酶Q10提取率呈下降趋势。可见,较优的酶添加量为300 μL。
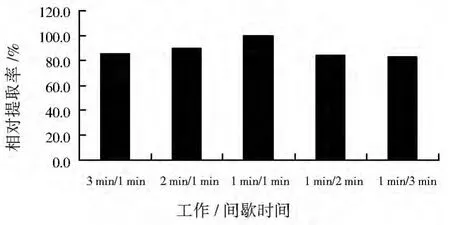
图4 超声波工作/间隔时间对辅酶Q10相对提取率的影响Fig.4 Effect of work/rest time of ultrasonic treatment on relative extraction rate of coenzyme Q10
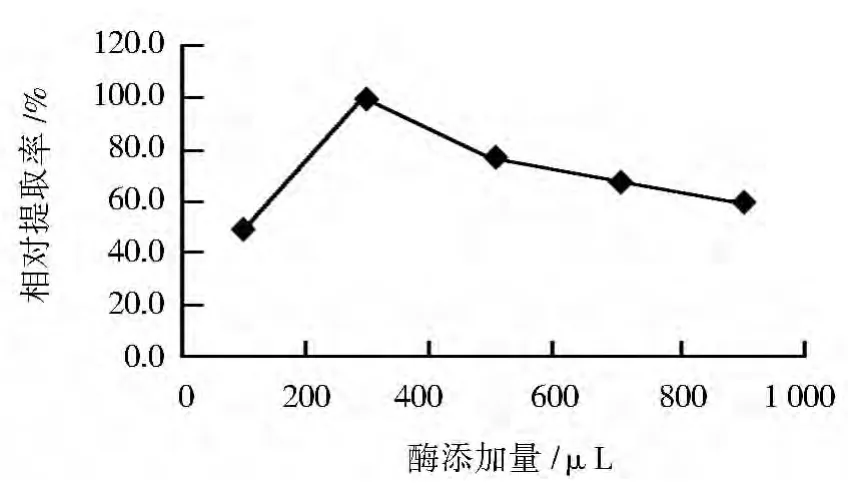
图5 酶添加量对辅酶Q10相对提取率的影响Fig.5 Effect of amount of enzyme on relative extraction rate of coenzyme Q10
2.6 酶解pH对辅酶Q10提取率的影响
在酶法辅助超声波法初始条件下,改变pH分别为6.2、6.7、7.2、7.7和8.2,以最高提取率为100%,考察pH对辅酶Q10提取率的影响,结果见图6。当pH为7.2时,辅酶Q10提取率最高。可见,最适酶解pH为7.2。
2.7 酶解温度对辅酶Q10提取率的影响
在酶法辅助超声波法初始条件下,改变酶解温度分别为27、32、37、42和47℃,以最高提取率为100%,考察酶解温度对辅酶Q10提取率的影响,结果见图7。随酶解温度升高,辅酶Q10提取率逐渐提高,当酶解温度37℃时,辅酶Q10提取率最高,其后又下降。可见最适酶解温度为37℃。
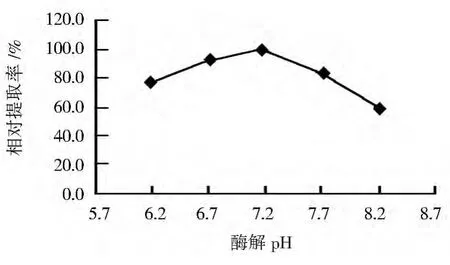
图6 酶解pH对辅酶Q10相对提取率的影响Fig.6 Effect of pH of zymoIysis on relative extraction rate of coenzyme Q10
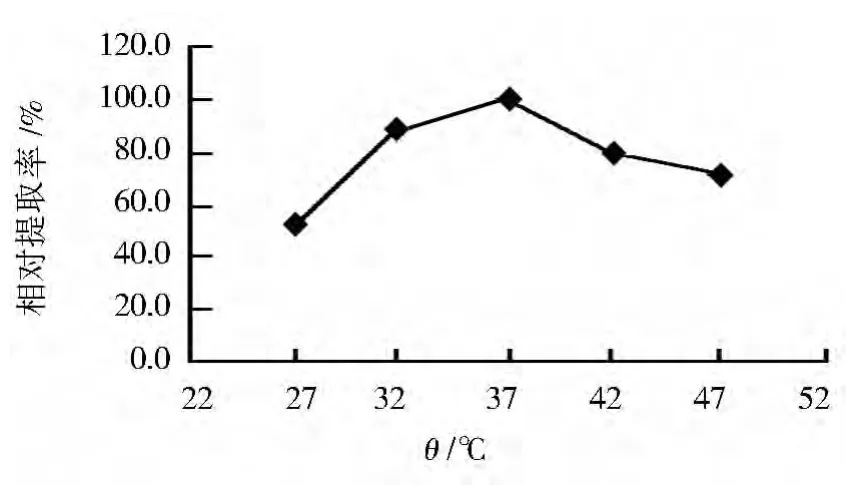
图7 酶解温度对辅酶Q10相对提取率的影响Fig.7 Effect of temperature of zymoIysis on relative extraction rate of coenzyme Q10
2.8 酶解时间对辅酶Q10提取率的影响
在酶法辅助超声波法初始条件下,改变酶解时间分别为0.5、1.0、1.5、2.0和2.5 h,以最高提取率为100%,研究其对辅酶Q10提取率的影响,结果见图8。随酶解时间延长,辅酶Q10提取率逐渐增大,当酶解时间为2 h时,辅酶Q10提取率最高。可见,较优的酶解时间为2 h。
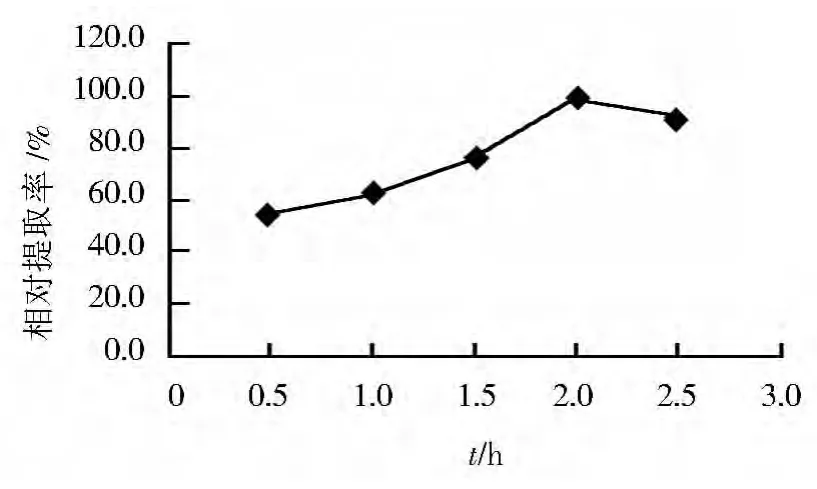
图8 酶解时间对辅酶Q10相对提取率的影响Fig.8 Effect of time of zymoIysis on relative extraction rate of coenzyme Q10
2.9 正交实验
单因素试验时发现,超声波总时间、料液比、溶菌酶添加量和酶解时间对辅酶Q10提取率的影响较显著。超声波振幅和超声波工作/间隔时间对辅酶Q10提取率的影响不显著。最适酶解pH为7.2,最适酶解温度37℃。因此采用超声波总时间、料液比、溶菌酶添加量和酶解时间进行L9(34)正交试验,因素水平见表1。实验结果与分析见表2。
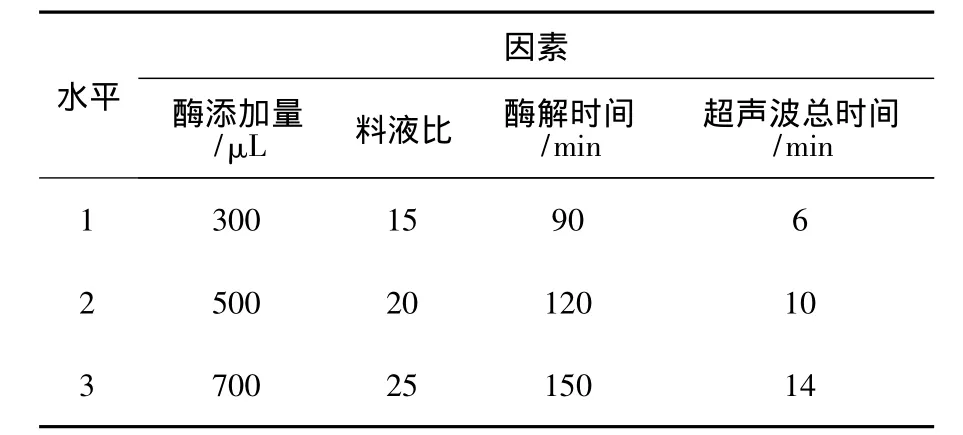
表1 正交试验因素水平表Table1 Factors and levels of orthogonal experiment
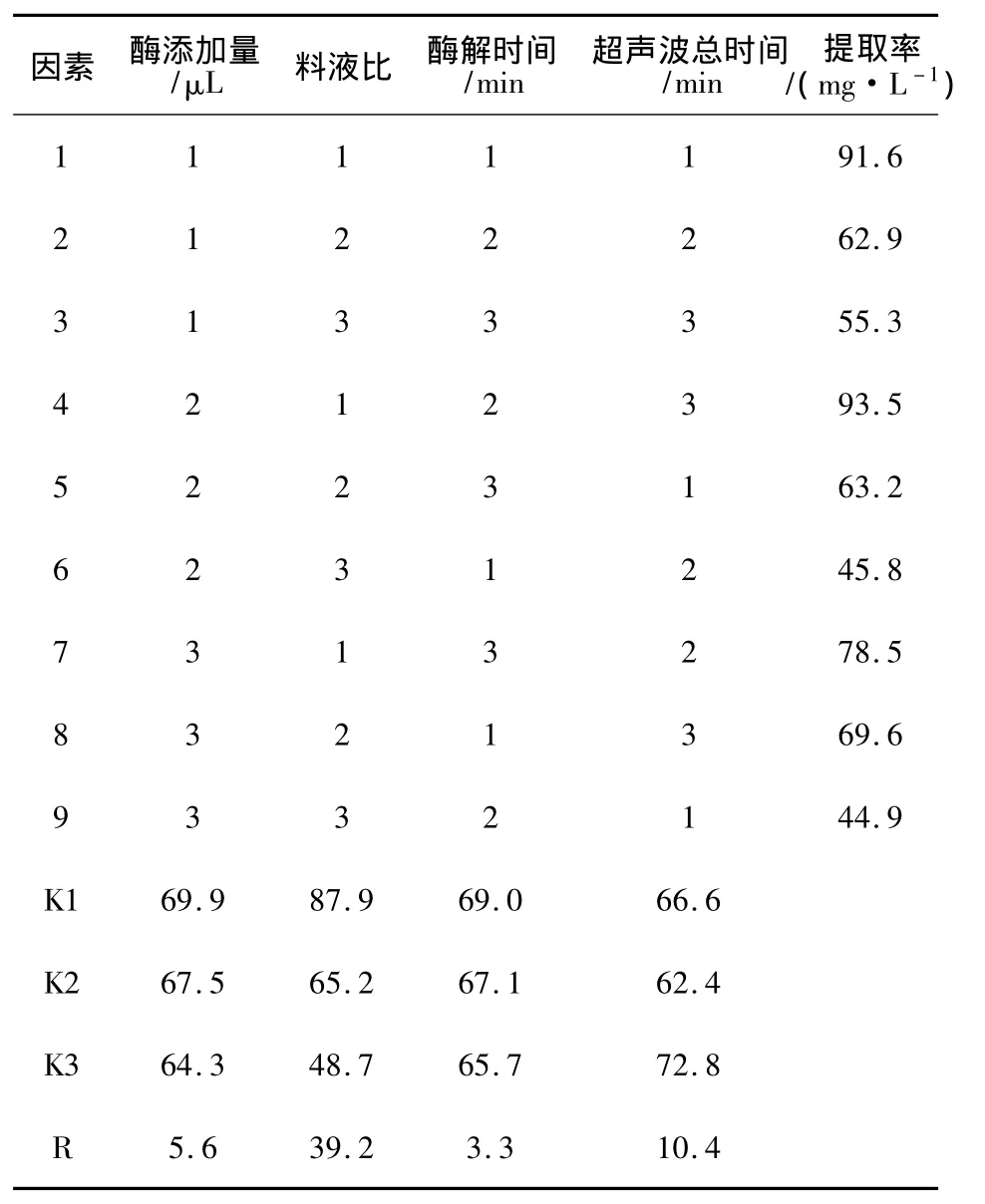
表2 正交实验结果与分析Table2 Results and analysis of orthogonal experiment
从表2可以看出,对辅酶Q10提取率影响因素主次顺序为料液比>超声波总时间>酶添加量>酶解时间。结合单因素实验结果,得到辅酶Q10较优提取条件:超声波总时间14 min,超声波振幅30%,超声波工作/间歇时间1 min/1 min,料液比1∶15,酶添加量300 μL,酶解pH 7.2,酶解温度37℃,酶解时间90 min。
2.10 对比实验
分别在优化前超声波法初始条件和酶法辅助超声波法优化后条件下从类球红细菌中提取辅酶Q10。结果表明优化前辅酶Q10提取率为51.9 mg/L,优化后辅酶Q10提取率为99.6 mg/L。可见,优化后的提取率比优化前提高了91.9%。
3 结论
本研究采用单因素和正交实验优化了酶法辅助超声波法提取类球红细菌辅酶Q10的提取条件,正交实验结果显示各因素影响辅酶Q10提取率的顺序为料液比>超声波总时间>酶添加量>酶解时间。综合单因素和正交实验结果,得到辅酶Q10较优的提取条件:超声波总时间14 min,超声波振幅30%,超声波工作/间歇时间1 min/1 min,料液比1∶15,酶添加量300 μL,酶解pH 7.2,酶解温度37℃,酶解时间90 min。优化前辅酶Q10提取率为51.9 mg/L,优化后辅酶Q10提取率为99.6 mg/L。优化后辅酶Q10提取率比优化前提高了91.9%。这为类球红细菌保健食品的研究开发及产业化生产提供了科学依据。
[1]陶志杰,曹迪,王改玲,等.超声波法辅助提取花生中辅酶Q10的工艺优化[J].食品科学,2012,33(18):53-56.
[2]朱俊丰,郑方亮,艾海新,等.微波结合紫外诱变选育辅酶Q10高产菌株[J].微生物学杂志,2010,30(2):57-62.
[3]王改玲,宋瑞雯,陶志杰,等.花生中辅酶Q10的提取工艺及含量测定[J].食品与发酵工业,2012,38(5):236-239.
[4]田宝静,李剑,聂立影,等.土壤杆菌中辅酶Q10的提取工艺[J].食品与生物技术学报,2009,28(6):858-861.
[5]朱俊丰,季世坤,郑方亮,等.辅酶Q10酸热破碎法提取工艺条件的研究[J].辽宁大学学报(自然科学版),2010,37(1):67-70.
[6]李聚海,岳田利,袁亚宏.辅酶Q10超声波破碎法提取工艺条件研究[J].西北农林科技大学学报(自然科学版),2007,35(5):207-211.
[7]Ha SJ,Kim SY,Seo JH,et al.Ca2+increases the specific coenzyme Q10 content inAgrobacterium tumefaciens[J].Biopro-cess Biosyst Eng,2009,32(5):697-700.
[8]燕玮婷,刘二明,邓林伟,等.稻曲病菌厚垣孢子不同破壁方法的比较[J].微生物学杂志,2010,30(2):14-17.
[9]杨新辉,孟宪军,宋宇宁,等.三孢布拉霉发酵生产番茄红素的提取工艺及残留溶剂去除[J].微生物学杂志,2010,30(2):46-50.
[10]郭诗静,黄卓烈,初志战,等.超声波对猪胰脂肪酶催化活性影响的机理研究[J].生物技术通报,2007,(4):155-159.
[11]Yen HW,Feng CY,Kang JL.Cultivation ofRhodobacter sphaeroidesin the Stirred Bioreactor with Different Feeding Strategies for CoQ10[J].Production.Appl Biochem Biotechnol,2010,160(5):1441-1449.
[12]Yen HW,Chiu CH.The influences of aerobic-dark and anaerobic-light cultivation on CoQ10 production byRhodobacter sphaeroidesin the submerged fermenter[J].Enzyme and Microbial Technology,2007,41(5):600-604.
[13]Kien NB,Kong IS,Lee MG,et al.Coenzyme Q10 production in a 150-l reactor by a mutant strain ofRhodobacter sphaeroides[J].J Ind Microbiol Biotechnol,2010,37(5):521-529.
[14]赵凯,于影,姜丹,等.1株类球红细菌及其降解敌敌畏的特性[J].环境科学,2009,30(4):1119-1204.
[15]Gu ZX,Chen DM,Han YB,et al.Optimization of carotenoids extraction fromRhodobacter sphaeroides[J].LWT,2008,41(6):1082-1088.
[16]王根华,钱和,肖刚.发酵菌体中辅酶Q10的提取及其测定方法[J].无锡轻工大学学报,2003,22(2):59-62.
