HCMV感染对恶性胶质瘤U87细胞增殖及ATF5表达的影响
2014-07-23王桐梅钱冬萌
王桐梅,钱冬萌,胡 明,李 玲,张 丽,陈 豪,杨 瑞,王 斌
(青岛大学医学院病原生物学教研室,山东青岛 266071)
人巨细胞病毒(human cytomegalovirus,HCMV)属疱疹病毒β亚科,是人类疱疹病毒中基因组最大的一种病毒[1]。研究发现,HCMV在胶质瘤中有很高的感染率,且HCMV可诱导细胞恶性转化和关键细胞通路功能障碍[2]。但HCMV在胶质瘤发生、发展中具体的分子机制还有待进一步探讨。有研究者提出肿瘤调节作用以解释HCMV感染在肿瘤细胞的发生、发展中的作用,肿瘤调节作用即HCMV能够调控细胞内信号通路和转录因子等调节肿瘤的恶性行为[3]。转录激活因子5(Activating transcription factor 5,ATF5)是一个在恶性神经胶质瘤中高表达的转录调控因子,在调节细胞增殖、分化和凋亡方面有广泛的作用[4]。研究发现,HCMV即刻早期基因和ATF5都能够与核转录因子连接器相互结合发挥作用[5]。因此推测:HCMV感染促神经胶质瘤增殖可能与ATF5信号通路有关。本研究拟探讨HCMV感染对神经胶质瘤细胞U87中细胞增殖及ATF5通路的影响,为进一步阐明HCMV感染在恶性神经胶质瘤的发生、发展中的相关分子机制提供理论基础。
1 材料与方法
1.1 材料
1.1.1 病毒与细胞 HCMV AD169毒株由法国巴斯德研究所赠送,按常规方法传代,滴定(108PFU/mL)。人胚肺成纤维细胞(HELF)由本室保藏,用于HCMV病毒扩增。神经胶质瘤细胞U87购自上海细胞库,按常规方法培养、传代,第5代后细胞用于本实验。ATF5的siRNA重组慢病毒(LV-ATF5-RNAi)由上海吉凯基因化学技术有限公司提供。ATF5的 shRNA靶序列:LV-ATF5-RNAi(8842-1)5'-GCGAGATCCAGTACGTCAA-3',LV-ATF5-RNAi(8843-1)5'-TCTTGGATACTCTGGACTT-3',LV-ATF5-RNAi(8844-1)5'-TGGAACAGATGGAAGACTT-3'。
1.1.2 主要试剂与仪器 胎牛血清(FBS,Hyclone)、MEM(Hyclone)、噻唑蓝(MTT,Sigma)、二甲基亚砜(DMSO,Sigma)、SUNRISE酶标仪(瑞士)、Trizol(TaKaRa)、Go TaqⓇqPCR Master Mix(Promega)、Anti-Cytomegalovirus IE(ViroStat)、Anti-ATF5 antibody(abcom)、HRP山羊抗小鼠IgG及山羊抗兔IgG、BIO RAD Real-time PCR仪(MyiQTM2 Optics Module)、蛋白凝胶电泳系统(韦伯)。
1.2 方法
1.2.1 MTT法检测细胞增殖活性 取对数生长期的U87细胞接种于96孔培养板(密度:5×103cell/孔),每孔100 μL。分别设立HCMV感染组、正常细胞组及调零组,各组5个复孔。细胞贴壁后,更换2%MEM,孵育2 h后加入HCMV(MOI=5),病毒感染0、12、24、48 h后,弃原培养液,每孔分别加入10 μL 5 g/L MTT(3-(4,5)-2-噻唑-(2,5)-二苯基溴化四氮唑蓝)和90 μL MEM,孵育4 h后弃上清,每孔加入150 μL二甲基亚砜(DMSO),置SUNRISE酶标仪上,振荡10 min后,测495 nm波长下的吸光度A值。计算细胞增殖率,表示细胞活性。细胞增殖率=(感染细胞A值-调零孔A值)/(对照组细胞A值-调零孔A值)。
1.2.2 荧光定量PCR检测HCMV感染U87细胞株ATF5 mRNA的表达水平变化 Trizol法提取HCMV 感染U87 0、12、24、48 h 细胞RNA,紫外分光光度计定量。反转录反应按PrimeSCript RT reagent Kit With gDNA Eraser说明书操作,产物cDNA置于-20℃。Real-time PCR采用β-actin作为内参基因,内参基因与目的基因各设3个平行反应管。引物由上海生工生物有限公司合成,序列见表1。反应体系为20 μL,其中10 μL SYBR green mixture,上下游引物各1 μL,cDNA 2 μL,加水至20 μL。95℃ 3 min,95℃ 10 s,55℃ 30 s,循环40次。55℃,30 s时读取荧光值。

表1 本研究中Real-time PCR所用引物及产物长度Table1 Sequence of the Primers and length of products
1.2.3 蛋白提取及 Western-blotting HCMV感染神经胶质瘤细胞0、12、24、48 h后,用预冷的PBS洗3遍,加入400 μL 含有1 μmol/L PMSF 的细胞裂解液,冰浴30 min后,12 000 r/min 4℃离心10 min,上清液为总蛋白,检测该组总蛋白中ie,ATF5蛋白表达水平变化。每上样孔上样30 μg总蛋白,进行SDS-PAGE分析。湿转法将蛋白转至PVDF膜上,5%脱脂奶粉室温封闭2 h,分别按要求稀释后加入β-actin,ie和ATF5抗体4℃孵育过夜。用TBST洗膜3次,每次10 min。再加入HRP-标记的二抗。室温孵育2 h,TBST洗膜3次,每次10 min,ECL发光。以β-actin作为内参,Quantity One软件进行灰度分析,计算目的蛋白相对表达含量。
1.2.4 慢病毒(LV-ATF5-RNAi)感染神经胶质瘤细胞条件优化及干扰靶点的选择 取生长良好、对数生长期的U87细胞,接种于96孔板,每孔5 000个细胞,待细胞汇合度达30%~50%时,分别在正常培养液、正常培养液+Polybrene、正常培养液+EIS及正常培养液+EIS+Polybrene四种条件下感染慢病毒,每种条件设4个感染复数(MOI值为10、20、30、40),感染12 h后观察细胞状态,更换正常培养液,并于感染后48、72、96 h于荧光显微镜下观察荧光蛋白的表达以确定最佳慢病毒感染条件及感染复数。在最佳慢病毒感染条件及感染复数条件下,分别将对照慢病毒Li-CON055及含靶向干扰ATF5的小干扰RNA质粒的慢病毒LV-ATF5-RNAi(8842)、LV-ATF5-RNAi(8843)和LV-ATF5-RNAi(8844)感染U87细胞,待稳定转染后,提取蛋白,Western-blot检测细胞内ATF5的表达水平。
1.2.5 统计学分析 采用SPSS 17.0统计软件包进行数据分析,数据以±s表示,多组间均数比较采用单因素方差分析,两组间比较采用独立样本t检验。P<0.05差异有统计学意义。
2 结果与分析
2.1 HCMV感染对U87细胞增殖的影响
如图1所示,与正常对照组细胞比较,HCMV感染0、12、24、48 h后,细胞增殖明显。P<0.05,差异有统计学意义。
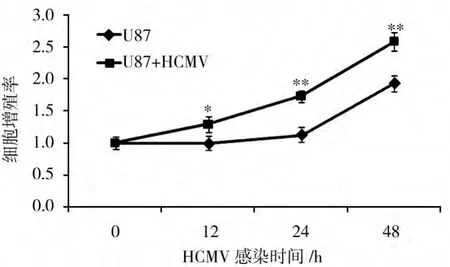
图1 MTT法检测HCMV感染对U87细胞增殖的影响Fig.1 Effect of HCMV infection on U87 cells proliferation
2.2 HCMV感染对神经胶质瘤U87细胞ATF5 mRNA表达的影响
如图2所示,IE2为HCMV进入宿主细胞后最先表达的基因,是病毒复制和其他基因表达所必需的。同时,在调控宿主细胞某些基因的表达方面发挥重要作用。Real-time PCR检测结果表明,HCMV感染0、12、24、48 h,随着IE2表达的升高,U87细胞中ATF5表达水平也升高。表明U87细胞抗凋亡能力增强。

图2 Real-time PCR检测HCMV感染U87细胞后IE2、ATF5 mRNA表达水平Fig.2 Real-time PCR analyses expression levels of IE2,ATF5 mRNA in U87 cells by HCMV infection
2.3 HCMV感染对神经胶质瘤U87细胞ATF5蛋白表达水平的影响
HCMV 感染U87 12、24、48 h(图3、表2),随着ie蛋白表达水平的升高,ATF5蛋白表达水平升高有统计学意义(P<0.05),与Real-time PCR结果相一致。
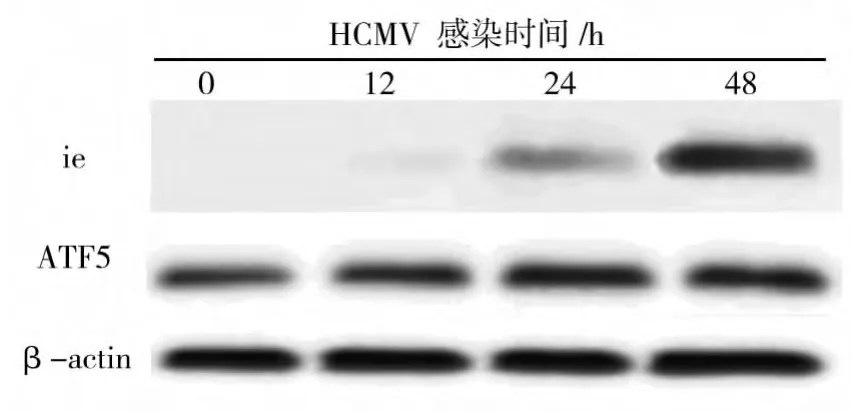
图3 Western-blot检测HCMV感染U87后,细胞内ie,ATF5蛋白表达水平Fig.3 Western-blot analyzes the protein level of ie,ATF5 in HCMV-infected U87 cells
表2 HCMV感染后,U87细胞内 ie、ATF5蛋白与β-actin灰度比值变化±s)Table2 The relative density of protein bands(Figure3)for ie,ATF5 was calculated using β-actin as a loading control

表2 HCMV感染后,U87细胞内 ie、ATF5蛋白与β-actin灰度比值变化±s)Table2 The relative density of protein bands(Figure3)for ie,ATF5 was calculated using β-actin as a loading control
注:与0 h未感染HCMV的U87细胞相比,*P<0.05
HCMV感染时间/h蛋白012 24 48 ie 0 0.20±0.04 0.61±0.04 0.94±0.06 ATF5 0.67±0.04 0.90±0.09 0.92±0.07 1.10±0.06*
2.4 慢病毒感染效率的检测
如图4所示,慢病毒感染U87,72 h后在荧光显微镜下观察,可见细胞内稳定表达的红色荧光蛋白,以每高倍镜下荧光细胞数/同一视野细胞计数计算感染效率。在MOI=40的条件下,慢病毒感染U87细胞效率达95%以上。

图4 慢病毒感染U87细胞72 h后的光镜(A)和荧光镜(B)(40×)Fig.4 The figures photographed by light microscope(A)and fluorescence microscope(B)72 h after the Lentivirus infected the U87 cells(40×)
2.5 ATF5沉默效率的检测
如图5、表3所示,Western-blot结果显示,LVATF5-RNAi(8842)组U87细胞ATF5表达水平有明显减低,而LiCON055感染组与U87组ATF5表达水平差异无统计学意义。提示,慢病毒 LVATF5-RNAi(8842)对U87细胞内源性ATF5表达水平具有抑制作用。因此,将LV-ATF5-RNAi(8842)感染组用于下一步实验。
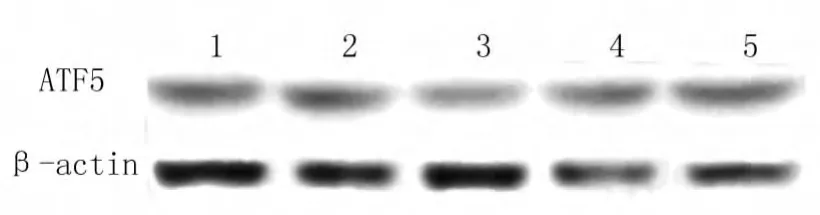
图5 Western-blot检测慢病毒沉默ATF5效率Fig.5 Western-blot analyzes the efficiency of lentiviral silencing ATF5
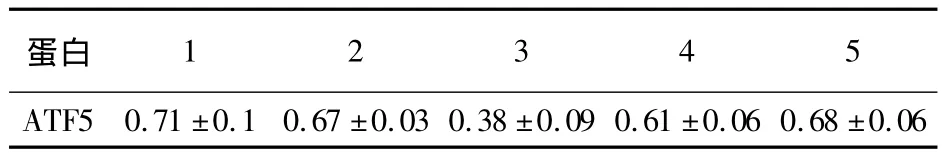
表3 慢病毒感染U87细胞内ATF5蛋白与 β-actin比值灰度分析Table3 The relative density of protein bands(Figure 5)for ATF5 to β-actin in the lentiviral infected U87 cells
2.6 HCMV感染对沉默ATF5 U87细胞增殖的影响
如图6所示,MTT结果显示,与对照组比较,HCMV感染对沉默ATF5 U87细胞增殖有显著的抑制作用(P<0.05)。

图6 HCMV对沉默ATF5 U87增殖的影响Fig.6 Cell viability analysis of siATF5 U87 cells by HCMV
3 讨论
研究表明,HCMV感染与恶性神经胶质瘤的发生发展有密切的关系[6]。Cobbs等[7]首次证明了HCMV核酸和蛋白存在于不同恶性度(Ⅱ~Ⅳ)的神经胶质瘤中,且在该肿瘤中高表达。HCMV能够编码多种病毒基因,其基因产物参与调控宿主细胞内信号通路、转录因子以及肿瘤抑制蛋白,发挥其肿瘤调节作用[8]。HCMV编码的即刻早期蛋白(ie)能够与宿主细胞内多种转录因子SP1及CREB等相互作用形成复合物,从而调控下游基因的转录激活[9]。
转录激活因子5(ATF5)是神经胶质瘤的一个标志性转录因子,与细胞增殖、发育有密切关系。ATF5隶属转录因子ATF/CREB家族成员之一,具有亮氨酸拉链(bZIP)的特征结构域,能与细胞内多种蛋白分子相互作用,形成复合物,共同调节基因的转录,从而参与调控细胞的增殖与凋亡[10]。目前,有关ATF5信号通路在HCMV感染诱导神经胶质瘤细胞增殖中的作用,文献少见报道。
本研究发现,神经胶质瘤细胞U87感染HCMV后,细胞增殖明显。提示,HCMV感染能够促进神经胶质瘤细胞U87的增殖。Real-time PCR及Western-blot结果显示,HCMV感染48 h后,U87细胞ATF5表达水平明显升高(P<0.05),显示细胞抗凋亡能力增强。此结果表明,HCMV感染可能是通过调控ATF5信号通路,进而影响细胞的增殖能力。
为进一步证明ATF5在HCMV感染中可能的作用,构建了靶向ATF5 siRNA慢病毒载体,其感染效率高、维持时间久,能够长期抑制目的基因的表达。沉默U87细胞内源性ATF5后,观察HCMV感染对siATF5 U87细胞的影响。结果显示,沉默U87细胞内源性ATF5后,可降低U87细胞增殖活性,与JM Angelastro等[11]的研究相符。与对照组比较,HCMV感染沉默ATF5的U87细胞,细胞增殖受到明显抑制。结果表明,切断ATF5信号通路,能够在一定程度上抑制HCMV感染对胶质瘤细胞的促增殖作用。
综上所述,本研究阐明HCMV感染能够通过调控ATF5信号通路参与调节肿瘤细胞恶性行为。HCMV感染能够上调ATF5表达水平,进而调控下游抗凋亡基因,促进细胞增殖。因此,预防HCMV感染或者下调细胞内源性ATF5表达,可作为治疗胶质瘤新的治疗靶点。本研究仅对HCMV感染增加神经胶质瘤恶性表型作了初步研究,其具体分子机制还有待进一步研究。
[1]金晶,蔡亦红,类延花,等.HCMV pp65截短蛋白原核表达条件优化[J].微生物学杂志,2005,25(3):28-32.
[2]曾而明,罗达亚,王红梅,等.胶质瘤组织中人类巨细胞病毒的感染研究[J].南昌大学学报(医学版),2010,50(6):1-3.
[3]Barami K.Oncomodulatory mechanisms of human cytomegalovirus in gliomas[J].J Clin Neurosci,2010,17(7):819-823.
[4]Sheng Z,Li L,Zhu L J,et al.A genome-wide RNA interference screen reveals an essential CREB3L2-ATF5-MCL1 survival pathway in malignant glioma with therapeutic implications[J].Nat Med,2010,16(6):671-677.
[5]Liu D X,Qian D,Wang B,et al.p300-Dependent ATF5 acetylation is essential for Egr-1 gene activation and cell proliferation and survival[J].Mol Cell Biol,2011,31(18):3906-3916.
[6]Dziurzynski K,Chang S M,Heimberger A B,et al.Consensus on the role of human cytomegalovirus in glioblastoma[J].Neuro Oncol,2012,14(3):246-255.
[7]Charles S.Cobb,Lualhati Harkins,Minu Samata,et al.Human Cytomegalovirus Infection and Expression in Human malignant Glioma[J].Advances in Brief,2012,6(15):3347-3350.
[8]汪晓婷,王明丽.人巨细胞病毒相关肿瘤调节作用的研究新进展[J].微生物与感染,2011,6(03):165-168.
[9]Rodems S M,Clark C L,Spector D H.Separate DNA elements containing ATF/CREB and IE86 binding sites differentially regulate the human cytomegalovirus UL112-113 promoter at early and late times in the infection[J].J Virol,1998,72(4):2697-2707.
[10]Sheng Z,Evans S K,Green M R.An activating transcription factor 5-mediated survival pathway as a target for cancer therapy[J].Oncotarget,2010,1(6):457-460.
[11]Angelastro J M,Canoll P D,Kuo J,et al.Selective destruction of glioblastoma cells by interference with the activity or expression of ATF5[J].Oncogene,2006,25(6):907-916.
