AMPK在小鼠运动性和病理性心肌肥大能量代谢中的作用
2014-07-19胡玉龙王永梅李宁川
胡玉龙,徐 慧,王永梅,昝 销,李宁川
AMPK在小鼠运动性和病理性心肌肥大能量代谢中的作用
胡玉龙1,徐 慧1,王永梅2,昝 销1,李宁川1
目的:探讨运动性和病理性心肌肥大模型在能量代谢方面的差异及其调控因素。方法:采用游泳训练构建运动性心肌肥大模型,用主动脉弓缩窄术(TAC)构建病理性心肌肥大模型。12周龄雄性C57Bl/6J小鼠随机分为4组:对照组(Control),运动组(Swim),假手术组(Sham),手术组(TAC),每组10只。实验结束,采用二维超声心动图检测小鼠心室壁肥厚程度和心功能;对心肌组织切片进行Masson染色检测心肌组织纤维化程度;比色法检测心肌组织中游离脂肪酸(FFA)和葡萄糖(Glu)含量;应用实时定量PCR(RT-PCR)检测心肌组织AMPK和PPAR-α mRNA的水平。结果:1)游泳运动和TAC手术两种方法均能使小鼠产生明显的心肌肥大。与相应的对照组相比,两种肥大模型的心脏室间隔厚度(IVS)和左室后壁厚度(LVPW)之和均明显升高(P<0.05),心重/体重比值,左心室/胫骨长度比值与相应的对照组相比也都明显增加(P<0.05);TAC组ANP、BNP的mRNA水平比Swim组明显升高(P<0.01),心肌组织纤维化程度比Swim组明显加重。2)与Sham组相比,TAC组心肌中FFA含量明显增高(P<0.05),且显著高于Swim组(P<0.01);而Swim组心肌的Glu含量比Control组明显升高(P<0.05),且高于TAC组(P<0.05)。3)与相应的对照组相比,Swim组AMPK mRNA表达水平明显升高(P<0.05),且显著高于TAC组(P<0.01);TAC组PPAR-α mRNA表达水平明显降低(P<0.05),也明显低于Swim组(P<0.05)。结论:运动能改善肥大心肌的能量代谢,减小“能量代谢胚胎型再演”的程度,其机制可能是通过激活AMPK的表达来进行调控的。
心肌肥大;运动;能量代谢;AMPK;PPAR-α
心肌肥大是心脏对急慢性血流动力超负荷的一种代偿反应,高血压和长期运动训练都能引起不同程度的心肌肥大[19]。病理性心肌肥大是导致心血管疾病发生率和死亡率增高的独立危险因子,是心力衰竭的前驱病变,而运动性心肌肥大则可以保持心脏正常的泵血功能数年至数十年。寻找二者发展和转归的差异,对保护心功能,防止病理性心肌肥大向心衰发展具有重要的意义。病理性心肌肥大时心肌组织缺氧,能量代谢出现“胚胎型转换”[2],即最大限度地节约氧消耗,以葡萄糖氧化取代脂肪酸氧化,心肌细胞得不到充分的能量供应,还可能因为脂肪酸堆积导致氧化应激等后续损伤。而运动导致的生理性心肌肥大并不存在这一现象,甚至出现心肌能量代谢水平增强,脂肪酸氧化能力提高[21]。这可能是运动性和病理性心肌肥大产生不同转归和预后的一个重要原因,但目前调控这一差异的因素并不是很清楚。
已有的研究证明,磷酸腺苷激活的蛋白激酶(AMP-activated protein kinase,AMPK)和过氧化物酶体增殖物激活受体-a(peroxisome proliferator-activated receptor-a,PPAR-a)在调节心脏能量代谢过程中起着开关作用,AMPK和PPAR-a被激活后可以加速分解代谢,抑制合成,促进心肌细胞脂肪酸氧化,保证能量供应。相反,抑制这两个蛋白后,会伴随着心功能的受损[1,4,6]。因此,本研究大胆推测,运动导致的生理性心肌肥大可能也是通过激活AMPK和PPAR-a,从而对肥大心肌的能量代谢起到保护作用。
本研究以游泳耐力训练构建生理性心肌肥大模型,以主动脉弓缩窄术(transverse aorta constriction,TAC)导致心脏后负荷增加而致病理性心肌肥大,探讨两种模型心肌组织脂肪酸和葡萄糖代谢的差异,并检测二者AMPK和PPAR-α的激活程度,为解释运动性和病理性心肌肥大发展转归的差异寻找新的证据和突破点。
1 材料和方法
1.1 动物及分组
12周龄雄性C57BL/6J小鼠购自扬州大学动物比较中心(动物许可证号:SYXK苏2012-0029),随机分为4组,每组各10只:1)安静对照组(Control):正常饲养;2)运动组(Swim):进行游泳耐力训练;3)假手术组(Sham):小鼠暴露主动脉弓但不进行动脉缩窄;4)手术组(TAC):小鼠进行主动脉弓缩窄手术,术后饲养2周。
1.2 实验方案
TAC手术操作要点如下[22]:采用3.6%水合氯醛腹腔注射麻醉,经气管插管与啮齿动物呼吸机连接。经颈部正中切口向下暴露主动脉弓部,在左颈总动脉与头臂干之间血管下方穿一7-0号丝线,并紧贴血管放置一26号针头,用丝线将动脉与针头一起扎紧并迅速抽出针头,按照统一标准造成不完全缩窄,术后饲养2周。Sham组除不进行缩窄外,其余手术步骤与TAC组相同。
Swim组训练方案:正式训练前9天为适应阶段,从第1天的10 min逐渐增加到第9天的90 min。正式训练时每天上、下午各一次,每次持续训练90 min,维持此强度训练2周。
1.3 指标测定与方法
1.3.1 二维超声心动图检测
各组小鼠麻醉后行二维超声心动图检查(General Electric Co,Fairfield,Conn),取左室长轴切面二尖瓣水平,在第4肋间探及,探头频率为13 MHz,扫描速度100 mm/s。在二维超声引导下取M超声曲线,测量心脏室间隔厚度(interventricular septum dimension,IVS)和左室后壁厚度(LV posterior wall dimension,LVPW),并测算其射血分数(ejection fractional shortening,EF)。
1.3.2 动物标本采集及处理
称量小鼠体重后麻醉,眼球取血,开胸后迅速取出心脏,剪去周围结缔组织,滤纸吸干水分,称取心脏重量。修剪去右心室,称取左心室重量。取小鼠小腿,量取胫骨长度,计算心重/体重比值(heart weight/body weight ratio,HW/BW)和左心室重量/胫骨长度比值(LV weight/tibia length ratio,LVW/TL)。
1.3.3 实时荧光定量PCR(realtime PCR,RT-PCR)
充分研磨心肌组织,提取总RNA,逆转录和RT-PCR操作按试剂盒说明书进行,引物由Invitrogen公司合成,序列如表1。反应体系为SYBR Green ROX(Roche)10 μl,上、下游引物共0.6 μl,cDNA 100 ng,DEPC水加至总体积20 μl,充分混匀。PCR反应条件为:50 ℃预处理2 min,95 ℃预变性10 min,95 ℃变性15 s,60 ℃退火,60 s共反应40个循环。ABI 7500软件记录数据并分析,将目的基因的Ct值与内参GAPDH的Ct值进行标准化,计算出目的基因的相对表达量。

表 1 本研究目的基因的引物序列一览表
1.3.4 心肌组织游离脂肪酸(free fatty acids,FFA)和葡萄糖(Glucose,Glu)含量的测定
称取约50 mg左室心肌组织,置于预冷的9倍体积的生理盐水中,电动匀浆。采用BCA蛋白定量试剂盒测定组织蛋白量,按说明书要求分别在空白管、标准管和测定管中加入相应试剂,充分混匀,3 500 rpm,离心10 min,小心吸去上层蓝色液体及蛋白凝块,吸取下层抽提液2 ml,在440 nm光径处,调零比色,计算样品中FFA含量。
心肌Glu含量测定,制备心肌组织匀浆液和蛋白定量方法同前。按说明书要求,在96孔板中加入相应试剂,混匀后37 ℃保温5 min,在505 nm光径处,酶标仪测定各孔吸光度。根据吸光度计算心肌Glu含量。
1.3.5 统计学分析
2 结果
2.1 二维超声心动图结果
如图1A所示,Swim组和TAC组的IVS和LVPW都有不同程度的增厚,左室内径缩小。统计结果显示,Swim和TAC组的LVPWd+IVSd与相应的对照组相比,都有明显增加(P<0.05,图1B),图1C显示两种心肌肥大模型的EF值都有升高,TAC组与Sham组相比,有显著性差异(P<0.05)。二维超声心动图结果提示,两种造模方法都能使小鼠心肌产生肥厚,以TAC组更为明显,且因为2周的造模时间使得TAC组心室内径减小,心功能尚处于代偿期,所以EF反而有所升高。
2.2 各组小鼠HW/BW、LVW/TL结果
图2A和2B显示,Swim组和TAC组的HW/BW和LVW/TL与相应的对照组相比,都有明显的升高(P<0.05),提示心肌重量增加,产生了肥厚。

图 1 本研究各组小鼠二维超声心动图检测结果
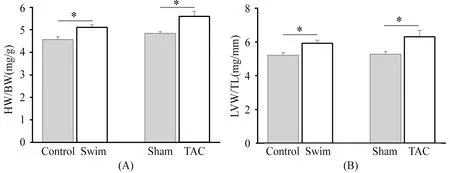
图 2 本研究各组小鼠HW/BW、LVW/TL比值
2.3 心肌组织心钠肽(atrial natriuretic peptide,ANP)、脑钠肽(brain natriuretic peptide,BNP)的mRNA水平
提取心肌组织总RNA检测胚胎型基因ANP、BNP的mRNA水平,如图3A显示,TAC所致心肌肥大小鼠,ANP水平明显高于Sham组(P<0.01),与Swim相比也有显著升高(P<0.01)。Swim组的BNP mRNA水平与Control组相比,没有明显升高,TAC组的BNP mRNA水平显著高于Sham组(P<0.01)和Swim组(P<0.01)。提示TAC所致病理性心肌肥大模型,心肌缺氧较为严重,承受的容量和压力负荷较大,ANP、BNP被显著激活,而运动导致的心肌肥大这一现象并不明显。
2.4 心肌组织胶原纤维沉积程度
对心肌组织进行Masson染色,图4中红色区域为心肌组织,绿色区域为胶原纤维。结果显示,Swim组心肌组织有少量胶原纤维沉积,TAC组的胶原纤维沉积最为严重,提示压力负荷导致的病理性心肌肥大模型,胶原蛋白的表达加强,纤维化程度加重,心脏的顺应性变差,进而引起心脏舒缩功能下降。
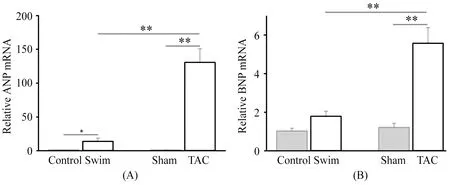
图 3 本研究心肌组织ANB、BNP mRNA水平
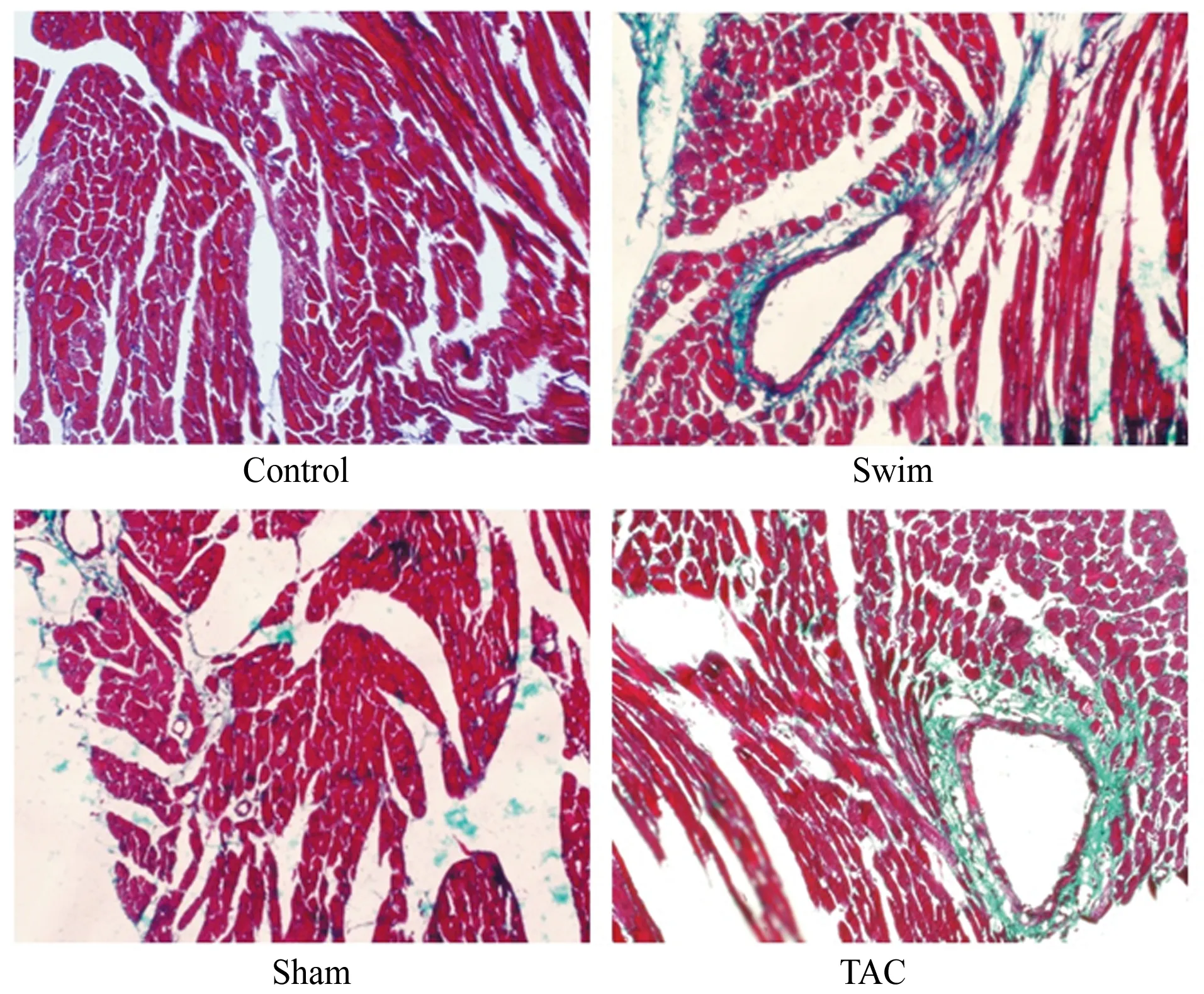
图 4 本研究心肌组织Masson染色 (×200)
2.5 心肌组织FFA和Glu水平
图5A显示,Swim组小鼠心肌组织FFA与Control组相比,没有明显差异。TAC组心肌FFA含量明显高于Sham组(P<0.05),Swim组与TAC组小鼠心肌组织FFA含量存在明显差异(P<0.01),提示病理性肥大心肌中脂肪酸β-氧化功能减弱,脂肪的利用减少,造成心肌组织脂质沉积。
图5B显示,与Control组相比,Swim组小鼠心肌Glu含量明显增加(P<0.05),TAC组心肌Glu虽然与Sham组相比没有显著性差异,但与Swim相比,具有明显差异(P<0.05)。提示长期有氧运动可以减少糖的利用和氧化供能,使心肌中Glu含量增多。
2.6 心肌组织AMPK和 PPAR-α的mRNA水平
提取心肌组织总RNA,RT-PCR检测AMPK和 PPAR-α的mRNA水平。图6A显示,Swim组的AMPK mRNA水平与Control组相比有明显升高(P<0.05),而TAC组则没有明显变化,Swim组与TAC组相比,具有明显差异(P<0.01)。图6B显示,TAC组PPAR-α的mRNA水平明显低于Sham组(P<0.05),而Swim组与Control组相比没有明显差异,TAC组的PPAR-α的mRNA水平明显低于Swim组(P<0.05)。
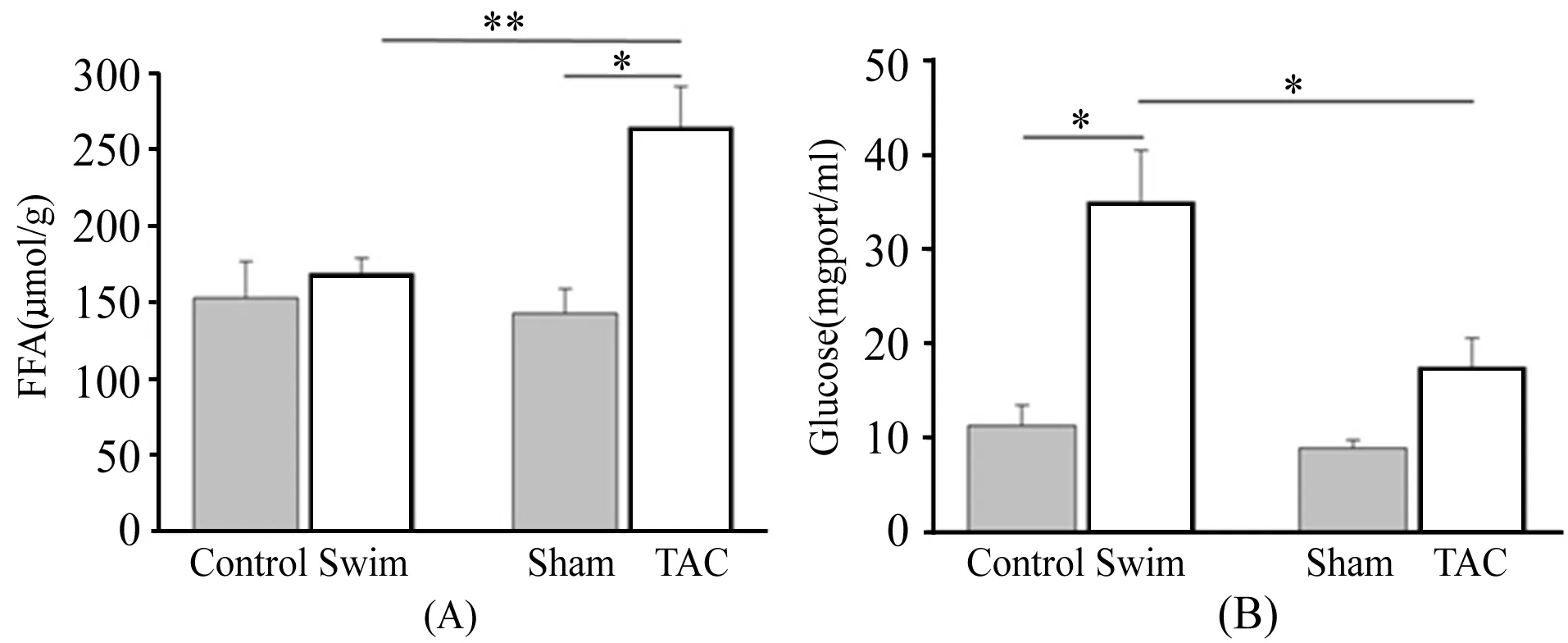
图 5 本研究心肌组织FFA、Glu水平
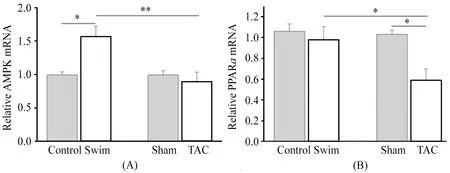
图 6 本研究心肌组织AMPK、PPARα的mRNA水平
3 讨论
心肌肥大的发病机制涉及神经-体液、能量代谢、氧化应激等多种因素的综合作用,而其中能量代谢紊乱是主要影响因子之一[14]。已经证实,健康心脏可利用多种底物产生能量以满足自身高消耗要求,其中脂肪酸氧化和葡萄糖转化分别占心脏耗能的65%和30%,乳酸、酮体、氨基酸等物质仅占据心脏能量消耗极小部分[20,24]。在病理性心肌肥大中,由于心肌组织长期慢性缺氧,心肌转而使用耗氧较低但产能较少的葡萄糖氧化取代脂肪酸氧化供能,即出现心肌能量代谢的“胚胎型再演”[2]。运动可使心脏的泵血功能增强,供氧充足,细胞脂肪酸β-氧化相应增强,能量生成增多。我们采用的两种心肌肥大模型中,TAC导致的病理性心肌肥大模型,虽然室壁肥厚,左室内径缩小,心功能得到一定代偿,但胚胎型基因ANP、BNP的mRNA水平升高,胶原纤维沉积明显,提示心肌缺氧较为严重,预后不良,而运动导致的心肌肥大则没有这些表现,而且,病理性心肌肥大模型心肌组织FFA含量显著升高,表明脂肪分解减慢,有大量FFA堆积,容易产生氧化应激,导致心肌进一步损伤,而运动性心肌肥大模型心肌组织FFA水平没有明显变化。
ANP和BNP分别是由心房和心室肌细胞分泌的肽类激素,当心肌缺氧、受到牵张、心肌细胞压力或容量负荷增加时分泌增多。ANP、BNP分泌时间较早,在心肌肥大和心衰早期即出现,且半衰期较长,与心衰的关系密切,已成为临床心肌缺氧和早期心衰的诊断标志物[10-12,16]。在本研究的实验中,Swim组ANP的mRNA水平有轻微升高,BNP则升高不明显;TAC导致的病理性心肌肥大模型却出现ANP、BNP都显著升高的现象,且明显高于Swim组。说明TAC导致的病理性心肌肥大模型,心肌细胞受到的容量和机械牵张较大,缺氧比较严重。而心肌细胞缺氧时,能量代谢以节约氧消耗为前提,由耗氧量较大的脂肪酸氧化供能为主转为葡萄糖氧化供能为主。
心肌组织的纤维化改变是心肌组织缺血缺氧后发生重构的典型病理改变,也是心力衰竭的重要原因。心肌缺血缺氧引起组织损伤、氧化应激和慢性炎症反应,使心肌细胞凋亡和坏死,细胞外基质和血管间隙被胶原物质替代,使得正常心肌细胞得不到充足的能量和血液供应,进一步加重损伤[7,13,23]。本研究的实验发现,TAC导致的胶原纤维沉积更为严重,特别是在血管周围,提示病理性心肌肥大的血管壁顺应性变差,心肌组织供血供氧障碍,进一步造成能量代谢障碍。
综上,病理性心肌肥大模型的ANP、BNP mRNA水平升高和更为严重的纤维化改变都提示,心肌组织存在严重的缺氧现象,使心肌组织的能量代谢由脂肪酸氧化供能为主转为葡萄糖供能为主,造成心肌组织FFA堆积。本研究进一步探讨了调控二者心肌能量代谢的分子机制。
AMPK是调节能量代谢的关键分子,在心脏保护中起到重要的作用,心肌组织中AMP/ATP比值升高可有效激活AMPK。赛庆彬等人研究发现,长期有氧运动持续上调心力衰竭大鼠心肌p-AMPK的表达,且可以提高心功能[9]。另有研究表明,运动锻炼可以使病理性心肌肥大中已经异常的心肌肌球蛋白类型向正常化发展,使ATP酶活性和肌质网功能增强,线粒体数量增加,从而改善病理性心肌肥大[18]。本研究中,Swim组小鼠心肌AMPK的mRNA水平明显升高,其心肌组织中FFA含量正常,没有出现堆积,葡萄糖含量有所升高,说明心肌组织仍主要以FFA为能量底物,并没有出现病理性心肌肥大模型中的能量代谢胚胎型转化。可见运动可以激活心肌组织AMPK,促进心肌对脂肪酸的氧化分解,改善肥大心肌的能量代谢。
PPARs是核激素受体家族中的配体激活受体,有PPARα,PPAR β/δ,PPARγ 3种亚型,控制许多细胞内的代谢过程。之前学者们认为,PPARs主要存在于脂肪细胞,其功能主要在于促进脂肪细胞分化,调节脂质代谢和糖代谢,是研究肥胖、高脂血症、糖尿病及胰岛素抵抗等代谢综合症的重要靶标[3,8,15,17]。但Young ME等人研究报道[25],PPAR-α主要在心脏中表达,是心脏底物转换的调节因子,抑制葡萄糖氧化而增加脂肪酸β-氧化。本实验发现,病理性心肌肥大发生时,PPAR-α表达明显下调,减弱了对葡萄糖氧化的抑制,导致心肌组织葡萄糖氧化增强,脂肪酸β-氧化减弱,使得心肌能量代谢紊乱,左心室功能下降,严重时可能出现心律不齐甚至心衰等相应症状。PPAR-α是AMPK的下游因子,激活AMPK可以上调PPAR-α的表达。而本实验中,运动性心肌肥大模型的AMPK被激活,但PPAR-α表达并没有明显升高,可能原因为,肥大相对缺氧的心肌组织中,PPAR-α的表达可能不仅只受AMPK的调控,还受到其他因素的调节。
4 结论
1.病理性心肌肥大时,由于缺氧等长期不良刺激,导致心肌ANP、BNP表达升高、间质纤维化加重,脂肪酸氧化障碍,FFA堆积,能量底物向葡萄糖转变,能量代谢供求矛盾突出,运动性心肌肥大则没有这种改变。
2.运动能改善心肌肥大时的能量代谢,保护缺血心肌,其机制可能是通过激活AMPK的表达进行调控的。
[1]常颖,周义义,马延超.长期耐力训练抑制慢性心力衰竭大鼠HIF1α-PPARγ信号途径并改善心肌脂质代谢紊乱的研究[J].体育科学,2012,32(12):62-70.
[2]冯兵,徐静,刘伟,等.肥大心肌细胞缺氧复氧损伤特点及干预能量代谢的作用[J].中国病理生理杂志,2007,23( 3):500-504.
[3]李为民,刘怡希.心脏能量代谢重构研究进展[J].中国医学前沿杂志,2013,5 (4):8-11.
[4]林先,彭佑华.老龄鼠心肌能量代谢重构及PPAR-α调节作用的研究 [J].现代预防医学,2012,39(24):6449-6454.
[5]林志健,张冰,刘小青.AMPK-ACC信号通路与相关代谢疾病的研究进展[J].中国糖尿病杂志,2013,21(5):474-477.
[6]刘宇坦,刘怡希,李为民.AMPK与心血管疾病关系研究进展 [J].国际心血管病杂志,2013,40(2):97-100.
[7]米粟.白介素17A抑制自噬活性促进组织纤维化发生发展[D].北京:北京协和医学院博士学位论文,2012.
[8]潘华.肥胖大鼠高游离脂肪酸血症对心脏结构及功能的影响[D].成都:四川大学硕士学位论文,2007.
[9]赛庆彬,马延超,朱荣.有氧运动抑制心力衰竭大鼠心脏脂质沉积:AMPK- PPAR-α信号通路的作用[J].中国运动医学杂志,2012,31(12):1081-1108.
[10] 孙国强.血尿素与BNP及心脏功能关系的临床研究[D].长春:吉林大学硕士学位论文,2011.
[11] 王枫,姜丽萍,于忠恩,等.血浆脑钠肽对老年慢性心力衰竭的诊断价值及预后评估[J].中国全科医学,2011,14(12):4099.
[12] 王跃荣,张栋梁,李岚,等.慢性心力衰竭患者氨基末端B型钠尿肽与心肌肌钙蛋白I水平分析[J].检验医学,2011,26(7):433-435.
[13] 吴立玲,张幼仪.心血管病理生理学[M].北京:北京大学医学出版社,2009.
[14] 杨锡让.实用运动生理学[M].北京:北京体育大学出版社,2007.
[15] 殷然,董吁钢,李红良,等.AMPK通过增强心肌脂肪酸氧化抑制大鼠心肌肥厚[J].中国病理生理杂志,2007,23(7):1258-1262.
[16] 昝春辉,宣兵.心房利钠肽与心血管疾病的临床研究进展[J].实用心脑肺血管病杂志,2013,4(21):8-10.
[17] 张世勤.MAPKs及PPARs在心肌肥大和心力衰竭发生和防治中的作用和细胞机理[D].长沙:中南大学博士学位论文,2003.
[18] 张振英,刘秀华,孙胜,等.腹主动脉狭窄致大鼠心肌肥大后心肌组织蛋白质组变化的研究 [J].中国微循环,2009,4(13):84-89.
[19] 周四桂,王平,路遥,等.短链酰基辅酶A脱氢酶在大鼠生理性和病理性心肌肥大中的作用[J].中国病理生理杂志,2012,28(11):1921-1927.
[20] ELLISON G M,WARING C D,VICINANZA C,etal.Physiological cardiac remodelling in response to endurance exercise training:cellular and molecular mechanisms [J].Heart,2012,98(1):5-10.
[21]FORYST-LUDWIG,KREISSL M C,SPRANG C,etal.Sex differences in physiological cardiac hypertrophy are associated with exercise-mediated changes in energy substrate availability[J].Am J Phys Heart Circ Phys,2011,301(1):H115-H122.
[22]Hu Y,Li T,WANG Y,etal.Tollip attenuated the hypertrophic response of cardiomyocytes induced by IL-1 beta[J].Front Biosci,2009,14(1):2747-2756.
[23]LORELL B H,CARABELLO B A.Left ventricular hypertrophy:pathogenesis,detection,and prognosis[J].Circulation,2000,102:470-479.
[24]WEEKS K L,MCMULLEN J R.The athlete’s heart vs.the failing heart:can signaling explain the two distinct outcomes?[J].Phys,2011,26(2):97- 105.
[25]YOUNG M E,LAWS F A,GOODWIN G W,etal.Reactivation of peroxi-some proliferator- activated receptorα is associated with contractile dysfunction in hypertrophied rat heart[J].J Biol Chem,2001,276(48):44390-44394.
EffectofAMPKonEnergyMetabolismofMiceinExercise-inducedandPathologicalCardiacHypertrophy
HU Yu-long1,XU Hui1,WANG Yong-mei2,ZAN Xiao1,LI Ning-chuan1
To explore the differences of energy metabolism in exercise-induced and pathological cardiac hypertrophy and its regulation factor.Methods:The exercise-induced cardiac hypertrophy model was made by swim training,and the pathological model was made by transverse aortic constriction (TAC).12-week-old C57Bl/6J mice were divided randomly into control group,swim group,sham group and TAC group.By the end of experiments,cardiac hypertrophy,contractility were evaluated by echocardiography,and myocardial fibrosis were detected by Masson staining.Myocardial free fatty acid (FFA) and glucose levels were measured by colorimetric detection,AMPK and PPAR-α mRNA expression were detected by real time PCR (RT-PCR).Results:1) Significant cardiac hypertrophy could both produced by swim training and TAC in mice.Compared with corresponding control groups,interventricular septum thickness (IVS) and left ventricular posterior wall thickness (LVPW) of two cardiac hypertrophy models were significantly increased (P<0.05),heart weight/body weight ratio,left ventricular weight/ tibia length ratio were also increased significantly (P<0.05) compared with corresponding control groups.ANP and BNP mRNA expression of TAC group were higher than those of swim group obviously (P<0.01),and its’ myocardial fibrosis was significantly heavier than swim group.2) FFA in myocardium of TAC group were significantly increased compared with those of sham (P<0.05) and swim group (P<0.01),Glu in myocardial of swim group were significantly higher than those of control (P<0.05) and TAC group (P<0.05).(3) AMPK mRNA expression levels were significantly increased of swim group compared with control (P<0.05) and TAC group (P<0.01),while PPAR-α mRNA expression levels of TAC group were significantly lower than those of sham (P<0.05) and swim group (P<0.05).Conclusion:Exercise could improve energy metabolism in cardiac hypertrophy,and reduce energy metabolism embryonic recapitulation through activating of AMPK expression.
cardiachypertrophy;exercise;energymetabolism;AMPK;PPAR-α
1000-677X(2014)09-0039-05
2014-01-14;
:2014-08-05
江苏省体育局局管课题(ST12102202)。
胡玉龙(1975-),女,湖南临武人,副教授,博士,硕士研究生导师,研究方向为运动对心血管疾病的干预机制,Tel:(0514)87997109,E-mail:ylhu@yzu.edu.cn。
1.扬州大学 体育学院,江苏 扬州 225009;2.南京陆军指挥学院门诊部,江苏 南京 210045 1.Physical Education College,Yangzhou University,Yangzhou 225009,China;2.Nanjing Army Command College Clinic Hospital,Nanjing 210045,China.
G804.7
:A
