吲哚参与的不对称Michael加成反应研究进展
2014-07-18郭丰敏刘雄伟潘博文刘雄利
郭丰敏,刘雄伟,潘博文,石 洋,刘雄利,周 英
(贵州大学药学院,贵州省中药民族药创制工程中心,贵州 贵阳 550025)
吲哚骨架在天然产物和治疗药物实体中是一种重要的结构[1],故在很多结构中引入吲哚基团或对吲哚骨架进行结构修饰是开发和研究新型功能分子的有效途径。由于其存在抗氧化、抗菌和杀虫功效等生物学作用,吲哚取代物的制备近来得到广泛关注[2]。吲哚是一个富电子的杂环芳香化合物,可接受亲电试剂的进攻,其Michael加成反应是一种强有力的碳-碳键形成的合成途径[3],这些反应在富电子的芳杂环的烷基化反应中的应用很广。在众多Michael加成反应中,吲哚与α,β-不饱和羰基化合物的不对称Michael加成反应被广泛研究[4-5]。鉴于吲哚结构在天然产物和潜在药物中的普遍存在,以及吲哚这种芳香类杂环的不对称烷基化合成在许多天然产物和药物的合成中的重大意义,国内外关于吲哚与α,β-不饱和羰基化合物的催化性不对称Michael加成反应的发展做了大量的工作[6-7]。本文现对吲哚与不同类型的Michael反应受体的不对称反应进行综述。
1 吲哚与烯酮的不对称Michael加成反应
1.1 一般烯酮
2007年,Gonzalo Blay等人报道了用 Zr(OtBu)4与以联萘酚为基础的配合物作为催化剂催化烯酮与吲哚的不对称Michael加成反应,反应产率高且具有高过98%ee(图 1)[8]。

图1 Gonzalo Blay等人报道的催化反应Fig.1 Catalytic reactions reported by Gonzalo Blay
同年,Giuseppe Bartoli等人报道了一个用有机铵盐催化剂催化的此类反应,其产量跟对映体选择性分别在56% ~99%和70% ~96%之间,随反应物的差异有所不同,但多数较高(图2)[9]。
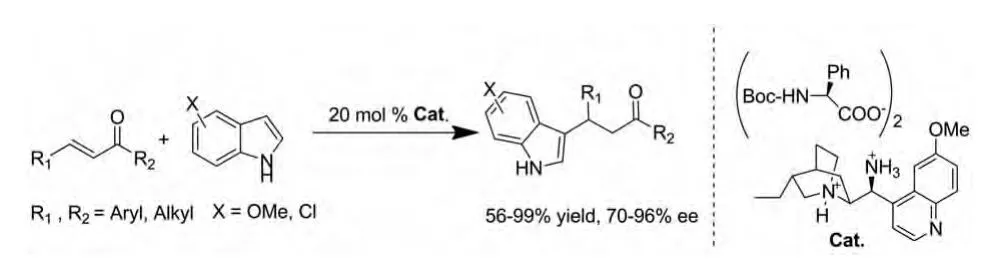
图2 有机铵盐催化的反应Fig.2 Organic salts catalyzed reactions
2012年Dawid Lyzwa等人报道了另一由有机催化剂催化的在高压加速下的吲哚与酮的不对称Michael加成反应,此反应特别适合四元立体碳中心的构建。在这种有机催化剂的催化下,吲哚与一般α,β-不饱和酮反应在高产率的条件下有高达90%的对映选择性,吲哚与β,β-二取代的烯酮反应也可在较好产率下有高达80%的对映选择性(图 3)[10]。
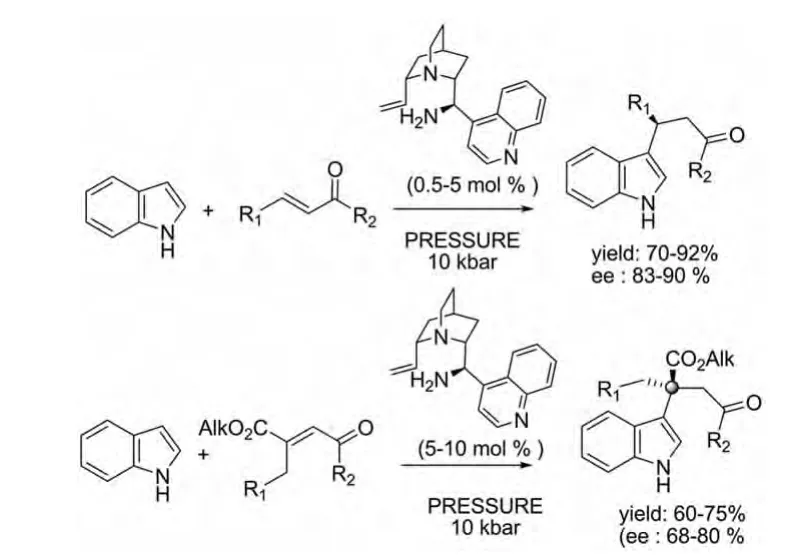
图3 Dawid Lyzwa等人报道的催化反应Fig.3 Catalytic reactions reported by Dawid Lyzwa
1.2 α’-羟基烯酮
2005年,Claudio Palomo等报道了用二噁唑啉的二价铜配合物做催化剂催化的α′-羟基烯酮与吲哚的不对称Michael加成反应。该催化剂下的反应表现出了极佳的反应产率(86% ~96%)和对映选择性(93% ~98%)(图 4)[11]。
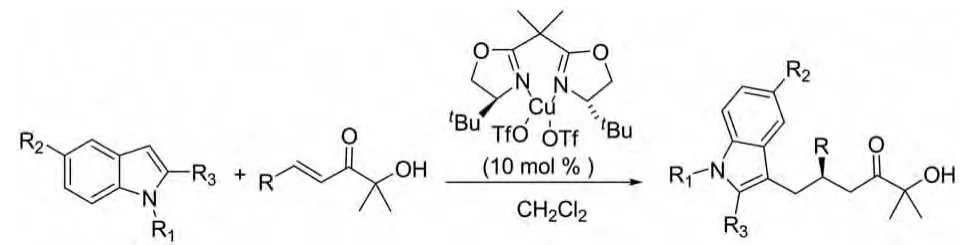
图4 Claudio Palomo报道的催化反应Fig.4 Catalytic reactions reported by Claudio Palomo
在2010年,Yang lei等人报道了β-芳基-α′-羟基烯酮与吲哚的不对称Michael加成反应,反应的催化剂为手性布朗斯特酸的金属盐。这种α′-羟基烯酮类与吲哚的反应在此催化剂作用下产率和对映选择性都非常好,特别是在β-芳基的对位有吸电子基团时,产率高达90%,ee值高达91%(图 5)[12]。
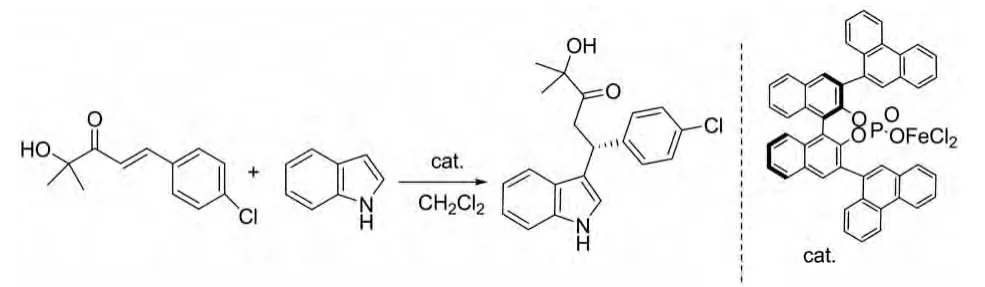
图5 手性布朗斯特酸的金属盐催化的反应Fig.5 Chiral Bronsted acid salt catalytic reaction
1.3 查尔酮
2010年Xiaoming Feng等人报道了查尔酮与吲哚在催化剂L10-Sc(OTf)3体系下的反应。该反应产率可达到99%,且有92%的ee值。此催化剂对除查尔酮的其他不饱和酮也有较好的催化作用,催化效果与酮的类型及吲哚上的取代基有一定关系,但产率和 ee值均较高(图 6)[13]。
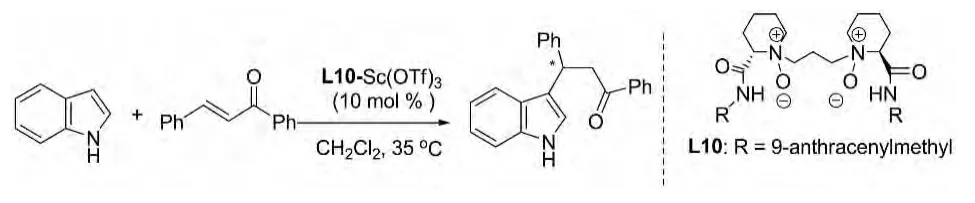
图6 L10-Sc(OTf)3催化的反应Fig.6 L10-Sc(OTf)3 catalytic reaction
另外还有许多研究小组开发了许多催化剂,但是随取代基的不同变化较大,且产率和ee变化较大。诸如2010年Tsubasa Sakamoto等人[14]和2010同一年Elisa G.Gutierrez等人[15]等研究小组开发的联萘磷酸类催化剂。
1.4 β -三氟甲基 -α,β -烯酮
2010年Gonzalo Blay等人报道了用手性联二萘酚衍生物与Zr(OtBu)4形成的配合物催化β-三氟甲基-α,β-烯酮与吲哚的反应(图7)。在研究的多种吲哚衍生物中,除少数取代产物在此催化体系下产率和ee均较低外,其他都表现出良好的催化活性(87% ~99%yield,70% ~96%ee)[16]。
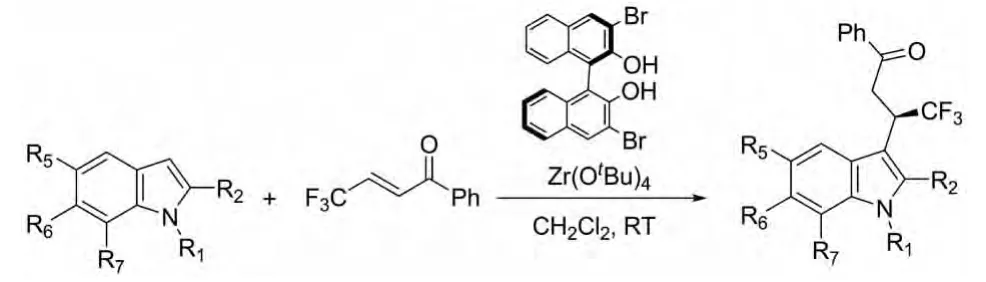
图7 Gonzalo Blay等人报道的催化反应Fig.7 Catalytic reactions reported by Gonzalo Blay
1.5 含杂环的 α,β -烯酮
2008年Pradeep K.Singh and Vinod K.Singh报道了一种吲哚与1-氧代-2-烯酮-吡啶在手性2,6-二-(5’,5’-二苯基噁唑啉)吡啶与Cu(Ⅱ)形成的配合物催化下发生的高对映选择性Michael加成反应(图8)。此催化剂在吲哚烷基化反应中可使产率高达97%,且具有非常好的对映选择性(99%ee)[17]。
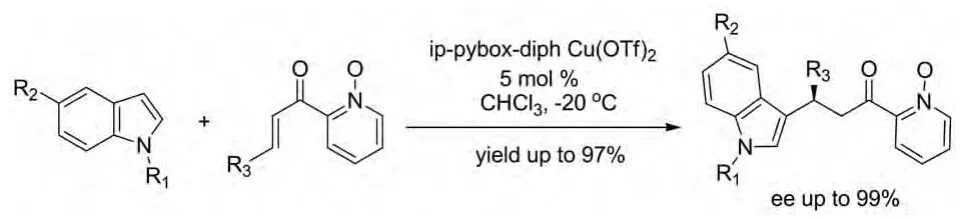
图8 Pradeep K.Singh和 Vinod K.Singh报道的催化反应Fig.8 Catalytic reactions reported by Pradeep K.Singh& Vinod K.Singh
在2012年,Jimil George and B.V.Subba Reddy也报道了吲哚与1-氧代-2-烯酮-吡啶的不对称Michael加成反应。他们使用的催化剂是5 mol%的glucoBOX-Cu(Ⅱ),这是第一次报道的用于吲哚的对映选择性Friedel-Crafts反应的基于糖的配体催化剂。此反应产率极好,有高达99%的 ee 值(图 9)[18]。
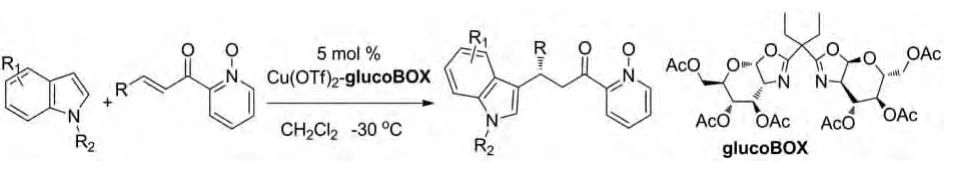
图9 glucoBOX-Cu(Ⅱ)催化的反应Fig.9 glucoBOX-Cu(Ⅱ)catalytic reactions
关于α,β-不饱和-2-酰基咪唑与吲哚的对映选择性Michael加成反应已有一些报道。其中David A.Evans及其研究小组分别在2005年[19]、2006年[20]、2007 年[21]报道了 2,6- 二 - 噁唑啉吡啶与三氟甲烷磺酸钪形成的配合物作为吲哚与含咪唑基烯酮的不对称Michael加成反应催化剂。研究小组在三篇报道中不断对催化剂结构中的取代基、催化剂的用量、溶剂及反应温度进行完善和更新,使催化剂活性与对映体选择性更好(图10)。
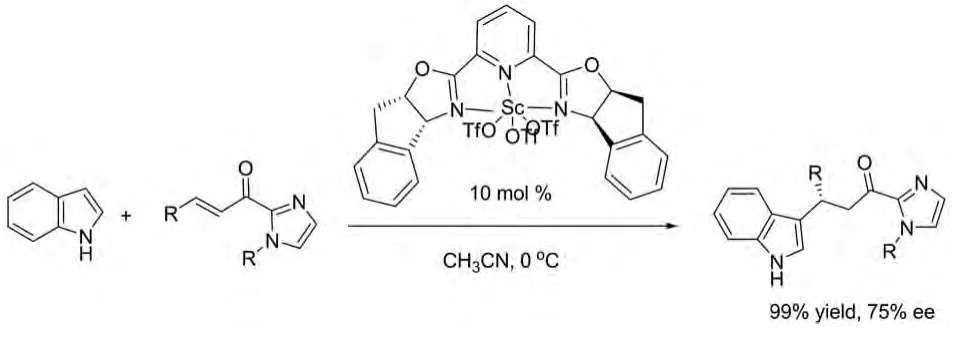
图10 David A.Evans及其研究小组报道的催化反应Fig.10 Catalytic reactions reported by David A.Evans’s team
在 2009年,Arnold J.Boersma等报道了以DNA为基础的催化剂来催化此类反应。这种催化剂催化效率高,在报道的几个例子里产率很好,且有高达99%的 ee值(图 11)[22]。

图11 DNA为基础的催化剂催化的反应Fig.11 Catalyst catalytic reactions based on DNA
2 吲哚与烯醛的不对称Michael反应
2002年,Joel F.Austin等人在前人研究基础上开发了一类有效的咪唑啉酮催化剂(Cat.1,2)。催化剂1或2和协同催化剂TFA和p-TSA能很好地催化N-甲基吲哚与(E)-丙烯基甲醛的对映选择性的Michael加成反应。反应具有很高的对映选择性(≥85%ee)和反应产率(yield≥70%)。另外,此催化剂在低温(-83oC)时使用i-PrOH(15%V/V in CH2Cl2)作为溶剂也可以得到具有很好对映选择性的产物(84%产率,92%ee)(图12)[23]。
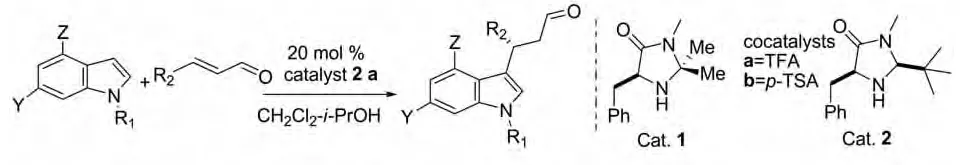
图12 Joel F.Austin等人报道的催化反应Fig.12 Catalytic reactions reported by Joel F.Austin
到2007年,Chang-Feng Li等报道了一种高效且可用于分子内成环的不对称Michael加成反应,此催化剂催化下的此类反应产率可高达95%,并且有高达93%的ee值(图13)[24]。

图13 Chang-Feng Li等人报道的催化反应Fig.13 Catalytic reactions reported by Chang-Feng Li
2009年,Liang Hong等报道了一种用于吲哚和α,β-不饱和醛的不对称Michael加成反应的碱性催化剂。这种催化剂避开了以往的酸性催化,使反应可以在碱性条件下顺利进行。并且,这种在三乙胺中进行的碱性催化反应产率非常高,对映体选择性也很高(图 14)[25]。
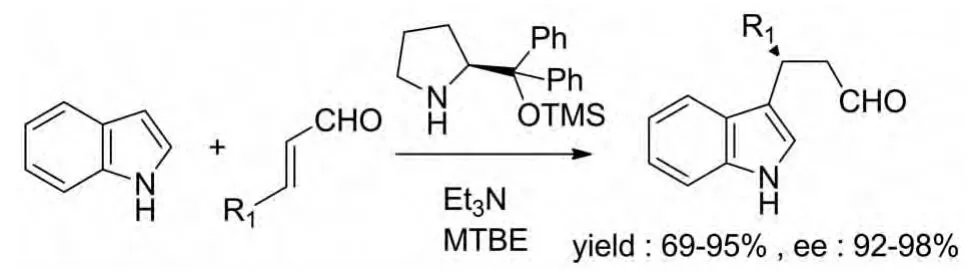
图14 Liang Hong等报道的催化反应Fig.14 Catalytic reactions reported by Liang Hong
3 吲哚与α,β-不饱和酯的不对称Michael反应
2003年David A.Evans等报道了用2,6-二-噁唑啉吡啶与三氟甲烷磺酸钪形成的配合物催化吲哚与α,β-不饱和酯的不对称Michael加成反应(图15)。反应产率较高,立体选择性也较好,并且是近年来唯一单独报道的此类反应催化剂[26]。
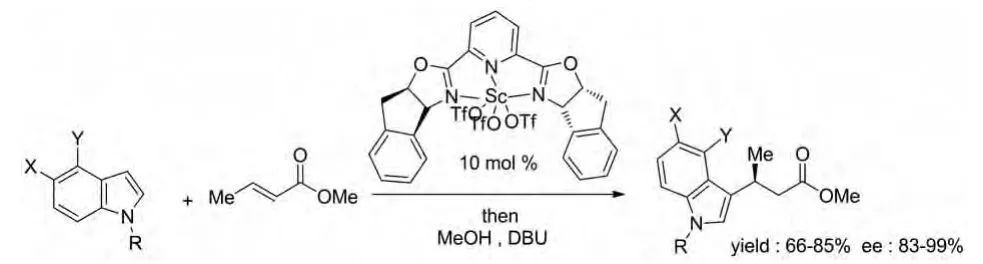
图15 David A.Evans等报道的催化反应Fig.15 Catalytic reactions reported by David A.Evans
4 β,γ-不饱和-α-酮基酯的不对称Michael反应
由于β,γ-不饱和-α-酮基酯的多位点性,此类化合物与吲哚反应同时会有1,2和1,4加成两种产物,故一般反应产率和对映体选择性不是很高。2007年Magnus Rueping研究小组和2011年Jian Lv及其研究小组分别报道了由手性布朗斯特酸类催化的吲哚类化合物与β,γ-不饱和-α-酮基酯的不对称Michael加成反应(图16)[27-28]。
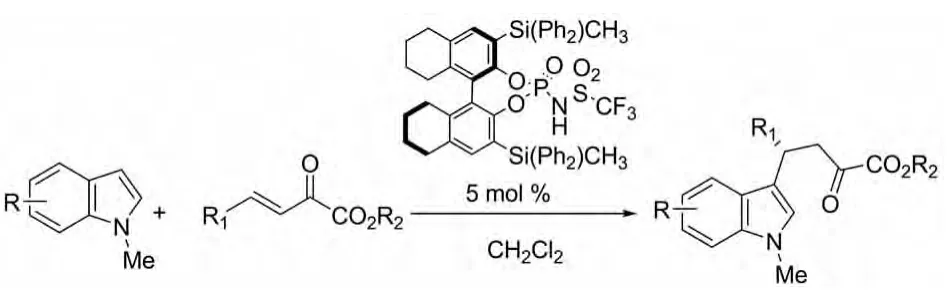
图16 Magnus Rueping研究小组和Jian Lv研究小组报道的催化反应Fig.16 Catalytic reactions reported by Magnus Rueping’team & Jian Lv’s team
5 吲哚与硝基烯的不对称Michael反应
2011年Jing Wu等人报道了用手性二磺酰胺二胺与Cu(OTf)2的配合物作为催化剂催化吲哚与硝基烯的不对称Michael加成反应,催化活性强,反应有高达99%的产率和97%的ee值(图17)[29]。
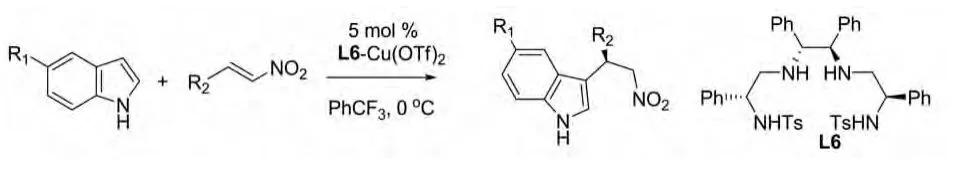
图17 Jing Wu报道的催化反应Fig.17 Catalytic reactions reported by Jing Wu
同一年,Takayoshi Arai等报道了吲哚与α-取代的硝基烯在新型咪唑啉-氨基苯酚L2与Cu(Ⅱ)的配合物的催化作用下的不对称Michael加成反应(图18)。随反应中底物取代基的不同产率和ee有差别,但总体催化效率较好,产率可高达94%,ee 值高达 92%[30]。
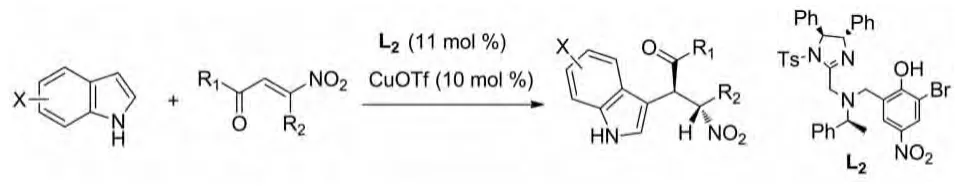
图18 Takayoshi Arai等报道的催化反应Fig.18 Catalytic reactions reported by Takayoshi Arai
2012年Yang Jia等报道了由二苯基胺连接的二噁唑啉和二噻唑啉L1与Zn(Ⅱ)配合物作为催化剂催化的吲哚跟2-氢-3-硝基-苯并吡喃的不对称Michael加成反应(图19)。该反应在温和条件下以高产率和高对映选择性(高达95%ee)得到双立体中心的物质结构[31]。
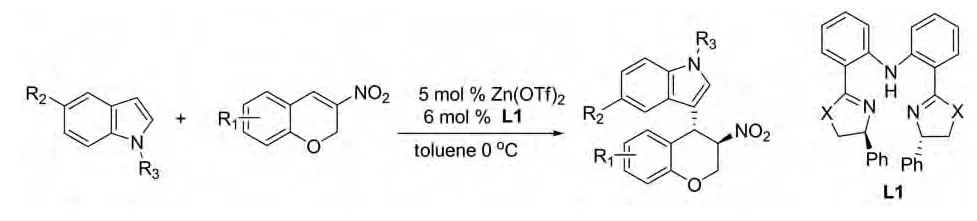
图19 Yang Jia等报道的催化反应Fig.19 Catalytic reactions reported by Yang Jia
6 吲哚与烷叉丙二酸酯的不对称Michael反应
2002年Jian Zhou和Yong Tang报道了用手性三噁唑啉与Cu(OTf)2·6H2O的配合物作为催化剂来催化吲哚与苯亚甲基丙二酸酯的不对称Michael加成反应(图 20)[32]。
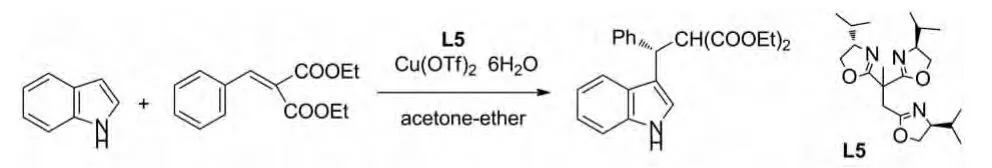
图20 手性三噁唑啉与Cu(OTf)2·6H2 O的配合物催化的反应Fig.20 Chiral trioxazoline and Cu(OTf)2·6H2 O complexes catalytic reaction
2005年Shoko Yamazaki and Yuko Iwata报道了另外的手性二唑啉类物质与Cu(OTf)2组合催化剂来催化此类反应。此催化剂催化的此类反应对映体选择性非常好,高达95%ee(图 21)[33]。
在2011年Lele Wen等人对三氟乙烯基丙二酸酯与吲哚的不对称Michael加成反应的催化剂进行了报道。最终遴选出催化活性非常好的手性二噁唑啉类与铜的混合物作为催化剂(图22)[34]。
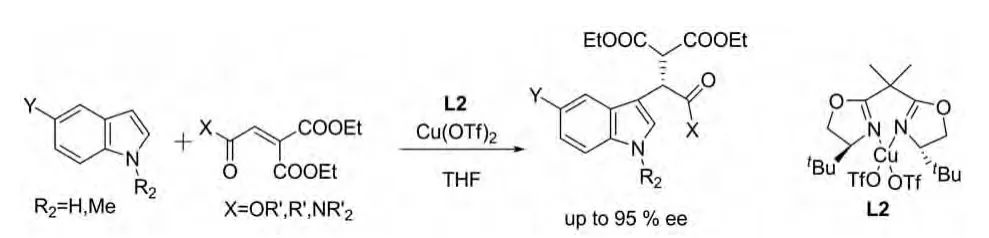
图21 Shoko Yamazaki and Yuko Iwata报道的催化反应Fig.21 Catalytic reactions reported by Shoko Yamazaki and Yuko Iwata
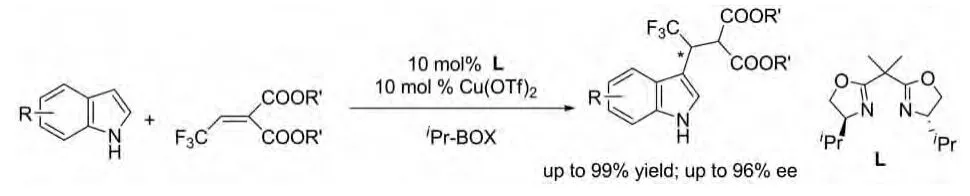
图22 手性二噁唑啉类与铜的混合物催化的反应Fig.22 Chiral dioxazoline and Cu2+catalytic reactions
7 展望
目前可以作为受体与吲哚发生不对称Michael加成反应的化合物类型(烯酮、烯醛、烯酯、硝基烯等)都有研究,特别是烯酮类物质。并且随着新催化剂的不断发展,反应产率和对映选择性也将会不断提高。相信这类反应会在有机合成界,特别是天然产物的合成中起到重要的促进作用。并且相信这类反应产生的具有吲哚骨架的手性化合物会在今后的药物设计和研发中占据重要地位。
[1](a)SAXTON J E.Recent progress in the chemistry of the monoterpenoid indole alkaloids[J].Nat.Prod.Rep.1997,14,559-590.(b)TOYOTA M,IHARA N,Recent progress in the chemistry of non-monoterpenoid indole alkaloids[J].Nat.Prod.Rep.,1998,15:327-340.
[2]CUTIGNANO A,BIFULCO G,BRUNOI,et al.A new antiviral bromoindole alkaloid from the mediterranean sponge halicortex sp[J].Tetrahedron,2000,56:3 743-3 748.
[3]OLAH G A,KRISHNAMURTI R,PRAKASH G K S.Friedel-Crafts alkylation In comprehensive organic synthesis[M]Pergamon Press:Oxford,1991,3:293-339.
[4]DAVID A E,KEITH R F,SONG H J.Enantio-selective Friedel-Crafts alkylation ofα,β -unsaturated 2-acyl imidazoles catalyzed by bis(oxazolinyl)pyridine-Scandium(III)triflate complexes[J].J.AM.CHEM.SOC.,2005,127:8 942-8 943.
[5]MARCO B,ALFONSO M,ACHILLE U R.Neue katalytische Methoden in der stereoselektiven Friedel-Crafts-alkylierung[J]Angew.Chem.Int.Ed.,2004,43:560-566.
[6]WANG Y,DING K,DAI L.NeuereÜbersicht zu asymmetrischen F-C-reaktionen[J].Chemtracts,2001,14:610–615.
[7]SVETLANA B T.Recent advances in asymmetric organocatalytic 1,4-conjugare additions[J].Eur.J.Org.Chem.,2007,11:1 701-1 716.
[8]GONZALO B,ISABEL F,JOSEP P.Highly enantioselective Friedel-Crafts alkylations of indoles with simple enones catalyzed by Zirconium(IV)-BINOL complexes[J].Org.Lett.,2007,9(13):2 601-2 604.
[9]GIUSEPPE B,MARCELLA B,ARMANDO C.Organocatalytic asymmetric Friedel-Crafts alkylation of indoles with simple α,β -unsaturated ketones[J].Org.Lett.,2007,9(7):1 043-1 045.
[10]DAWID Ł,KRZYSZTOF D,PIOTR K.High-pressure accelerated asymmetric organocatalytic Friedel-Crafts alkylation of indoles with enones:application to quaternary stereogenic centers construction[J].Org.Lett.,2012,14(6):1 540-1 543.
[11]CLAUDIO P,MIKEL O,BHARAT G.K,et al.Highly enantioselective Friedel-Crafts alkylations of pyrroles and indoles with α -hydroxy enones under Cu(II)-simple bis(oxazoline)catalysis[J].J.AM.CHEM.SOC.,2005,127(12):4 154-4 155.
[12]YANG L,ZHU Q M,GUO SM,et a l.Chiral Brosted acid directed iron-catalyzed enantioselective Friedel–Crafts alkylation of indoles with β -aryl a’-hydroxy enones[J].Chem.Eur.J.,2010,16:1 638-1 645.
[13]WANG W T,LIU X H,CAO WD,et al.Highly enantioselective synthesis ofβ -heteroaryl-substituted dihydrochalcones through Friedel– Crafts alkylation of indoles and pyrrole[J].Chem.Eur.J.,2010,16:1 664-1 669.
[14]TSUBASA S,JUNJII,KEIJIM,TAKAHIKOA.Chiral Brosted acid catalyzed asymmetric Friedel–Crafts alkylation reaction of indoles withα,β-unsaturated ketones:short access to optically active 2-and 3-substituted indole derivatives[J].Org.Biomol.Chem.,2010,8:5 448-5 454.
[15]ELISA G G,ERICJM,EVA H S,et al.Electron-withdrawing,biphenyl-2,2’-diol-based compounds for asymmetric catalysis[J].Eur.J.Org.Chem.,2010,16:3 027-3 031.
[16]GONZALO B,ISABEL F,CARMEN M M,et al.Synthesis of functionalized indoles with a trifluoromethyl-substituted stereogenic tertiary carbon atom through an enantioselective Friedel– Crafts alkylation with b-rrifluoromethyl-α,β –enones[J].Chem.Eur.J.,2010,16,9 117-9 122.
[17]PRADEEPK S,VINOD K S.Highly enantioselective Friedel-Crafts reaction of indoles with 2-enoylpyridine 1-oxides catalyzed by chiral pyridine 2,6-bis(5′,5′-diphenyloxazoline)-Cu(II)complexes[J].Org.Lett.,2008,10(18):4 121-4 124.
[18]JIMIL G,SUBBA REDDY B V,Enantioselective Friedel–Crafts alkylation of indoles with 2-enoylpyridine-Noxides catalyzed by glucoBOX-Cu(II)complex[J].Org.Biomol.Chem.,2012,10:4 731 –4 738.
[19]DAVID A E,KEITH R F,SONGH J.Enantioselective Friedel-Crafts alkylations ofα,β -unsaturated 2-acyl imidazoles catalyzed by bis(oxazolinyl)pyridine-Scandium(III)triflate complexes[J].J.AM.CHEM.SOC.,2005,127:8 942-8943.
[20]DAVID A E,KEITH R F.Catalytic enantioselective pyrrole alkylations ofα,β -unsaturated 2-acyl imidazoles[J].Org.Lett.,2006,8(11):2 249-2 252.
[21]DAVID A E,KEITH R F,SONGH J,et al.Enantioselective Friedel-Crafts alkylations catalyzed by bis(oxazolinyl)pyridine-Scandium(III)triflate complexes[J].J.AM.CHEM.SOC.,2007,129:10 029-10 041.
[22]ARNOLD JB,BENL F,GERARD R.Enantioselective Friedel–Crafts reactions in water using a DNA based catalyst[J].Angew.Chem.Int.Ed.,2009,48:1-4.
[23]JOEL F A,DAVID W C,MACMILLAN.Enantioselective organocatalytic indole alkylations.design of a new and highly effective chiral amine for iminium catalysis[J].J.AM.CHEM.SOC.,2002,124(7):1 172-1 173.
[24]LI CF,LIU H,LIAO J,et al.Enantioselective arganocatalytic intramolecular Ring-Closing Friedel-Crafts-Type alkylation of indoles[J].Org.Lett.,2007,9(10):1 847-1 850.
[25]HONG L,WANG L,CHEN C,et al.An efficient enantioselective method for asymmetric Friedel– Crafts alkylation of indoles with α,β -unsaturated aldehydes,[J].Adv.Synth.Catal.,2009,351:772 –778.
[26]DAVID A E,KARL A S,KEITH R F,et al.Enantioselective indole Friedel-Crafts alkylations catalyzed by Bis(oxazolinyl)pyridine-Scandium(III)triflate complexes[J].J.AM.CHEM.SOC.,2003,125:10 780-10 781.
[27]MAGNUSR,BORISJ N,STEFAN A M,et al.Asymmetric Brosted acid catalysis:enantioselective nucleophilic substitutions and 1,4-additions[J].Angew.Chem.Int.Ed.,2007,46:1-5.
[28]LV J,ZHANGL,ZHOU Y M,et al.Asymmetric binary acid catalysis:a regioselectivity switch between enantioselective1,2-and 1,4-addition through different counteranions of In[J].Angew.Chem.Int.Ed.,2011,50:1-6.
[29]WU J,LI X C,WU F,WAN B S.A new type of Bis(sulfonamide)-diamine ligand for a Cu(OTf)2-catalyzed asymmetric Friedel-Crafts alkylation reaction of indoles with nitroalkenes[J].Org.Lett.,2011,13(18):4 834-4 837.
[30]TAKAYOSHI A,ATSUKO A,MAKIKO W,et al.Catalytic asymmetric Friedel-Crafts/protonation of nitroalkenes and N-heteroaromatics[J].J.Org.Chem.,2011,76,5 450-5 456.
[31]JIA Y,YANGW,DU D M.Asymmetric Friedel–Crafts alkylation of indoles with 3-nitro-2H-chromenes catalyzed by diphenylamine-linked bis(oxazoline)and bis(thiazoline)Zn(II)complexesm[J].Org.Biomol.Chem.,2012,10:4 739-4 746.
[32]ZHOU J,TANG Y.Sidearm effect:improvement of the enantiomeric excess in the asymmetric Michael addition‡ of indoles to alkylidene malonates[J].J.AM.CHEM.SOC.,2002,124:9 030-9 031.
[33]SHOKO Y,YUKO I.Catalytic enantioselective Friedel-Crafts/Michael Addition reactions of indoles to ethenetricarboxylates[J].J.Org.Chem.,2006,71:739-743.
[34]WEN Y ,SHEN Q L,WAN X Y,et al.Enantioselective Friedel-Crafts alkylation of indoles with trifluoroethylidene malonates by Copper-Bis(oxazoline)complexes:construction of trifluoromethyl-substituted stereogenic tertiary carbon center[J].J.Org.Chem.,2011,76:2 282-2 285.
