骨髓间充质干细胞治疗新生重度缺氧缺血性脑损伤大鼠神经营养因子的表达
2014-07-18胡合珍滑蓉蓉安沂华王晓东
胡合珍,滑蓉蓉,安沂华,王晓东,
骨髓间充质干细胞治疗新生重度缺氧缺血性脑损伤大鼠神经营养因子的表达
胡合珍1,滑蓉蓉2,安沂华2,王晓东1,2
目的初步探讨骨髓间充质干细胞 (bone marrow mesenchymal stem cells,BM-MSCs)治疗新生重度缺氧缺血性脑损伤大鼠神经营养因子的表达及其与疗效的关系。方法60只6日龄SD大鼠被随机分为手术对照组(NS组)、空白对照组(BC组)和干细胞移植组(MSC组),每组20只,制备重度缺氧缺血性脑损伤大鼠模型。将BM-MSCs经体外培养、扩增后,经枕大池移植到MSC组模型大鼠的蛛网膜下腔中,NS组用相同体积的生理盐水代替BM-MSCs,BC组于模型建立后不进行任何移植。经上述处理后3、7、14、21 d对大鼠进行改良神经功能缺损评分(modified neurological severity scores,mNSS),同时收集大鼠脑脊液检测神经生长因子(nerve growth factor,NGF)、脑源性神经营养因子(brain-derived neurotrophic factor, BDNF)、神经营养素-3(neurotrophin-3,NT-3)、胶质细胞源性神营养因子(glia cell line-derived neurotrophic factor,GDNF)等神经营养因子的表达。结果MSC组及NS组大鼠在移植后第7、14和21天,其mNSS评分与移植前和移植后第3天相比较差异均有统计学意义(P<0.05)。MSC组、NS组及BC组移植后21 d mNSS评分分别为7.0±2.8、10.0±3.7和11.0±1.6。与第3天比较,BC组仅在移植后21 d出现差异并具有统计学意义(P<0.05),移植后7 d和14 d差异无统计学意义。脑脊液检测发现MSC组神经营养因子NGF、NT-3、BDNF及GDNF的表达较移植前有显著增加(P<0.05),而NS组和BC组表达反而减少(P<0.05)。结论经枕大池移植BM-MSCs对脑损伤大鼠神经功能恢复具有促进作用,推断NGF、NT-3、BDNF、GDNF等神经营养因子在其中起重要作用,其具体作用机制有待进一步研究。
骨髓间充质干细胞;缺氧缺血性脑损伤;神经营养因子;移植
骨髓间充质干细胞具有良好的自我更新能力和多分化潜能,以及迁移性、低免疫性、良好的组织融合性等特点,成为公认的组织修复与再生的种子细胞[1]。近年来,随着BM-MSCs研究的进展,神经营养因子在神经修复过程中越来越重要。本研究在新生重型缺氧缺血性脑损伤大鼠模型建立成功及体外成功培养出BM-MSCs之后,探讨BDNF、NT-3、NGF、GDNF等神经营养因子是否协同BM-MSCs参与脑损伤大鼠的脑损伤组织修复,改善其受损神经功能。
1 材料与方法
1.1 实验动物及分组 新生雌性Sprague-Dawley大鼠60只,体重13~17 g,由军事医学科学院动物所提供。将60只6日龄SD大鼠随机分为手术对照组(NS组)、空白对照组(BC组)和干细胞移植组(MSC组),每组20只。
1.2 实验材料制备 人BM-MSCs的培养、传代、鉴定[2]:获得骨髓标本后,制备细胞重悬液,接种于培养瓶中,于37 ℃、5% CO2恒温培养箱中培养,待细胞90%融合时以1∶3比例进行传代,流式细胞仪鉴定为BM-MSCs。
1.3 重度缺氧缺血性脑损伤大鼠模型的建立(改良Rice法) 10%水合氯醛按0.35 ml/100 g腹腔注射麻醉后,仰卧位手术台上固定四肢,手术区域消毒,颈正中线纵向切开皮肤,暴露皮下组织,以气管和右迷走神经为参照找到右侧颈总动脉,分离出血管后双重结扎,并从结扎线中间剪断血管,缝合切口。手术2 h后将大鼠置入密闭缺氧箱中(缺氧箱中连续2.5 h泵入92%N2+8%O2混合气体,气流量1 L /min)[3]。
1.4 BM-MSCs枕大池移植 在脑立体定位仪上操作,10%水合氯醛腹腔注射麻醉,大鼠头前倾位固定,在枕外粗隆和第一颈椎最高点之间的连线中点,微量进样器沿两耳连线的中点方向穿刺[4],感觉明显的落空感后回抽见清亮脑脊液,以100 μl/min注入BM-MSCs悬液100 μl。NS组用等量的生理盐水代替干细胞悬液。BC组则不进行任何移植。
1.5 改良神经功能缺损评分 分别于移植后3、7、14、21 d,对3组大鼠进行mNss[5]的评估。
1.6 神经营养因子检测及表达 分别于移植后3、7、14、21 d,利用干细胞移植相同方法分别对3组大鼠进行脑脊液收集,利用酶联免疫吸附测定法(enzyme-linked immunosorbent assay,ELISA)检测脑脊液中的NGF、NT-3、BDNF、GDNF等神经营养因子,用荧光定量PCR( realtime fluores-cence quantitative PCR,RT- PCR) 进行NGF、NT-3、BDNF、GDNF等神经营养因子表达检测。
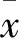
2 结 果
2.1 BM-MSCs体外培养 倒置显微镜下观察细胞生长情况和形态特征(图1)。
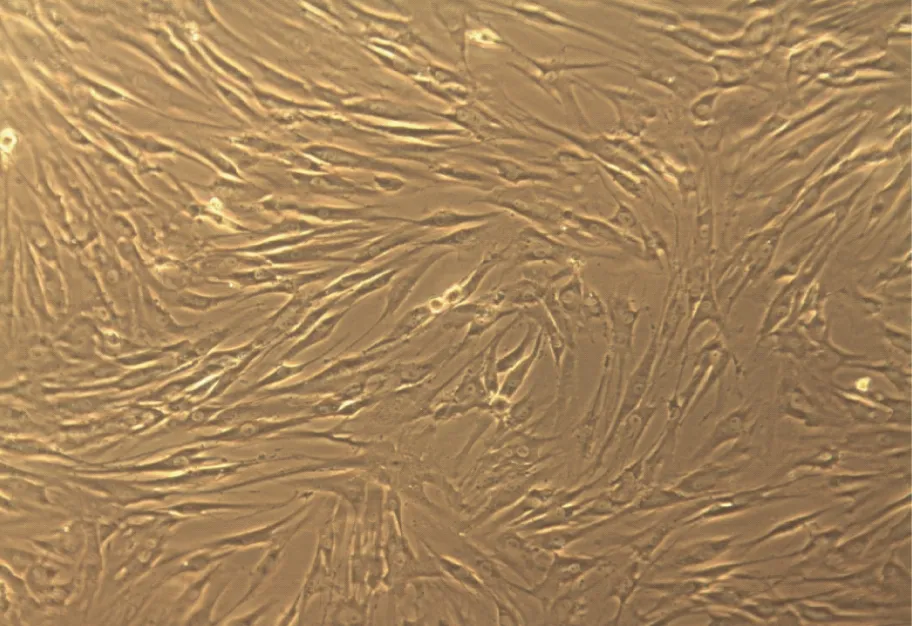
图1 BM-MSCs光镜观察(×100)培养48 h后光镜观察可见细胞增殖旺盛,呈“鱼群”样
2.2 模型大鼠的建立 建模手术后大鼠表现为固定向术侧旋转运动及术侧肢体瘫痪,表明改良Rice法建立重度缺氧缺血性脑损伤大鼠模型成功。
2.3 大鼠神经功能评价 表1结果显示,在脑损伤模型建立后及移植后3 d,3组大鼠mNSS评分均较高。MSC组与NS组在移植后7、14和21 d的评分较移植前和移植后3 d均有统计学差异(P<0.05),从移植后7 d开始,两组大鼠mNSS评分开始降低,且MSC组降分幅度大于NS组,术后21 d评分显示,MSC组与NS组、BC组相比均有统计学差异(P<0.05),NS组与BC组相比则差异不明显(P>0.05)。BC组移植后7 d和14 d与移植前和移植后3 d相比无明显变化,移植后21 d则差异明显(P<0.05,表1)。
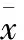
表1 3组缺氧缺血脑损伤大鼠移植前后mNSS评分比较 (n=20;±s)
注:与移植前相比,①P<0.05; NS组相比,②P<0.05; BC组相比,③P<0.05
2.4 RT-PCR检测NGF、NT-3、BDNF、GDNF的表达 模型建立后,3组大鼠脑脊液中NGF、NT-3、BDNF和GDNF在脑损伤刺激下均有所表达。MSC组各神经营养因子移植后第3天开始显著升高(P<0.05),术后7~14 d表达减少处于“表达低谷期”,但仍高于移植前的表达(P<0.05),第14~21天继续增加,在术后第21天仍处于明显高值(P<0.05)。NS组和BC组各神经营养因子表达为移植3 d后有明显增加(P<0.05),但在7~14 d“表达低谷期”各因子表达明显降低,均低于移植前(P<0.05),14~21 d因子表达较“表达低谷期”增加,但差异无统计学意义,且表达未高于移植前。MSC组较NS组、BC组,术后3 d及术后21 d因子表达均增高(P<0.05),NS组与BC组相比则无此表达趋势。见表2。
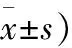
表2 3组大鼠移植前后NGF、NT-3、BDNF和GDNF神经营养因子表达比较 (n=20;
注:与移植前相比,①P<0.05;与移植后3 d相比,②P<0.05;与移植后7 d相比,③P<0.05;与移植后14 d相比,④P<0.05;与NS组相比,⑤P<0.05;与BC组相比,⑥P<0.05
3 讨 论
研究发现,BDNF缺乏的小鼠,其周围感觉神经元数量减少,前庭神经节严重变性[6];NT-3可以诱导神经突起的生长和促进神经递质合成关键酶的表达[7];NGF能提高基底前脑和纹状体胆碱能神经元的cAMP水平,增高胆碱乙酰移位酶的活性,并对这些神经元的生长和存活起重要作用[8];GDNF不仅能够促进多种神经元的存活和分化,对多巴胺神经元有明显的营养和促存活作用,减轻脑水肿,保护脑损伤后的神经元,还对精原细胞的再生和分化有决定作用,GDNF缺失的小鼠表现为干细胞数量的减少,而GDNF的过度表达导致未分化的精原细胞的累积[9]。
本研究成功建立新生重度缺氧缺血性脑损伤大鼠模型后,从体外培养出人 BM-MSCs,通过枕大池移植途径,移植于脑损伤模型大鼠蛛网膜下腔,进入脑脊液循环。在一些趋化因子的作用下向损伤部位聚集而发挥作用,从而避免脑内原位移植带来的二次损伤,减少损伤灶内的炎性因子、血凝块等不利于移植后的BM-MSCs存活、生长的因素刺激[10]。于移植后不同时间点评估神经功能改善情况并检测NGF、BDNF、GDNF、NT-3等神经营养因子的表达。
mNSS评分结果中MSC组及NS组评分于移植后均降低,但MSC组变化程度大,说明给予脑损伤大鼠在移植的干细胞刺激下,大鼠神经功能恢复速度更快,受损功能改善更多,干细胞对于改善缺氧缺血性脑损伤大鼠的神经功能具有非常明显的作用。BC组的评分结果在移植后21 d出现明显变化,说明大鼠在缺氧缺血性脑损伤后,神经功能障碍存在一定程度的自身恢复,但是恢复所需时间较长,改善程度小。本实验中大鼠脑损伤后神经功能恢复的主要机制可能有以下几个方面:(1)BM-MSCs在脑内特化成神经组织,替代损伤的细胞,重建神经环路[11];(2)移植的BM-MSCs细胞在脑内激活内源性修复反应或分泌神经因子给宿主细胞提供营养支持;(3)骨髓细胞中包含有血管内皮细胞,缺血性损伤能刺激血管内皮祖细胞从骨髓中被动员到外周血中,归巢、汇集到缺血组织中,分化成内皮细胞,形成新血管[12];(4)自体脑内的神经干细胞在脑损伤后可能也发挥着积极的作用。本研究中,最长观察时间为移植后21 d,由于观察时间有限,不能很好说明干细胞移植后体内发挥作用的长期性及稳定性,这将是后续研究的重点。
研究证明,移植的BM-MSCs对缺氧缺血性脑损伤的大鼠的神经功能有明确的改善作用。其作用机制主要有“替代学说”和“营养学说”。“替代学说”:BM-MSCs移植后可以分化为神经元并和宿主原有神经细胞建立联系,从而改善神经功能[13]。“营养学说”:BM-MSCs移植后主要是通过分泌某些神经营养物质,起到神经保护的作用,而使神经功能得到改善[14]。但是具体机制仍在进一步研究中。实验证明,这些神经营养因子可以快速激活休眠的干细胞并促使其生长,同时可以调节机体内微环境,为干细胞提供有利的生长条件[15]。神经营养因子对中枢及周围神经元的发育、分化、生长、再生和功能特性的表达均具有重要的作用[16]。但是正常脑组织内神经营养因子的表达很少,无法在脑损伤后对受损神经元起到足够的修复与保护作用。
本研究中MSC组各神经营养因子表达于移植后第3天开始升高,术后第21天仍处于明显高值。说明BM-MSCs移植后,对体内神经营养因子的表达有正性刺激作用,以协助BM-MSCs共同修复受损神经。出现“表达低谷期”的可能机制是由于在移植前3 d损伤组织处于急性水肿期,刺激导致内源性因子分泌均显著增加,水肿逐渐吸收后,刺激因素的消失使各因子分泌逐渐处于平稳[17]。由于收集样本量较小,各神经营养因子在各组中的具体变化不能进一步更好地阐述。
本实验将BM-MSCs移植入缺氧缺血脑损伤大鼠后,结果显示神经营养因子分泌增加,协同BM-MSCs促进受损神经元的修复,相应的神经功能评分也较移植前改善。(1)BM-MSCs移植后分泌外源性神经营养因子,使局部微环境得到改善,促进外源性BM-MSCs的存活、增殖和分化,神经元和神经胶质的增加,使神经营养因子表达增多[18];(2)BM-MSCs移植后分泌的神经营养因子可能通过自分泌、旁分泌方式促进内源性和外源性BM-MSCs的增殖,分化为新的神经元、星形胶质细胞和少突胶质细胞,细胞数量的增多促进神经营养因子的表达增多[19];(3)损伤的脑组织自身产生的各种营养因子促进内源性、外源性BM-MSCs的增殖和分化,从而促进神经营养因子的表达[20-24]。
[1] Wang H,Wu M, Liu Y. Mesenchymal stem cells major sources of safe signals in immune system[J]. Cell Immun,2012, 272(2):112-116.
[2] Vadala G,Studer R K,Sowa G,etal.Coculture of bone marrow mesenchymal stem cells and nucleus pulpous cells modulate gene expression profile without cell fusion[J].Spine, 2008,33(8):870-876.
[3] 刘建新,王晓峰,张荣军,等.经枕大池移植神经干细胞治疗重型颅脑损伤大鼠的实验研究[J].临床神经外科杂志,2012,3(9):133-135.
[4] Satoshi O S, James E G. Multiple cell populations in the early postnatal sub ventricular zone take distinct migratory pathways: a dynamic study of glial and neuronal progen it or migration[J].Neuro,2003, 23: 4240-4250.
[5] Wu J S, Dong A P, Wang X C,etal.Bone marrow mesenchymal stem cell transplantation in the repair of rat spinal cord hemi section injury[J]. Acta Lab Anim Sci Sin, 2010, 18(1):198-207.
[6] Kim S J , Choi S W , Hur K J,etal.Synergistic effect of mesenchymal stem cells infected with recombinant adenovirus expressing human BDNF on erectile function in a rat model of cavernous nerve injury[J].Korean Urol,2012,53 (10): 726-732.
[7] Huang Z Y, Hong L Q, Na N,etal.Infusion of mesenchymal stem cells over expressing GDNF ameliorates renal function in nephrotoxic serum nephritis [J].Cell Biochem Funct, 2012, 30 (2): 139-144.
[8] Motoyoshi Y A, Tamura M, Moriyama M,etal.Activation of cultured atrocities by amphotericin B: Stimulation of NO and cytokines production and changes in neurotrophic factors production [J].Neurochem Int, 2013, 5:232-240.
[9] Yang C,Zhou L,Gao X.Neuroprotective effects of bone marrow stem cells over expressing glial cell line-derived neurotrophic factor on rats with intracerebral hemorrhage and neurons exposed to hypoxia deoxygenating[J].Neurosurgery,2011, 68:691-699.
[10] Benjamin Y,Castillo M. Hypoxic-ischemic brain injury:imaging findings from birth to adulthood[J]. Radiographics,2008,28(2):417-439.
[11] Sacchetti B, Funari A, Michienzi S,etal. Self-renewing osteoprogenitors in bone marrow sinusoids can organize a hema-topoietic microenvironment[J].Cell, 2007,131(2):324-336.
[12] Traggiai E, Volpi S, Schena F,etal. Bone marrow-derived mesenchymal stem cells induce both polyclonal expansion and differentiation of B cells isolated from healthy donors and systemic lupus erythematosus patients[J].Stem Cells,2008,26(2):562-569.
[13] Chen W H, Liu H Y, Lo W C,etal. Intervertebral disc regeneration in an ex vivo culture system using mesenchymal stem cells and platelet-rich plasma[J]. Biomaterials,2009,7(19):1-11.
[14] Chongran S,Han Z ,Jin L,etal.Modulation of the major histocompatibility complex by neural stem cell-derived neurotrophic factors used for regenerative therapy in a rat model of stroke[J].J Transl Med,2010,8:77-83.
[15] Lovell M A,Geiger H,Van Zant G E,etal.Isolation of neural precursor cells from Alzheimer's disease and aged control postmortem brain[J].Neurobiol Aging,2006,27(7):909-917.
[16] Song J,Lee S T,Kang W,etal.Human embryonic stem cell-derived neural precursor transplants attenuate apomorphine-induced rotational behavior in rats with unilateral quinolinic acid lesions[J].Neurosci Lett ,2007,423(1):58-61.
[17] Chu K, Kim M, Park K I ,etal. Human neural stem cells improve sen sori motor deficits in the adult rat brain with experi mental focal ischemia[J]. Brain Res ,2004 , 1016 : 145-153.
[18] Titomanlio L, Kavelaars A, Dalous J,etal. Stem cell therapy for neonatal brain injury: perspectives and challenges[J].Ann Neurol,2011,70(5), 698-712.
[19] Shi W.BDNF blended chitosan scaffolds for human umbilical cord MSC transplants in traumatic brain injury therapy[J].Biomaterials,2012,33:3119-3126.
[20] Li Y, Chopp M, Chen J,etal.Intrastriatal transplantation of bone marrow nonhematopoietic cells improves functional recovery after stroke in adult mice[J]. J Cerebr Blood Met,2000, 20(9):1311-1319.
[21] Rempe D A, Kent T A. Using bone marrow stromal cells for treatment of stroke[J]. Neurology,2002, 59(4): 486-487.
[22] Cao Q,Benton R L,Whitomore S R.Stem cell repair of central nervous system injury[J].J Neuroscience RES,2002,68(5):501-510.
[23] Trope P, Noel D, Platet N. Isolation and characterization of mesenchymal stem cells from adult mouse bone marrow[J]. Exp Cell Res,2004,29(5): 395-406.
[24] Prabhakaran M P, Venugopal J R, Ramakrishna S.Mesenchymal stem cell differentiation to neuronal cells on electrospun nanofibrous substrates for nerve tissue engineering[J]. Biomaterial,2009, 30: 4996-5008.
(2014-03-01收稿 2014-04-20修回)
(责任编辑 梁秋野)
Expressionofneurotrophicfactorsintherapyofbonemarrowmesenchymalstemcellstonewbornratswithseverehypoxicischemicbraindamage
HU Hezhen1,HUA Rongrong2,AN Yihua2,and WANG Xiaodong1,2. 1. Clinical institute of Chinese People’s Armed Police Forces General Hospital of Anhui Medical University,Beijing 100039,China; 2.Stem Cell Department, General Hospital of Chinese People’s Armed Police Forces,Beijing 100039,China
ObjectiveTo study the expression changes in nerve growth factor (NGF) and brain derived neurotrophic factor (BDNF) and nerve nutriment-3 neurotrophin-3 (NT-3), glia cell line - derived neurotrophic factor (GDNF) in the process of bone marrow mesenchymal stem cells (BM-MSCs) therapy to newborn rats with severe hypoxic ischemic brain damage and relationship with improvement of neural function.MethodsThe rat models of severe hypoxic ischemic brain damage developed by the right common carotid artery ligation +oxygen deficit(number=60)were divided into stem cell treatment group(MSC group, number=20), the operation control group(NS group, number=20)and blank control group(BC group, number=20) randomly.We transplanted BM-MSCs cultured and amplified in vitro into cerebrospinal fluid of model rats through cisterna magna. Movement of rats was assessed with modified Neurological Severity Scores (mNSS) at day 3, day 7, day 14 and day 21 after transplantation.NS group used the same volume of normal saline instead of BM-MSCs and mNSS evaluation time and method was the same as in MSC group. We established BC group the model with no transplantation and mNSS evaluation time and method was the same with MSC group,examined the expressions of NGF, BDNF, NT - 3and GDNF collected from rats, cerebrospinal fluid at day 3, day 7, day 14 and day 21 after transplantation.ResultsThere was significant difference in mNSS scores between MSC group and NS group at day 7, day 14 and day 21 after transplantation(P<0.05);Scores in MSC group, NS group and BC group were 7±2.8、10±3.7 and 11±1.6, respectively.And BC group had a variation only in day 21 after transplantation(P<0.05). And there was apparent increase in the expression of neurotrophic factors in MSC group at day 3, day 7, day 14 and day 21 after transplantation by cerebrospinal fluid detection(P<0.05).ConclusionsBM - MSCs can promote recovery of neurological function in brain injury rats. NGF、NT-3、BDNF and GDNF play an important role in the process of the recovery of neural function,but the specific mechanism needs further research.
bone marrow mesenchymal stem cells; hypoxic-ischemic brain damage; neurotrophic factor; transplant
国家教育部出国留学回国人员启动基金(2011001);广东省战略性新兴产业关键技术攻关项目(2011A081401003)
胡合珍,硕士研究生,E-mail: luoboshidai@163.com
1. 100039北京,安徽医科大学武警总医院临床学院;2. 100039北京,武警总医院细胞移植科
王晓东,E-mail:xdwang2000@163.com
R457.7
