UPLC-QTOF MS法比较赤芍、白芍煎液化学成分差异
2014-07-18练杭芸徐王彦君梁乾德马增春王宇光汤响林谭洪玲肖成荣
练杭芸,徐王彦君,梁乾德,马增春, 王宇光,汤响林, 谭洪玲, 肖成荣, 高 月
(1. 安徽医科大学研究生学院,安徽 合肥 230032;2. 军事医学科学院放射与辐射研究所,北京 100850)
UPLC-QTOF MS法比较赤芍、白芍煎液化学成分差异
练杭芸1,徐王彦君1,梁乾德2,马增春2, 王宇光2,汤响林2, 谭洪玲2, 肖成荣2, 高 月2
(1. 安徽医科大学研究生学院,安徽 合肥 230032;2. 军事医学科学院放射与辐射研究所,北京 100850)
为了解中药赤芍和白芍煎液的化学成分差异,采用UPLC-QTOF MS技术对市场上正规销售的赤芍和白芍饮片样品进行分析比较,并用主成分分析和正交偏最小二乘辨别分析进行数据统计,同时采用与标准品比较、基于自制自动化预鉴别软件的一级质谱精确质荷比分析和二级质谱碎片分析进行成分鉴别。结果表明,氧化芍药苷和芍药内酯苷分别是赤芍和白芍煎液最重要的差异性化合物。此外,赤芍药苷、1’-O-benzoylsucrose、牡丹皮苷F、牡丹皮苷C/苯甲酰羟基芍药苷、牡丹皮苷E、(1S,2S,4R)-trans-2-hydroxy-1,8-cineole-B-D-glucopyranoside、蔗糖、没食子酰芍药苷/没食子酰芍药内酯苷等在赤芍、白芍煎液中的含量差异明显。
LC/MS; 赤芍; 白芍; 煎液; 化学成分
常用中药赤芍、白芍的基源和药性相似,但临床用途明显不同[1]。虽然古代医家有“白补而赤泻,白收而赤散”[2]的说法,但现代研究对于两药的药理作用差异尚未给出明确的结论,有些研究结果甚至相反[3-9],显然通过比较药理作用而揭示两药差异还需要深入研究。任何药理作用总有其物质基础,两药间的一种或几种差异的化学成分很可能就是两药药理作用差异的决定因素。因此,通过比较西药的化学成分差异,在一定程度上可对了解其药理差异给出有益的提示。但比较两种中药的化学成分差异并非易事。目前,探索赤芍、白芍化学成分差异多采用比较基于紫外检测器的色谱指纹图谱,再以数量有限的几种标准品进行峰的指认技术[10-14]。受分辨能力、标准品数量等限制,该方法所获得的信息较少。最近,南京中医药大学的研究团队率先将超高效液相色谱-四极杆飞行时间质谱(UPLC-QTOF MS)技术运用于这个领域[15]。超高效液相色谱和高分辨质谱相结合可以使不同化学成分更好地相互区分,并且检测到的精确质荷比数据使得在没有标准品的情况下也能获得关于化合物结构的重要提示,因此获得的信息较传统方法更丰富。本研究拟采用UPLC-QTOF MS技术研究赤芍、白芍的化学成分差异,与上述研究团队不同的是样品均来自北京市场,考察对象是两药的煎液(考虑到临床用药以水煎为主,样品制备采用饮片水煎后乙醇沉淀)。另外,除了与标准品比较进行成分鉴别外,同时使用本实验室自制的自动化预鉴别软件进行一级质谱精确质荷比数据鉴别,以多种可能的离子形态进行自动化结构预判,并进行二级质谱碎片分析以提高鉴别结果的可信度。
1 实验部分
1.1 药材和试剂
赤芍、白芍饮片:随机购自北京6家正规药店;芍药内酯苷、芍药苷标准品:购自中国药品生物制品检定所;蔗糖(分析纯):西陇化工股份有限公司产品;甲酸(HPLC级):德国CNW Technologies GmbH公司产品;乙腈(HPLC级):美国Fisher Scienific公司产品;超纯水由Millipore超纯水系统制备。
1.2 样品制备
精密称取20 g白芍或赤芍饮片,第一煎加160 mL水,浸泡1 h后煎30 min,过滤,第二煎加100 mL水,煎20 min,过滤,合并两煎煎液。加水至200 mL,混匀后取20 mL逐滴加入至80 mL乙醇中,减压抽滤,滤液在低于50 ℃下减压浓缩至1 mL左右,用50%乙腈溶液转移并定容至25 mL容量瓶中。芍药苷、芍药内酯苷和蔗糖标准品以50%乙腈溶液溶解。样品溶液经0.22 μm微孔滤膜过滤后进样分析。
1.3 UPLC-QTOF MS条件
1.3.1 色谱条件 样品分析使用Acquity UPLC与Synapt HD-QTOF-MS联用系统。Waters Acquity HSS T3 色谱柱(100 mm × 2.1 mm ×1.8 μm),配备Vanguard HSS T3保护柱;柱温30 ℃;梯度洗脱溶剂:A为含0.1%甲酸的水溶液,B为含0.1%甲酸的乙腈溶液;洗脱过程:2%B(0~1 min),2%~5%B(1~2 min),5%~12%B(2~5 min),12%~20%B(5~10 min),20%~30% B10~12 min),30%~50%B(12~13 min),50%~100%B(13~15 min),100%B(15~16 min);流速0.5 mL/min;进样量2 μL。
1.3.2 质谱条件 电喷雾电离(ESI)离子源,V模式检测,质量扫描范围m/z50~1 500,毛细管电压分别为3 kV(正离子模式)和2.9 kV(负离子模式),样品锥电压40 V,提取锥电压4 V,源温100 ℃,脱溶剂气温度450 ℃,脱溶剂气流速900 L/h,锁校质荷比(lock mass)分别为m/z556.277 1(正离子模式)和m/z554.261 5(负离子模式)。数据采集控制和分析软件为MassLynx(V4.1),包含MarkerLynx数据分析模块。
1.4 主成分分析(PCA)和正交偏最小二乘辨别分析(OPLS-DA)
用MassLynx软件中的MarkerLynx模块分别对全部样品正离子和负离子模式的UPLC-QTOF MS原始数据进行峰检测、然后进行PCA和OPLS-DA分析。其中强度阈值50,质量窗口0.05,保留时间窗口0.2。PCA和OPLS-DA分析的数据标准化方法为Pareto。
1.5 芍药属植物化学成分文献数据库
用CNKI和Medline等工具检索芍药属植物化学成分的文献。将化合物分子式、化学名称等信息录入Excel表,约200项。将每个化合物的分子式用本实验室自制软件进行元素拆解计数,计算出正离子模式下常见离子[M+H]+、[M+NH4]+、[M+Na]+、[M+K]+、[2M+H]+、[2M+H+K]2+和负离子模式下常见离子[M-H]-、[M+HCOO]-、[2M-H]-、[M+Cl]-,共计10种离子形态的精确质荷比数值,从而建立可用于自动化预鉴别的芍药属植物化学成分文献数据库。
1.6 Marker的鉴别
将芍药苷标准品、芍药内酯苷、蔗糖溶液在相同分析条件下获得的数据与待鉴别Marker数据进行比较(包括保留时间和质谱特征),以确定Marker中是否含有这些化合物。将待鉴别Marker的保留时间和质荷比数据与上述数据库的数据拷贝于同一Excel表。用本实验室自制的Searcher软件进行批量自动化预鉴别,实测数据与数据库数据的质荷比偏差不大于10-5,即认定为相匹配。对全部待鉴别Marker进行MS/MS分析,根据碎片离子质荷比信息,对预鉴别提示的化学结构进行验证。
1.7 重要Marker信号强度比较
2 结果与讨论
2.1 典型色谱图
赤芍和白芍样品在正离子和负离子模式下的UPLC-QTOF MS基峰强度离子流图(BPI)示于图1。
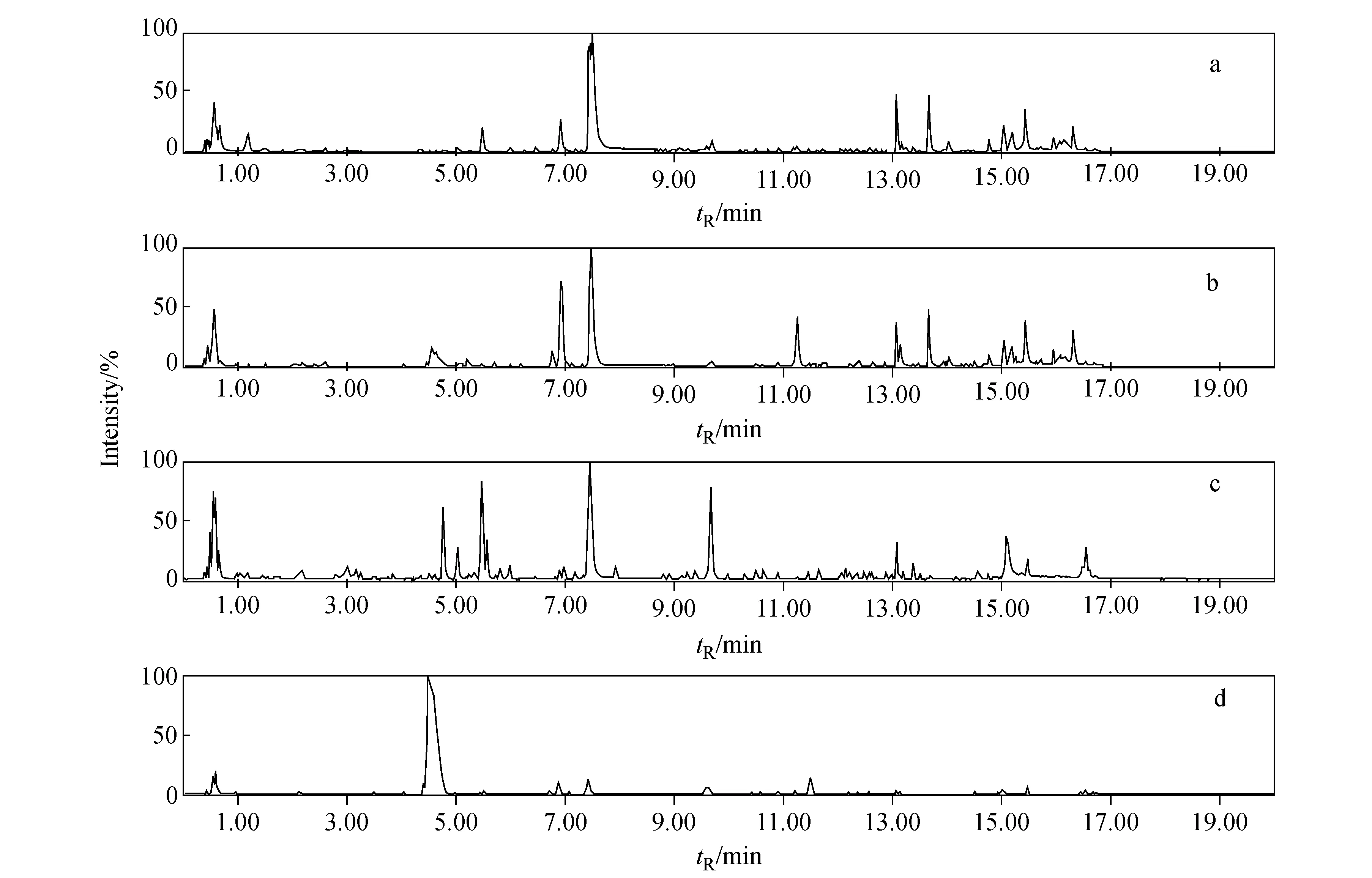
注:a.赤芍(正离子谱);b.白芍(正离子谱);c.赤芍(负离子谱);d.白芍(负离子谱)图1 赤芍和白芍样品的典型UPLC-QTOF MS基峰强度离子流(BPI)色谱图Fig.1 Typical UPLC-QTOF MS base peak intensity(BPI) chromatogram of Radix Paeoniae Rubra and Radix Paeoniae Alba samples
2.2 PCA分析
赤芍和白芍样品在正离子和负离子模式下的UPLC-QTOF MS数据PCA分析的得分图示于图2a和2b。每个点代表一个样品,横、纵坐标分别为第一、第二主成分得分。可以看出,无论是正离子模式还是负离子模式,赤芍和白芍样品均在第一主成分得分上有明显差异,即分别聚向横轴的相反方向,表明二者UPLC-QTOF MS数据的差异特征明显。
2.3 OPLS-DA分析
赤芍和白芍样品在正离子和负离子模式条件下的UPLC-QTOF MS数据OPLS-DA分析的S图示于图2c和2d。每个点代表一个变量,即位于某个保留时间的某个质荷比的信号强度。横坐标代表变量的贡献度(协方差),纵坐标代表变量的相关性(可信度),在-1~1之间取值[16]。无论是横坐标还是纵坐标,正方向代表赤芍组信号强于白芍组,负方向代表白芍组信号强于赤芍组。越靠近S形点集两端的点,其信号强度在两组间有差异的特征越明显。图中红色方框所标记的点是以“横坐标绝对值> 0.001,纵坐标绝对值> 0.8”为标准选择出的差异性信号,共107个,其中正离子模式67个,负离子模式40个。
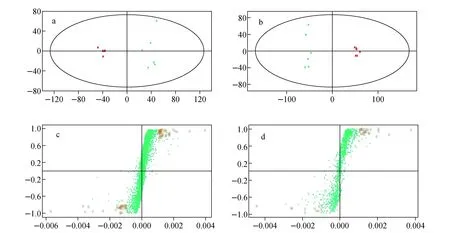
注:a.正离子PCA得分图;b.负离子PCA得分图;▲为赤芍样品,■为白芍样品; c.正离子OPLS-DA的S图;d.负离子OPLS-DA的S图;红色方框所标记的点是选择出的差异性信号图2 赤芍和白芍样品UPLC-QTOF MS的PCA得分图和OPLS-DA的S图Fig.2 Score plot from PCA and S-Plot from OPLS-DA of Radix Paeoniae Rubra and Radix Paeoniae Alba samples
2.4 鉴别
对Marker的鉴别包括与标准品比较、一级质谱精确质荷比与文献化合物数据库比较、二级质谱碎片分析三方面。共考察了芍药苷、芍药内酯苷和蔗糖3种标准品。一级质谱精确质荷比的比较采用本实验室自主研制的自动化预鉴别(结构预判)软件[17],这是因为这种预鉴别的工作量极大,具体表现在3个方面:1)电喷雾离子化过程中的化合物会形成多种形态的离子。除可能形成准分子离子([M+H]+、[M-H]-)外,通常还会形成加合物离子和聚合物离子(如[M+NH4]+、[M+Na]+、[M+K]+、[2M+H]+、[2M+H+K]2+、[M+HCOO]-、[2M-H]-、[M+Cl]-等),以及源内裂解碎片离子。因此,必须将质谱信号假定为多种可能的离子形态(碎片离子除外),推算出多种可能的精确分子质量,并分别与数据库数据进行比较,才能较好地减少预鉴别的错误和遗漏。2)数据库化合物的数量巨大,本研究所建立的芍药属植物化学成分文献数据库收集的化合物数量约200种。3)样品中待鉴别数据量大,本研究的待鉴别Marker达107个。由此可见,依据一级质谱精确质荷比和数据库进行结构预判的工作量极大,人工完成的难度很大,有必要借助计算机来自动化完成。在没有标准品的情况下,化合物二级质谱碎片信息可以在一定程度上验证一级质谱精确质荷比的结构预判结果,提高鉴别结果的可信度。一级质谱精确质荷比的比较和二级质谱碎片分析的结果列于表1。
与Marker鉴别有关的化合物的化学结构式示于图3。
目前,“功能性食品”课程的主要教学单元包括:功能性食品基础篇;氨基酸、活性肽、活性蛋白质及其加工技术篇;功能性碳水化合物及其加工技术篇;活性油脂及其加工技术篇;其他功能性物质及其加工技术篇和强化食品及其加工技术篇6个方面,目前课程的授课方式是先进行理论讲解,然后进行相关的实验实训。在理论讲解的授课过程中,与实际生活不够贴切,学生提不起学习兴趣,有些知识点达不到良好的教学效果。

图3 与Marker鉴别有关的化合物的化学结构式Fig.3 Chemical structures involved in Marker identification
2.4.1 芍药苷(paeoniflorin) 全部选出的Marker中没有与芍药苷标准品保留时间(7.48 min)一致的信号,表明芍药苷在赤芍、白芍两组间的含量差异并不明显。
2.4.2 芍药内酯苷(albiflorin) 芍药内酯苷[18]标准品在6.9 min和11.2 min各有一个色谱峰,前者峰高约是后者的2~3倍,2个色谱峰的一级质谱和主要离子的二级质谱均非常相似(图谱略),因此可能是结构相似的异构体,但也不排除生成了复合物的可能。在所选出的Marker中,这2个时间点也都有符合芍药内酯苷特征的信号。这里将对应的化合物分别称为“芍药内酯苷1”和“芍药内酯苷2”。其中保留时间为6.9 min的芍药内酯苷1有信号67、100、103、106、107,保留时间为11.2 min的芍药内酯苷2有信号51、66。所有一级质谱信号的强度都是白芍组高于赤芍组,表明芍药内酯苷含量高是白芍煎液区别于赤芍煎液的重要特征。
2.4.3 氧化芍药苷(oxypaeoniflorin)或其异构体 文献报道的氧化芍药苷[18]异构体有2种。在5.5 min和7.9 min均出现了质荷比与氧化芍药苷一致的信号,前者峰高约是后者的5倍。这里将对应的化合物分别称为“氧化芍药苷1”和“氧化芍药苷2”。两者的二级质谱相似,可能是结构相似的异构体。保留时间为5.5 min的氧化芍药苷1有信号1、25、68、87,保留时间为7.9 min的氧化芍药苷2有信号83。所有一级质谱信号的强度都是赤芍组高于白芍组,说明赤芍煎液的氧化芍药苷含量高于白芍煎液。
2.4.4 蔗糖(sucrose)或其异构体 信号35(保留时间为0.55 min)与蔗糖的[M+K]+匹配,保留时间与蔗糖标准品(保留时间为0.58 min)一致,赤芍组的信号强度高于白芍组,说明赤芍煎液的蔗糖含量高于白芍煎液。
2.4.5 赤芍药苷(8-debenzoylpaeoniflorin)或其异构体 信号2和11均与赤芍药苷[19]的[M+Na]+匹配。这里将对应的化合物分别称为“赤芍药苷1”和“赤芍药苷2”。二者可能是结构相似的异构体。信号强度均为赤芍组高于白芍组,说明赤芍煎液中赤芍药苷含量高于白芍煎液。
2.4.6 牡丹皮苷F(mudanpioside F)或其异构体 信号8与牡丹皮苷F[20]的[M+Na]+匹配,赤芍组强度高于白芍组,说明赤芍煎液中牡丹皮苷F含量高于白芍煎液。
2.4.7 牡丹皮苷E(mudanpioside E)或其异构体
信号32和93分别与牡丹皮苷E[20]的[M+Na]+和[M-H]-匹配,强度均为赤芍组高于白芍组,说明赤芍煎液中牡丹皮苷E含量高于白芍煎液。
2.4.8 1’-O-benzoylsucrose或其异构体和未知化合物1 信号4和59均与1’-O-benzoylsucrose[21]的[M+Na]+匹配。信号4的MS/MS显示存在单糖结构,而信号59的MS/MS不支持存在单糖结构,这里称为“未知化合物1”。赤芍组的信号4强度高于白芍组,而信号59的强度则相反,说明赤芍煎液中1’-O-benzoylsucrose含量高于白芍煎液,而未知化合物1在白芍煎液中的含量高于赤芍煎液。
2.4.9 (1S,2S,4R)-trans-2-Hydroxy-1,8-cineole-B-D-glucopyranoside或其异构体 信号34与(1S,2S,4R)-trans-2-Hydroxy-1,8-cineole-B-D-glucopyranoside[22]的[M+Na]+匹配,赤芍组强度高于白芍组,说明赤芍煎液中该化合物含量高于白芍煎液。
2.4.10 没食子酰芍药苷(galloylpaeoniflorin)/没食子酰芍药内酯苷(galloylalbiflorin)或其异构体 信号56与没食子酰芍药苷/没食子酰芍药内酯苷[23]的[M+Na]+匹配,白芍组强度高于赤芍组,说明白芍煎液中没食子酰芍药苷或没食子酰芍药内酯苷含量高于赤芍煎液。
2.4.11 牡丹皮苷C(mudanpioside C)/苯甲酰羟基芍药苷(benzoyloxypaeoniflorin)或其异构体 牡丹皮苷C[20]和苯甲酰羟基芍药苷[24]互为异构体。信号24和80分别与其[M+Na]+和[M-H]-匹配,强度均为赤芍组高于白芍组,说明赤芍煎液中牡丹皮苷C或苯甲酰羟基芍药苷含量高于白芍煎液。
2.4.12 未知化合物2 信号33和95分别与分子式为C31H34O14的化合物[M+Na]+和[M-H]-匹配。数据库中,6'-O-benzoyl-4''-hydroxy-3"-methoxy-paeoniflorin[25]和牡丹皮苷B(mudanpioside B)[20]与此分子式相符,但信号95的MS/MS碎片信息均不支持,因此这里称为“未知化合物2”。信号强度均为赤芍组高于白芍组,表明赤芍煎液中该化合物含量高于白芍煎液。
2.5 差异化合物的贡献度排序
在OPLS-DA的S图中,其横坐标的绝对值显示了变量(信号)对模型的贡献度大小[16]。绝对值越大,贡献度越大。正方向代表赤芍组信号强度高于白芍组,负方向反之。因此,为了探讨各个被鉴别化合物的重要性大小,将它们的对应Marker按照横坐标数值进行排序。信号强度为赤芍组高于白芍组的化合物:氧化芍药苷1>赤芍药苷1>1-O-benzoylsucrose>牡丹皮苷F>赤芍药苷2>牡丹皮苷C/苯甲酰羟基芍药苷> 氧化芍药苷2>牡丹皮苷E>未知化合物2>(1S,2S,4R)-trans-2-Hydroxy-1,8-cineole-B-D-glucopyranoside > 蔗糖;信号强度为白芍组高于赤芍组的化合物:芍药内酯苷1>芍药内酯苷2>未知化合物1>没食子酰芍药苷/没食子酰芍药内酯苷。可以看出,“赤芍组含量高于白芍组”的特征所涉及的化合物较多,而“白芍组含量高于赤芍组”的化合物相对较少,这可能与白芍药材在“煮和去皮”等加工过程中有多种化学成分流失有一定关系。氧化芍药苷和芍药内酯苷分别是赤芍组和白芍组最重要的差异性化合物,二者信号强度的比较示于图4。
在文献[15]中也发现氧化芍药苷和芍药内酯苷分别在赤芍和白芍中含量高,这与本研究的结果一致。但其报道中提到二者并不是贡献度最大的,这可能与药材的产地以及分析过程中样品的前处理方法不同等因素有关。同样,文献[11]也发现白芍中芍药内酯苷峰的面积远高于赤芍。
2.6 药理学意义
关于赤芍、白芍中单体化学成分的药理学研究还较少。本研究发现,氧化芍药苷和芍药内酯苷分别是赤芍和白芍煎液中最重要的差异化学成分,因此比较其药理作用有助于发现赤芍和白芍的功效差异。从已有的研究报道[26-33]分析,芍药内酯苷对中枢神经系统的作用(抗惊厥、镇痛)较明确,氧化芍药苷的抗炎作用较明确。那么,白芍的某些功效特点,如“柔肝止痛”,会不会与芍药内酯苷的中枢神经系统作用有关?赤芍某些功效特点,如“清热凉血”,会不会与氧化芍药苷的抗炎作用有关?要回答上述猜测,以及最终阐明赤芍和白芍功效差异的本质,还必须直接比较各差异性化合物的药理作用。
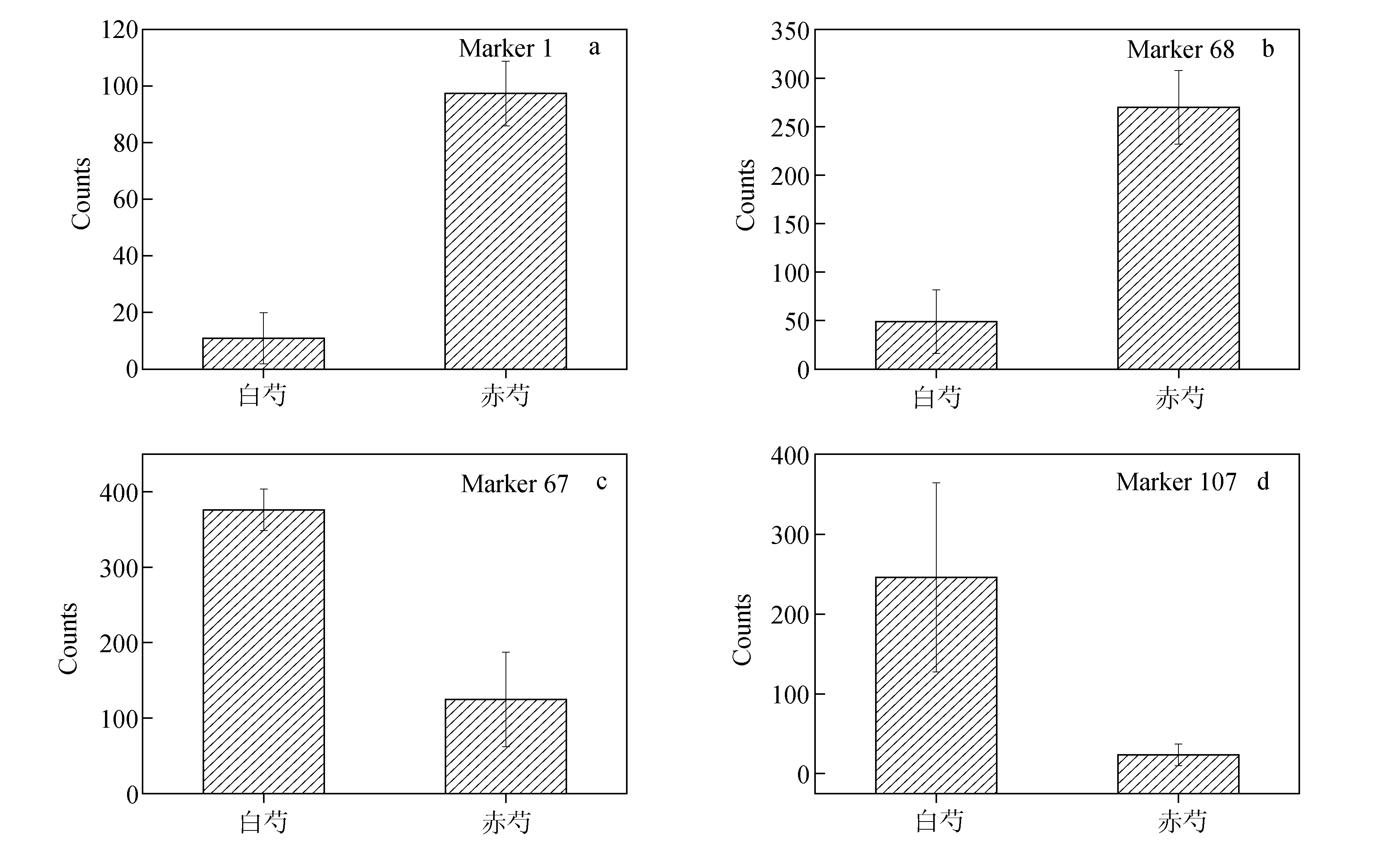
图4 氧化芍药苷(a,b)和芍药内酯苷(c,d)的信号强度比较Fig.4 Comparison of signal intensities of oxypaeoniflorin (a,b)and albiflorin(c,d)
3 结论
氧化芍药苷和芍药内酯苷分别是赤芍和白芍煎液最重要的差异性化合物。此外,赤芍药苷、1’-O-benzoylsucrose、牡丹皮苷F、牡丹皮苷C/苯甲酰羟基芍药苷、牡丹皮苷E、(1S,2S,4R)-trans-2-Hydroxy-1,8-cineole-B-D-glucopyranoside、蔗糖、没食子酰芍药苷/没食子酰芍药苷等在赤芍、白芍煎液中的含量差异明显。这为探讨赤芍、白芍化学成分及药效差异提供了参考。
[1] 国家药典委员会. 中华人民共和国药典(一部)[M].北京: 化学工业出版社, 2005: 79, 125.
[2] 杨 柳, 许舜军, 吴金雄, 等. 白芍、赤芍的比较研究概况[J]. 中药新药与临床药理, 2011, 22(5): 577-580. YANG Liu, XU Shunjun, WU Jinxiong, et al. Study on differences betweenRadixPaeoniaeAlbaandRadixPaeoniaeRubra[J].Traditional Chinese Drug Research & Clinical Pharmacology, 2011, 22(5): 577-580(in Chinese).
[3] 周 丹, 韩大庆, 刘 静, 等. 白芍、赤芍及卵叶芍药滋补强壮作用的研究初探[J]. 吉林中医药, 1993, 2(2): 38-39. ZHOU Dan, HAN Daqing, LIU Jing, et al. Studies on the nourshing and strengthening effects ofRadixPaeoniaeAlba、RadixPaeoniaeRubraand Paeonia obovata Ma-xim[J]. Jilin Journal of Traditional Chinese Medicine, 1993, 2(2): 38-39(in Chinese).
[4] 李 强, 周 荣, 杨伟鹏, 等. 赤芍、白芍补血作用比较研究(Ⅰ) [J]. 中医药信息, 2010, 27(6): 112-114. LI Qiang, ZHOU Rong, YANG Weipeng, et al. Comparative study on the effects of blood enriching ofRadixPaeoniaeRubraandRadixPaeoniaeAlba(Ⅰ) [J]. Information on Traditional Chinese Medicine, 2010, 27(6): 112-114(in Chinese).
[5] 李 强, 周 荣, 杨伟鹏, 等. 赤芍、白芍对环磷酰胺所致的血虚证小鼠补血作用比较研究[J]. 中医药信息, 2011, 28(1): 19-21. LI Qiang, ZHOU Rong, YANG Weipeng, et al. The comparative study of blood enrichm ent effects on blood deficiency mice caused by cyclophosphamide throughRadixPaeoniaeRubraandRadixPaeoniaeAlba[J].Information on Traditional Chinese Medicine, 2011, 28(1): 19-21(in Chinese).
[6] 王 瑞, 鲁 岚, 李颖伟, 等. 赤芍与白芍的药理作用比较[J]. 中国实验方剂学杂志, 2010,16(7): 112-114. WANG Rui, LU Lan, LI Yingwei, et al. A comparison on pharmacological actions betweenRadixPaeoniaeRubraandRadixPaeoniaeAlba[J]. Chinese Journal of Experimental Traditional Medical Formulae, 2010, 16(7): 112-114(in Chinese).
[7] 杨琪伟, 杨 莉, 熊爱珍, 等. 赤芍和白芍抗炎作用的UPLC-MS代谢组学初步研究[J]. 中国中药杂志, 2011, 36(6): 694-697. YANG Weiqi, YANG Li, XIONG Aizhen, et al. Metabolomics study of anti-inflammatory action ofRadixPaeoniaeRubraandRadixPaeoniaeAlbaby ultraperformance liquid chromatography-mass spectrometry[J]. China Journal of Chinese Materia Medica, 2011, 36(6): 694-697(in Chinese).
[8] 杨琪伟, 杨 莉, 熊爱珍, 等. 赤芍与白芍抗血小板凝集作用的UPLC-MS代谢组学初步研究[J]. 中国中药杂志, 2011, 36(6): 698-701. YANG Qiwei, YANG Li, XIONG Aizhen, et al. Metabolomics study of anti-platelet effect ofRadixPaeoniaeRubraandRadixPaeoniaeAlbaby UPLC-MS[J]. China Journal of Chinese Materia Medica, 2011, 36(6): 698-701(in Chinese).
[9] 宋玉超, 连超杰, 崔秀荣, 等. 赤芍、白芍凉血作用比较研究(Ⅰ)-LPS刺激大鼠肺泡巨噬细胞的作用研究[J]. 中国医药指南, 2011 ,10(15): 4-6. SONG Yuchao, LIAN Chaojie, CUI Xiurong, et al. A comparative study on content of cooling blood betweenRadixPaeoniaeRubraandRadixPaeoniaeAlba(Ⅰ) -study on lps-stimulated rat alveolar macrophages[J].Guide of China Medicine, 2011, 10(15): 4-6(in Chinese).
[10] 周红涛, 骆亦奇, 胡世林, 等. 赤芍与白芍的化学成分含量比较研究[J]. 中国药学杂志, 2003, 38(9): 16-19. ZHOU Hongtao, LUO Yiqi, HU Shiling, et al. A comparative study on content of major constituents betweenRadixPaeoniaeRubraandRadixPaeoniaeAlbaby HPCE[J]. Chin Pharm J, 2003, 38(9): 16-19(in Chinese).
[11] 王 巧, 刘荣霞, 于海兰,等. 白芍与赤芍HPLC指纹图谱研究[J]. 中国药学杂志, 2007, 8(8): 581-584. WANG Qiao, LIU Rongxia, YU Hailan, et al. Studies on HPLC fingerprint of white peony roots and red peony root[J].Chin Pharm J, 2007, 8(8): 581-584(in Chinese).
[12] 王磊磊, 陈军辉, 王 虹, 等. 赤芍与白芍药材高效毛细管电泳指纹图谱方法学研究[J]. 时珍国医国药, 2008, 19(10): 2 341-2 345. WANG Leilei, CHEN Junhui, WANG Hong, et al. Methodologic study of HPCE fingerprints ofRadixPaeoniaeAlbaandRadixPaeoniaeRubra[J]. Li Shi Zhen Medicine And Materia Medica Research, 2008, 19(10): 2 341-2 345(in Chinese).
[13] 高 明, 赵 镭, 赵光树.白芍和赤芍HPLC指纹图谱比较研究[J]. 中草药, 2010, 41(11): 1 904-1 906. GAO Ming, ZHAO Lei, ZHAO Guangshu. Characteristic chromatographic profile of Paeoniae Radix andRadixPaeoniaeRubra[J].Chinese Traditional and Herbal Drugs, 2010, 41(11): 1 904-1 906(in Chinese).
[14] 王 瑞, 黄山君, 杨琪伟, 等. 赤芍与白芍HPLC 特征指纹谱的建立及其在质量控制中的应用[J]. 中国中药杂志, 2011, 36(6): 729-733. WANG Rui, HUANG Shanjun, YANG Qiwei, et al. Characteristic chromatographic profile ofPaeoniaeRadixand its application in quality control of crude and processed drugs of different origins and processing methods[J]. China Journal of Chinese Materia Medica, 2011, 36(6): 729-733 (in Chinese).
[15] LUO N C, QIAN D W, DUAN J A, et al. UPLC-Q-TOF/MS coupled with multivariate statistical analysis as a powerful technique for rapidly exploring potential chemical markers to differentiate betweenRadixPaeoniaeAlbaandRadixPaeoniaeRubra[J]. Nat Prod Commun, 2013, 8(4): 487-491.
[16] SUSANNE W, ERIK J, LINA S, et al. Visualization of GC/TOF-MS-based metabolomics data for identification of biochemically interesting compounds using OPLS class models[J]. Anal Chem, 2008,80(1): 115-122.
[17] 梁乾德, 马 靖, 高 月. 高分辨电喷雾离子化质谱数据批量自动化预鉴别软件的研制[J]. 质谱学报, 2012, 33(5): 286-289. LIANG Qiande, MA Jing, GAO Yue. Software development for batch automatic preliminary identification of high resolution electrospray mass spectrometric data[J]. J Chin Mass Spectrometry Society, 2012, 33(5): 286-289 (in Chinese).
[18] LI S L, SONG J Z, FRANKY F K C, et al. Chemical profiling of Radix Paeoniae evaluated by ultra-performance liquid chromatography/photo-diode-array/quadrupole time-of-flight mass spectrometry[J]. Journal of Pharmaceutical and Biomedical Analysis, 2009, 49(2): 253-266.
[19] 周家驹. 中药原植物化学成分手册[M]. 北京: 化学工业出版社, 2004: 246.
[20] LIN H C, DING H Y, WU T S, et al. Monoterpene glycosides from paeonia suffruticosa[J]. Phytochemistry, 1996,41(1): 237-242.
[21] TANAKA T, KATAOKA M, TSUBOI N, et al. New monoterpene glycoside esters and phenolic constituents ofPaeoniaeradix, and increase of water solubility of proanthocyanidins in the presence of paeoniflorin[J].Chem Pharm Bull (Tokyo), 2000, 48: 201-207.
[22] 段文娟, 姜 艳, 靳 鑫, 等. 赤芍的化学成分研究[J]. 中国药物化学杂志, 2009, 19: 55-58. DUAN Wenjuan, JIANG Yan, JIN Xin, et al. Chemical constituents ofPaeoniaalbiflora[J]. Chinese Journal of Medicinal Chemistry, 2009, 19: 55-58 (in Chinese).
[23] WASHIDA K, ITOH Y, IWASHITA T, et al. Androgen modulators from the roots ofPaeonialactiflora(paeoniaeradix) grown and processed in nara prefecture[J]. Japan Chem Pharm Bull (Tokyo), 2009, 57(9): 971-974.
[24] WU S H, CHEN Y W, YANG L Y, et al. Mo- noterpene glycosides fromPaeoniadelavayi[J]. Fitoterapia, 2007, 78: 76-78.
[25] WU S H, LUO X D, MA Y B, et al. Monoterpenoid derivatives fromPaeoniadelavayi[J]. J Asian Nat Prod Res, 2002,4(2): 135-140.
[26] MASAYASU K, IKUKO K, TAKAHASHI K, et al. Blocking effects of blended paeoniflorin or its related compounds with glycyrrhizin on neuromuscular junctions in frog and mouse[J]. Jpn J Pharmacol, 1984, 36(3): 275-282.
[27] FURUYA R, HU H H, ZHANG Z Y, et al. Suffruyabiosides A and B, two new monoterpene diglycosides from moutan cortex[J]. Molecules, 2012, 17(5): 4 915-4 923.
[28] ZHANG M H, FENG L, ZHU M M. Antioxidative and anti-inflammatory activities of paeoniflorin and oxypaeoniflora on ages-induced mesangial cell damage[J]. Planta Med, 2013,79(14):1 319-1 323.
[29] JIANG M, ZHOU M G, HAN Y Q, et al. Identification of NF-κB Inhibitors in Xuebijing injection for sepsis treatment based on bioactivity-integrated UPLC-Q/TOF[J]. J Ethnopharmacol, 2013, 147(2): 426-433.
[30] SUGAYA A, SUZUKI T, SUGAYA E, et al. Inhibitory effect of peony root extract on pentylenetetrazol-induced EEG power spectrum changes and extracellular calcium concentration changes in rat cerebral cortex[J]. J Ethnopharmacol,1991,33(1/2): 159-167.
[31] LEE K, OMIYA Y, YUZURIHARA M, et al. Antinociceptive effect of paeoniflorin via spinalα-adrenoceptor activation in diabetic mice[J]. Eur J Pain, 2011, 15(10): 1 035-1 039.
[32] ZENG X Y, ZHOU X, XU J, et al. Screening for the efficacy on lipid accumulation in 3T3-L1 cells is an effective tool for the identification of new anti-diabetic compounds[J]. Biochem Pharmacol, 2012, 84: 830-837.
[33] SUH K S, CHOI E M, LEE Y, et al. Protective effect of albiflorin against oxidative-stress-mediated toxicity in osteoblast-like MC3T3-E1 cells[J]. Fitoterapia, 2013, 89: 33-41.
Chemical Comparison Between Decoctions ofRadixPaeoniaeRubraandRadixPaeoniaeAlbaby UPLC-QTOF MS
LIAN Hang-yun1, XU Wang-yan-jun1, LIANG Qian-de2,MA Zeng-chun2, WANG Yu-guang2, TANG Xiang-lin2,TAN Hong-ling2, XIAO Cheng-rong2, GAO Yue2
(1.AnhuiMedicalUniversity,Hefei230032,China;2.InstituteofRadiationMedicine,AcademyofMilitaryMedicalScience,Beijing100850,China)
To investigate the chemical comparison between decoctions ofRadixPaeoniaeRubraandRadixPaeoniaeAlba, the samples from legal market were compared using ultra-performance liquid chromatography-quadrupole time-of-flight mass spectrometry (UPLC-QTOF MS). Data were statistically analyzed by principal component analysis and orthogonal partial least-squares to latent structures discriminate analysis. The comparing with reference compounds, accuratem/zvalue analysis of TOF-MS data based on in-house software for automatic tentative identification and QTOF-MS/MS fragment analysis were applied to constituents identification. The results indicate that oxypaeoniflorin and albiflorin are the most important differential constituents in the decoctions ofRadixPaeoniaeRubraandRadixPaeoniaeAlba, respectively. Moreover, the contents of 8-debenzoylpaeoniflorin, 1’-O-benzoylsucrose, mudanpioside F, mudanpioside C/benzoloxypaeoniflorin, mudanpioside E, (1S,2S,4R)-trans-2-hydroxy-1,8-cineole-B-D-glucopyranoside, saccharose and galloylpaeoniflorin/galloylalbiflorin may also be of significant difference for two kinds of decoctions.
LC/MS;RadixPaeoniaeRubra;RadixPaeoniaeAlba; decoction; chemical comparison
2013-10-25;
2014-01-23
国家自然科学基金(81073161,81130067)资助
练杭芸(1988~),女(汉族),浙江杭州人,硕士研究生,从事药物分析、中药现代化研究。E-mail:lianhangyun@sina.com
梁乾德(1971~),男(汉族),吉林农安人,博士,从事药物分析、中药现代化研究。E-mail:liangqiande@yeah.net 高 月(1963~),女(汉族),江苏宜兴人,研究员,从事药理毒理学、中药现代化研究。E-mail:gaoyue@bmi.ac.cn
O 657.63
A
1004-2997(2014)03-0269-10
10.7538/zpxb.2014.35.03.0269
