MicroRNA-378*通过抑制CTGF促进人骨髓间充质干细胞凋亡*
2014-07-18曾波航刘宁宁熊龙根刘世明
董 珺, 曾波航, 刘宁宁, 莫 沛, 熊龙根,, 刘世明,, 黎 佼,△
(广州医科大学附属第二医院 1肿瘤科, 2心内科, 3广州心血管疾病研究所,广东 广州 510260)
MicroRNA-378*通过抑制CTGF促进人骨髓间充质干细胞凋亡*
董 珺1,3, 曾波航1, 刘宁宁3, 莫 沛2, 熊龙根2,3, 刘世明2,3, 黎 佼2,3△
(广州医科大学附属第二医院1肿瘤科,2心内科,3广州心血管疾病研究所,广东 广州 510260)
目的: 研究年龄相关microRNA-378* (miR-378*) 对人骨髓间充质干细胞(hMSCs)存活和凋亡的调控作用。方法: 通过microRNA芯片和qRT-PCR检测供体年龄对hMSCs 中miR-378*表达的影响;通过H2O2诱导hMSCs凋亡;通过转染miR-378*模拟物或抑制物,过表达或抑制miR-378*的表达;用MTT、LDH、caspase-3/7、TUNEL检测等方法研究其对hMSCs存活和凋亡的影响;通过siRNA研究结缔组织生长因子(CTGF)对hMSCs存活和凋亡的影响。结果: 随供体年龄增加,hMSCs 中miR-378*的表达增加。H2O2刺激可促进miR-378*表达,抑制CTGF表达。过表达miR-378*可减少hMSCs的存活,促进细胞凋亡。相反,抑制miR-378*的表达促进hMSCs的存活,减少细胞凋亡。同时抑制miR-378*和CTGF的表达,使miR-378*失去对hMSCs存活和凋亡的调控作用。直接抑制CTGF的表达可减少hMSCs的存活,促进细胞凋亡。结论: miR-378*通过抑制CTGF的表达减少hMSCs存活,促进hMSCs凋亡。
人骨髓间充质干细胞; MicroRNA-378*; 细胞凋亡
我们的前期研究证实,随着供体年龄的增加,骨髓间充质干细胞的增殖、分化能力下降,细胞衰老增加,microRNA的表达发生改变[1-2]。而随着人骨髓间充质干细胞(human mesenchymal stem cells, hMSCs)供体年龄的增加,表达发生改变的microRNA,影响了hMSCs的功能,例如:随供体年龄增加,表达下降最显著的microRNA-10a (miR-10a),可通过Krupple样受体4(Krupple-like receptor 4,KLF4)再生hMSCs的分化能力,减少细胞衰老,抑制hMSCs增殖[2];而随着供体年龄的增加,表达升高最显著的miR-196a,可通过同源框B7(homeobox B7,HOXB7)及碱性成纤维细胞生长因子(basic fibroblast growth factor,bFGF)抑制hMSCs增殖[3];最近的研究发现,过表达miR-378可以通过抑制胰岛素样生长因子1受体(insulin-like growth factor 1 receptor,IGF1R)促进大鼠心肌细胞凋亡[4]。而我们的研究发现,随着供体年龄的增加,miR-378家族中miR-378*的表达上调,hMSCs衰老增加[2]。基于miR-378*可能参与调控hMSCs的存活与凋亡,本研究探讨了miR-378*对hMSCs存活及凋亡的调控作用,并进一步探讨其分子机制。
材 料 和 方 法
1 材料
1.1 人骨髓的提取 通过广州医科大学附属第二医院伦理委员会批准,与患者签订知情同意书后,在心脏瓣膜病患者手术过程中吸取人骨髓5 mL。供体为17~30岁者定义为年青组,65~80岁者定义为年老组,排除肿瘤、乙肝、HIV感染等因素。
1.2 主要试剂及仪器 胎牛血清和OPTI-MEM 培养基(Gibco);Lipofectamine 3000 转染试剂和Lipofectamine RNAiMAX转染试剂(Invitrogen);LDH细胞毒性检测试剂盒和MTT细胞增殖及细胞毒性检测试剂盒(碧云天);caspase-3/7活性检测试剂盒(Promega);原位细胞凋亡检测试剂盒(Roche);SYBR Green荧光定量试剂盒和RNA逆转录试剂盒(Toyobo);淋巴细胞分离液(MPBIO);荧光定量PCR仪(ABI);多功能酶标仪(TECAN)。
2 方法
2.1 hMSCs的提取及鉴定 将人骨髓小心叠加于等体积的淋巴细胞分离液上层,4 ℃下以2 000 r/min离心20 min,吸取分离液和血浆界面的云雾状的单个核细胞层,用无血清IMDM悬浮后,以1 000 r/min离心。按2×109/m2密度接种于培养瓶中培养。48 h后换液,贴壁细胞每3 d换液,待细胞融合度达80%以上时,胰酶消化传代,第3代细胞用于实验研究并通过流式细胞仪检测细胞表面特异性抗原的表达(CD29,CD31,CD34,CD44,CD45和CD166)[2]。
2.2 MicroRNA芯片检测及qRT-PCR检测 分别选取年青组(17岁、20岁、25岁)及年老组(78岁、80岁、75岁)hMSCs送于北京博奥生物有限公司进行mico-RNA芯片检测。用1 μg总RNA逆转录为cDNA。通过qRT-PCR检测miR-378*及结缔组织生长因子(connective tissue growth factor,CTGF)的表达,分别选取U6及GAPDH作为内参照。各引物序列见表1。
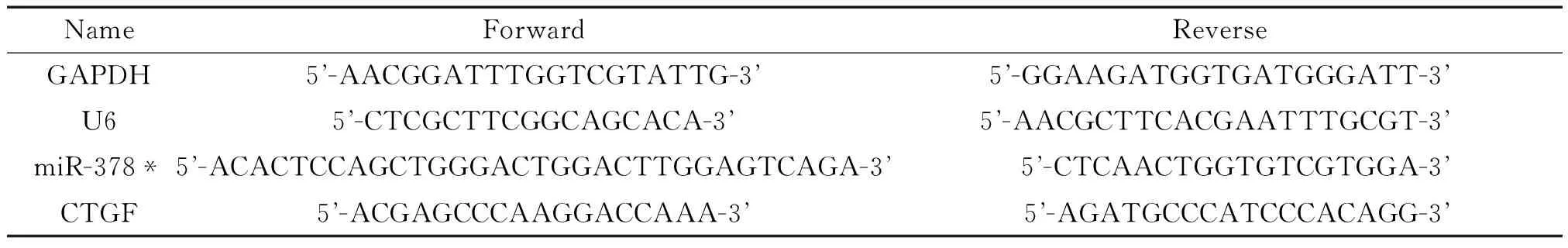
表1 引物序列
2.3 细胞转染 miR-378*模拟物、抑制物和si-CTGF及其相应的阴性对照均由上海吉玛公司合成,具体序列见表2。hMSCs培养于 24 孔板,无血清培养过夜后,更换为新鲜无血清及抗生素培养基(500 μL/孔)。将小分子 RNA 稀释于100 μL Opti-MEM培养基中,加入1 μL Lipofectamine RNAiMAX,轻柔混匀后室温放置15 min;将 RNAiMAX与miRNA/siRNA的稀释液加入 24 孔板的各孔细胞中,培养48 h按实验需要处理细胞。miR-378*模拟物及阴性对照的终浓度为100 nmol/L;miR-378*抑制物及阴性对照的终浓度为200 nmol/L;siRNA及其对照的终浓度为20 nmol/L。
2.4 MTT检测 H2O2(300 μmol/L,5 h)刺激不同预处理组 hMSCs后(详见细胞转染实验方法),通过MTT细胞增殖及细胞毒性检测试剂盒检测hMSCs活性(hMSCs以1×108/m2密度培养)。
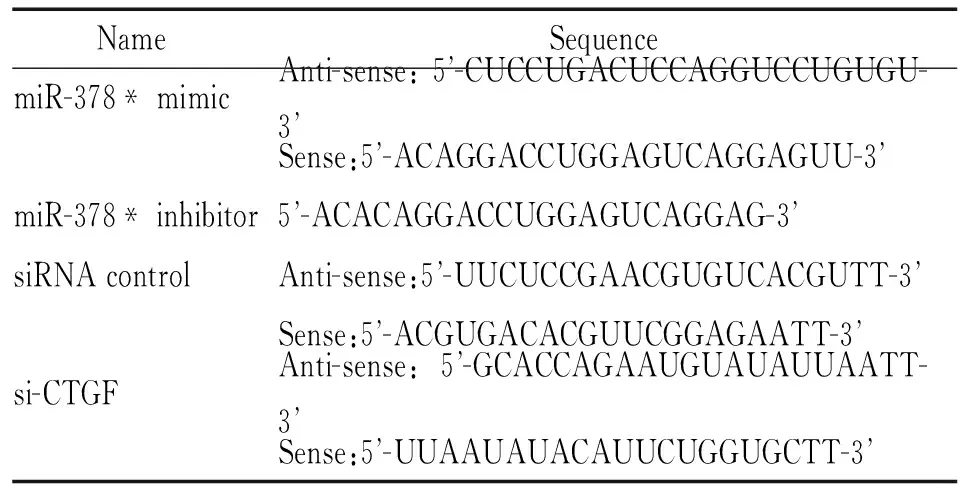
表2 MicroRNA与siRNA序列
2.5 LDH及caspase-3/7检测 H2O2(300 μmol/L,5 h)刺激不同预处理组 hMSCs后,通过LDH细胞毒性检测试剂盒及caspase-3/7活性检测试剂盒,检测不同预处理组中LDH酶及caspase-3/7的活性(hMSCs以3×108/m2密度培养)。
2.6 TUNEL法检测细胞凋亡 H2O2(300 μmol/L,5 h)刺激不同预处理组 hMSCs后,通过原位细胞凋亡检测试剂盒检测不同预处理组中细胞凋亡的表达(hMSCs以1.5×109/m2密度培养)。DAPI复染细胞核,荧光显微镜下检测细胞凋亡情况(每实验组做3复孔,每孔随机选取6个区域,行染色阳性细胞计数)。
2.7 Western blotting检测CTGF蛋白表达 各实验组细胞处理完毕后,加入细胞裂解液,4 ℃裂解30 min后收取蛋白液,采用BCA法进行蛋白定量。总蛋白经SDS-PAGE分离后,转移到NC膜上。用5%BSA封闭1 h,后加入CTGF抗体(1∶100),4 ℃过液,用TBST洗3次,每次10 min。ECL法显色,用凝胶成像系统扫描分析结果。
3 统计学处理
数据以均数±标准差(mean±SD)表示,应用SPSS 16.0统计软件,组间均数比较采用单因素方差分析。以P<0.05为差异有统计学意义。
结 果
1 miR-378*随供体年龄增加而表达上调
通过Affymetrixr GeneChip 2.0 miRNA芯片分析,我们发现miR-378*随供体年龄的增加而表达上调,见图1A。通过qRT-PCR检测,我们进一步证实,与年青组相比,年老组hMSCs中miR-378*表达上调4.71倍,见图1B。
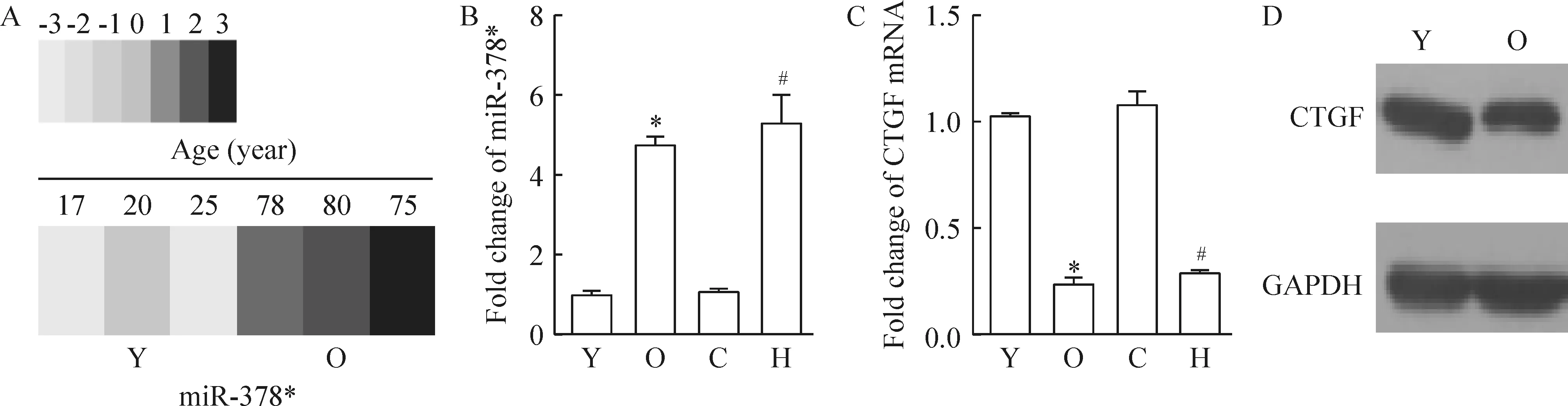
Figure 1.Alternation of miR-378* and CTGF expression in aged hMSCs. A: miR-378* expression in young (Y) and old (O) hMSCs was determined by microarray analysis; B: miR-378* expression in Y, O, control(C) and H2O2(H) treated hMSCs was determined by qRT-PCR; C: CTGF mRNA expression in Y, O, C and H2O2(H) treated hMSCs; D: CTGF protein expression in Y and O hMSCs. Mean±SD.n=3.*P<0.05vsY;#P<0.05vsC.
图1 供体年龄对hMSCs中miR-378*及CTGF表达的影响
2 H2O2诱导hMSCs凋亡
H2O2刺激可减少hMSCs存活,诱导hMSCs凋亡。通过MTT、LDH和caspase-3/7检测,我们发现H2O2刺激使hMSCs细胞存活率下降,LDH和caspase-3/7活性升高,见图2D~F。并且,H2O2可促进hMSCs中miR-378*的表达,抑制CTGF的表达,见图1B~D。
Figure 2.Effects of miR-378* and CTGF on hMSC survival and apoptosis. A: up-regulated miR-378* expression in hMSCs by miR-378* mimic (M) and down-regulated miR-378* expression in hMSCs by miR-378* inhibitor (I); B and C: the mRNA and protein expression of CTGF in hMSCs transfected with miR-378* mimic, miR-378* inhibitor, si-CTGF (S), or miR-378* inhibitor and si-CTGF (I+s); D, E and F: MTT, LDH and caspase-3/7 assays of young (Y), old (O) or H2O2-treated hMSCs which transfected with miR-378* mimic, miR-378* inhibitor, si-CTGF, or miR-378* inhibitor and si-CTGF.C1~3: controls. Mean±SD.n=4.*P<0.05vsC1;#P<0.05vsC2;△P<0.05vsY;▲P<0.05vsY+H2O2.
图2 miR-378*及CTGF对hMSCs存活与凋亡的调控作用
3 miR-378*促进H2O2诱导的hMSCs凋亡
转染miR-378*模拟物,可在hMSCs中过表达miR-378*(上调5.1倍);相反,转染miR-378*抑制物,可抑制miR-378*的表达(下调0.21倍),见图2A。过表达miR-378*后,通过MTT、LDH、caspase-3/7检测及TUNEL染色,我们发现hMSCs细胞存活率下降(MTT检测,下调0.58倍),细胞凋亡增加;LDH活性上调1.75倍;caspase-3/7活性上调1.28倍;TUNEL染色阳性率上调8.14倍。相反,抑制miR-378*表达后,hMSCs细胞存活率提高(MTT检测,上调1.24倍),细胞凋亡减少;LDH活性下调0.58倍;caspase-3/7活性下调0.83倍;TUNEL染色阳性率下调0.36倍,见图2D~F及图3。
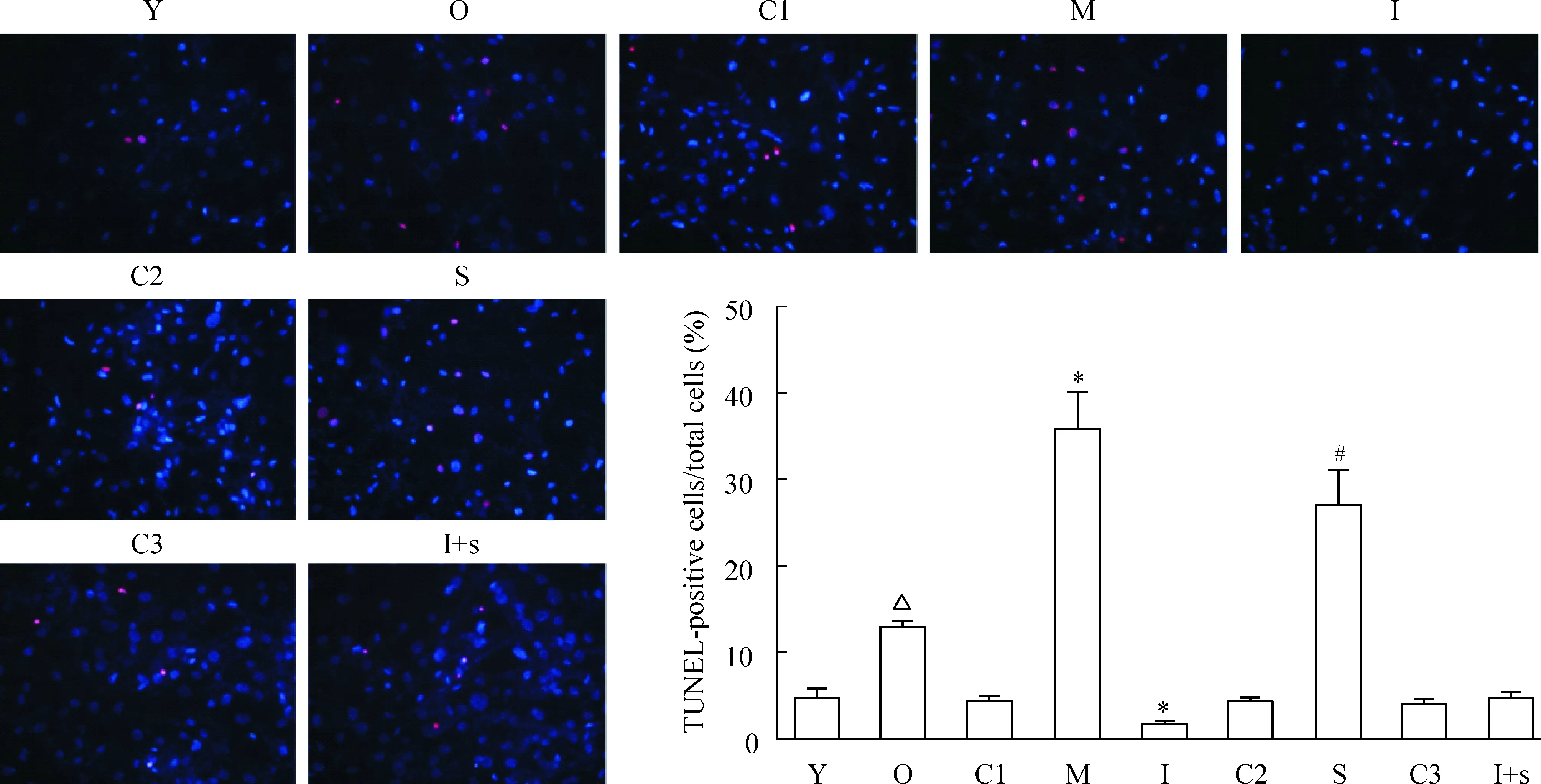
Figure 3.Effects of miR-378* and CTGF on hMSC apoptosis [TUNEL (red) and DAPI (blue) staining,×200].Mean±SD.n=3.*P<0.05vsC1;#P<0.05vsC2;△P<0.05vsY.
图3 TUNEL检测miR-378*及CTGF对hMSCs凋亡的调控作用
4 miR-378*通过抑制CTGF表达发挥调控作用
通过qRT-PCR检测,我们发现与年青组相比,年老组hMSCs中CTGF表达下调0.24倍,见图1C。H2O2刺激后引起hMSCs中miR-378*表达上调时,CTGF表达下调0.27倍,见图1B、C。转染miR-378*模拟物在hMSCs中过表达miR-378*时,CTGF表达下调0.49倍,而在hMSCs中抑制miR-378*表达时,CTGF表达升高3.31倍;通过si-CTGF,我们可在hMSCs中抑制CTGF mPNA及蛋白的表达(下调0.19倍),见图2B、C。在H2O2诱导细胞凋亡过程中,直接抑制CTGF的表达,使hMSCs存活率下降(MTT检测,下调0.55倍),细胞凋亡增加;LDH活性上调2倍;caspase-3/7活性上调1.31倍;TUNEL染色阳性率上调6.22倍。而在hMSCs中同时抑制miR-378*及CTGF表达后,使抑制miR-378*所引起的细胞存活增加、凋亡减少的作用消失,见图2D~F及图3。
讨 论
本课题组前期研究证实,随供体年龄改变而差异表达的miRNAs,与年龄因素引起的hMSCs功能改变相关,例如:miRNAs表达的改变可能与细胞增殖、分化、衰老及凋亡相关。本研究进一步探讨了miR-378*对hMSCs存活和凋亡的调控作用及其机制。我们发现miR-378*可通过抑制CTGF的表达,促进细胞凋亡,减少细胞存活。
研究证实microRNA参与调控细胞生存、复制、衰老、增殖及分化等过程,其中在最近的研究中,miR-378家族被证实参与多种细胞功能的调控。例如:在抑制miR-378*表达转基因小鼠的研究中发现,抑制miR-378*可以通过上调整合素β3及波形蛋白的表达,促进伤口愈合[5]。Zhang等[6]在结直肠癌中的研究发现,miR-378是一种抑癌因子,可通过抑制其靶基因波形蛋白的表达,抑制肿瘤的增殖和侵袭。然而,由于信号通路调控机制和细胞类型的不同,miR-378家族对细胞存活和凋亡的调控作用尚无定论。例如:在人脑星形胶质母细胞瘤细胞株(U87)、乳腺癌细胞株(MT-1)及混合肿瘤细胞中的研究发现,miR-378*可以抑制转录因子SuFu和Fus-1的表达,促进肿瘤细胞存活,肿瘤组织生长及血管生成[7]。而相反,Kim等[8]的研究发现,在电刺激预处理的小鼠心脏干细胞中过表达miR-378,使电刺激的细胞保护作用丧失,通过LDH释放和TUNEL染色检测发现,过表达miR-378使细胞的存活能力下降。在小鼠心肌细胞中的研究发现,miR-378随供体年龄的增加而表达上调。miR-378通过抑制IGF1R和Akt信号途径,促进心肌细胞凋亡[4]。与此结果类似,我们的研究发现miR-378*的表达随hMSCs供体年龄的增加而升高,miR-378*可促进hMSCs凋亡。
一个microRNA可能调控多个靶基因,多个microRNA也可能只调控一个靶基因。研究证实miR-378*可调控多种蛋白的表达,例如整合素β3、波形蛋白、Nodal 蛋白、纤连蛋白等[5, 7]。而与Kim等[8]的研究结果类似,我们发现miR-378*可以抑制CTGF基因及蛋白的表达。CTGF被证实不仅可调控黏附、迁移、增殖、分化、衰老、存活和凋亡等细胞功能,而且也被证实可参与调控血管生成、成骨细胞分化、成软骨细胞分化、伤口愈合和动脉硬化等生物过程[9]。例如:在细胞存活、凋亡的研究中发现,CTGF可以减少缺氧应激等细胞微环境改变引起的细胞损伤,减少缺氧应激引起的胰腺癌细胞凋亡,促进肿瘤生长[10]。而在人横纹肌肉瘤的研究中发现,抑制CTGF的表达可促进细胞凋亡,减少细胞存活和向成肌细胞分化[11]。 同样,在CTGF基因敲除小鼠中的研究发现,敲除CTGF基因后,小鼠肺细胞增殖能力下降,凋亡增加,最终导致小鼠肺组织发育不良[12]。Tsai等[13]在骨肉瘤的研究中发现,CTGF可以通过促进生存蛋白的表达,减少紫杉醇诱导的细胞凋亡。与这些研究结果类似,我们的研究证实,CTGF随hMSCs供体年龄的增加而表达下调。进一步的功能实验证实,CTGF的表达下降是引起hMSCs存活下降和凋亡增加的主要因素。
我们的研究发现:miR-378*随hMSCs供体年龄的增加而表达上调,从而抑制了其靶基因CTGF的表达,导致hMSCs存活下降和凋亡增加。本课题阐述了miR-378*调控hMSCs存活及凋亡的机制,为年龄相关microRNAs——miR-378*的运用提供了理论基础和新的研究方向。
[1] 黎 佼,陈敏生,杨伟健,等. 年轻骨髓间充质干细胞可通过细胞融合改善年老骨髓间充质干细胞功能[J]. 中国病理生理杂志, 2010, 26(5):976-981.
[2] Li J, Dong J, Zhang ZH, et al. miR-10a restores human mesenchymal stem cell differentiation by repressing KLF4[J]. J Cell Physiol, 2013, 228(12):2324-2336.
[3] 黎 佼,董 珺,张振辉,等. MicroRNA-196a通过HOXB7调控人骨髓间充质干细胞增殖功能[J]. 中国病理生理杂志, 2014, 30(2):278-285.
[4] Knezevic I, Patel A, Sundaresan NR, et al. A novel cardiomyocyte-enriched microRNA, miR-378, targets insulin-like growth factor 1 receptor: implications in postnatal cardiac remodeling and cell survival[J]. J Biol Chem, 2012, 287(16):12913-12926.
[5] Li H, Chang L, Du WW, et al. Anti-microRNA-378a enhances wound healing process by up-regulating integrin beta-3 and vimentin[J]. Mol Ther, 2014,22(10):1839-1850.
[6] Zhang GJ, Zhou H, Xiao HX, et al. MiR-378 is an independent prognostic factor and inhibits cell growth and invasion in colorectal cancer[J]. BMC Cancer, 2014, 14:109.
[7] Lee DY, Deng Z, Wang CH, et al. MicroRNA-378 promotes cell survival, tumor growth, and angiogenesis by targeting SuFu and Fus-1 expression[J]. Proc Natl Acad Sci U S A, 2007, 104(51):20350-20355.
[8] Kim SW, Kim HW, Huang W, et al. Cardiac stem cells with electrical stimulation improve ischaemic heart function through regulation of connective tissue growth factor and miR-378[J]. Cardiovasc Res, 2013, 100(2):241-251.
[9] Charrier A, Brigstock DR. Regulation of pancreatic function by connective tissue growth factor (CTGF, CCN2)[J]. Cytokine Growth Factor Rev, 2013, 24(1):59-68.
[10]Bennewith KL, Huang X, Ham CM, et al. The role of tumor cell-derived connective tissue growth factor (CTGF/CCN2) in pancreatic tumor growth[J]. Cancer Res, 2009, 69(3):775-784.
[11]Croci S, Landuzzi L, Astolfi A, et al. Inhibition of connective tissue growth factor (CTGF/CCN2) expression decreases the survival and myogenic differentiation of human rhabdomyosarcoma cells[J]. Cancer Res, 2004, 64(5):1730-1736.
[12]Baguma-Nibasheka M, Kablar B. Pulmonary hypoplasia in the connective tissue growth factor (Ctgf) null mouse[J]. Dev Dyn, 2008, 237(2):485-493.
[13]Tsai HC, Huang CY, Su HL, et al. CTGF increases drug resistance to paclitaxel by upregulating survivin expression in human osteosarcoma cells[J]. Biochim Biophys Acta, 2014, 1843(5):846-854.
MicroRNA-378*enhances apoptosis of human mesenchymal stem cells by repressing expression of CTGF
DONG Jun1,3, ZENG Bo-hang1, LIU Ning-ning3, MO Pei2, XIONG Long-gen2,3, LIU Shi-ming2,3, LI Jiao2,3
(1DepartmentofOncology,2DepartmentofCardiology,3GuangzhouInstituteofCardiovascularDisease,TheSecondAffiliatedHospital,GuangzhouMedicalUniversity,Guangzhou510260,China.E-mail:gzlijiao@163.com)
AIM: To investigate the effects of microRNA-378* (miR-378*) on the survival and apoptosis of human mesenchymal stem cells (hMSCs). METHODS: The expression of miR-378* was determined by microRNA arrays and quantitative real-time PCR (qRT-PCR). H2O2was used to induce hMSCs apoptosis. By transfection of miR-378* mimic or inhibitor, we up-regulated or down-regulated miR-378* expression in hMSCs. The effect of miR-378* and connective tissue growth factor (CTGF) on hMSC survival and apoptosis were detected by MTT, LDH, caspase-3/7 and TUNEL assays. RESULTS: The expression of miR-378* was up-regulated in the old hMSCs compared with the young hMSCs. H2O2increased the expression of miR-378*, decreased the expression of CTGF. Up-regulation of miR-378* resulted in increasing apoptosis and decreasing survival of hMSCs. Conversely, down-regulation of miR-378* resulted in decreasing cell apoptosis and increasing survival. The regulation of miR-378* on hMSC apoptosis and survival was attenuated by inhibiting the expression of miR-378* and CTGF together. Direct repression of CTGF expression inhibited the hMSC survival and increased apoptosis. CONCLUSION: miR-378* enhances apoptosis of hMSCs by repressing the expression of CTGF.
Human mesenchymal stem cells; MicroRNA-378*; Apoptosis
1000- 4718(2014)12- 2238- 05
2014- 07- 11
2014- 07- 30
国家自然科学基金青年项目(No. 81401156); 广州市属高校科研计划项目(No. 2012C232);广州医科大学博士科研项目(No. 2012C42)
R363
A
10.3969/j.issn.1000- 4718.2014.12.021
△ 通讯作者 Tel: 020-34153522; E-mail: gzlijiao@163.com
