RNA干扰技术沉默CDC25a基因对人肝癌细胞HepG2增殖的影响*
2014-07-18周玲丽骆成飘苏建家
李 薇, 曹 骥, 周玲丽, 罗 旺, 杨 春, 骆成飘, 李 瑗, 苏建家
(广西壮族自治区肿瘤防治研究所,广西 南宁 530021)
RNA干扰技术沉默CDC25a基因对人肝癌细胞HepG2增殖的影响*
李 薇, 曹 骥△, 周玲丽, 罗 旺, 杨 春, 骆成飘, 李 瑗, 苏建家
(广西壮族自治区肿瘤防治研究所,广西 南宁 530021)
目的: 研究细胞分裂周期素25a(cell division cycle 25a,CDC25a)基因沉默后对于人肝癌细胞系HepG2增殖的影响。同时探讨该影响发生的可能作用机制。方法: 使用RNA干扰技术沉默人肝癌HepG2细胞的CDC25a基因,采用实时荧光定量PCR技术检测肝癌细胞中的CDC25a 及其作用基因cyclin E及CDK2的 mRNA表达水平,Western blotting检测CDC25a的蛋白表达水平,并采用MTT法、Giemsa染色法及流式细胞技术检测细胞的增殖情况。结果: CDC25a 的mRNA及蛋白表达水平在RNA沉默组细胞中的表达低于阴性对照组及正常对照组细胞(P<0.05)。Cyclin E及CDK2 的mRNA表达水平在沉默组低于阴性对照及正常对照组(P<0.05)。MTT法、Giemsa染色法结果显示沉默组细胞增殖能力低于阴性对照组及正常对照组细胞(P<0.05),流式细胞技术结果显示沉默组细胞阻滞在G1期。 结论: LV-CDC25a-RNAi重组体感染HepG2细胞可以有效抑制CDC25a基因的表达,使人肝癌HepG2细胞增殖受到抑制,提示CDC25a基因可能是肝癌治疗的关键靶点。
基因,CDC25a; RNA干扰; 肝肿瘤
肿瘤发生是一个多因素、多基因、多步骤累积的过程,最明显区别于正常组织的是肿瘤细胞的生长具有自主性,即细胞增殖失控。有研究称几乎所有癌肿都表现出细胞周期紊乱或不规则,肝癌细胞作为消化系统常见肿瘤同样也有如此表现。细胞分裂周期素25a(cell division cycle 25a,CDC25a)属于细胞周期调控蛋白,其作用是活化细胞周期蛋白依赖性激酶(cyclin-dependent kinase, CDK)/cyclin这个核心的复合体,因而该基因过度表达可使得细胞加速增殖,一旦平衡失调则会导致肿瘤的发生[1]。本课题组前期研究表明CDC25a蛋白在肝癌组织中呈高表达,并且肝癌患者分期、转移及复发与该蛋白表达呈正相关[2]。为进一步探讨CDC25a基因在肝癌发生及发展中的作用,本实验采用RNA干扰技术,通过构建靶向CDC25a基因的siRNA慢病毒载体(LV-CDC25a-RNAi)并转染人肝癌HepG2细胞,将CDC25a基因沉默后观察该基因对于细胞增殖的影响。
材 料 和 方 法
1 材料
人肝癌HepG2细胞株购自上海吉凯基因技术有限公司;siRNA靶点设计、5种同时带有绿色荧光蛋白(green fluorescent protein,GFP)、CDC25a基因沉默重组慢病毒颗粒LV-CDC25a-RNAi(KD1、2、3、4、5)及对照慢病毒颗粒(LV-siRNA-NC)的包装以及嘌呤霉素抗性筛选亦由上海吉凯基因技术有限公司负责;DMEM、胎牛血清和PBS购自Gibco;细胞周期检测试剂盒、逆转录试剂盒购自Fermentas;荧光定量PCR试剂盒购自TaKaRa;噻唑蓝(MTT)购自北京鼎国生物技术有限责任公司; Giemsa染液购自美国Chemicon;CDC25a单克隆抗体购自Abcam;鼠抗人GAPDH单克隆抗体购自北京中杉金桥生物技术有限公司;近红外染料标记的Ⅱ抗购自LI-COR。 Odyssey红外荧光成像仪为LI-COR产品;酶标仪Elx800购自Biotek;流式细胞仪FACS Calibur为BD产品。
2 方法
2.1 细胞培养、转染 人肝癌细胞株HepG2置于含10%胎牛血清、1%盐酸左氧氟沙星的DMEM培养基中培养,在37 ℃、5% CO2条件下进行培养。将对数生长期的人肝癌细胞系HepG2接种于24孔板,每孔种细胞数为1.5×105个;12 h后细胞融合率达到20%左右时进行转染。转染的感染复数(multiplicity of infection, MOI)为20,实验组中分别加入LV-CDC25a-RNAi(KD1、2、3、4、5), 阴性对照组加入LV-RNAi-NC, 空白对照组不做处理,常规培养。每隔24 h在荧光倒置显微镜下观察荧光表达阳性率。转染后4~5 d可收获细胞。
2.2 嘌呤霉素(puromycin)筛选稳定转染细胞株 使用嘌呤霉素处理HepG2细胞,48 h后细胞全部死亡的最低药物浓度,即为筛选浓度。实验组及阴性对照组细胞在转染48 h后各孔加入含有4 mg/L嘌呤霉素的培养液, 筛选稳定转染的细胞(实验过程中设有空白细胞加药处理组进行对照), 转染96 h后换液弃掉无嘌呤霉素抗性的细胞(非稳定转染细胞)。
2.3 Western blotting检测CDC25a蛋白表达 使用试剂盒提取7组细胞的总蛋白并用BCA法测定蛋白浓度, 加入蛋白缓冲液,100 ℃变性5 min后放入-80 ℃保存备用。 上样50 μg, 经SDS-PAGE分离蛋白, 转膜, 5%脱脂牛奶封闭2 h, 洗膜,加I抗(1∶100),过夜孵育后洗膜,加II抗(1∶10 000)室温孵育1 h。采用Odyssey红外荧光成像仪对PVDF膜进行扫描。
2.4 实时荧光定量PCR检测CDC25a、cyclin E和CDK2的 mRNA表达水平 使用Primer 5.0软件设计引物,引物由TaKaRa(大连)合成,CDC25a 上游引物为5’-TTGGTGGATTTTGAAGGT-3’,下游引物为5’-AGTGAAGCCGTGATGGTA-3’,产物大小为233 bp;Cyclin E的上游引物为5’-GACCTAAAGGACTCCCACAACAAC -3’,下游引物为5’-AACGGAGCCCAGAACACCT -3’,产物大小为89 bp;CDK2的上游引物为 5’- ATCCGCCTGGACACTGAG -3’,下游引物为 5’-TCCGCTTGTTAGGGTCGT-3’,产物大小为165 bp;内参照GAPDH的上游引物为 5’-TGACTTCAACAGCGACACCCA-3’,下游引物为5’-CACCCTGTTGCTGTAGCCAAA-3’,产物大小121 bp。Trizol法分别提取实验组、阴性对照及空白对照组细胞总RNA后逆转录为cDNA。程序为:95 ℃ 30 s;95 ℃ 5 s,62 ℃或60 ℃ 30 s,共40个循环。每组细胞设计3个重复孔,同时扩增目的及内参照基因。采用2-ΔΔCt分析法计算。
2.5 MTT法分析细胞增殖 取对数生长期3组细胞铺板,每组5复孔,每孔100 μL(细胞数约为2 000每孔)。分别于种板后的24 h、48 h、72 h、96 h和120 h加入10 μL(5 g/L现配现用)的MTT,无需换液。4 h后加入100 μL DMSO终止反应,振荡器振荡5~10 min,酶标仪490 nm检测吸光度(A)值。
2.6 Giemsa染色检测克隆形成 取对数生长期细胞以800个每孔将3组细胞接种于6孔板, 设每组3个复孔,置37 ℃、5% CO2培养箱(保证湿度)中培养2周。Giemsa染色,在显微镜下计算细胞克隆数。
2.7 细胞周期检测 取各组对数生长期细胞按105每孔接种于6孔板中,设置4个复孔。各组细胞经胰酶消化后,每管取1×106个细胞;PBS洗细胞3次,离心去上清。70%乙醇固定细胞2 h。离心去固定液,PBS洗涤细胞沉淀1次,每管加入 RNase 37 ℃水浴30 min后加入PI染液。室温避光孵育30 min;流式细胞仪上机检测,实验重复3次。
3 统计学处理
采用SPSS 16.0统计软件进行分析,计量资料采用均数±标准差(mean±SD)表示,多组间比较采用单因素方差分析(One-way ANOVA),以P<0.05为差异有统计学意义。
结 果
1 判断慢病毒的感染效率
转染96 h后荧光最强,在含有不同干扰序列的慢病毒转染后,各组细胞GFP荧光显色均匀一致,表达强度无明显差别,提示各组细胞的慢病毒感染效率无明显差别,见图1。

Figure 1.HepG2 cells were infected with the CDC25a-RNAi lentivirus for 96 h (×100).
图1 CDC25a-RNAi慢病毒感染HepG2细胞
2 CDC25a 的mRNA表达和有效靶点的筛选
Real-time PCR结果显示,与阴性对照及空白对照组相比,5个靶点中目的mRNA的表达水平均下调约80%左右,差异有统计学意义(P<0.05),其中以1号靶点敲减效率最高,阴性对照组和空白对照组两者比较差异无统计学意义,见图2、表1。
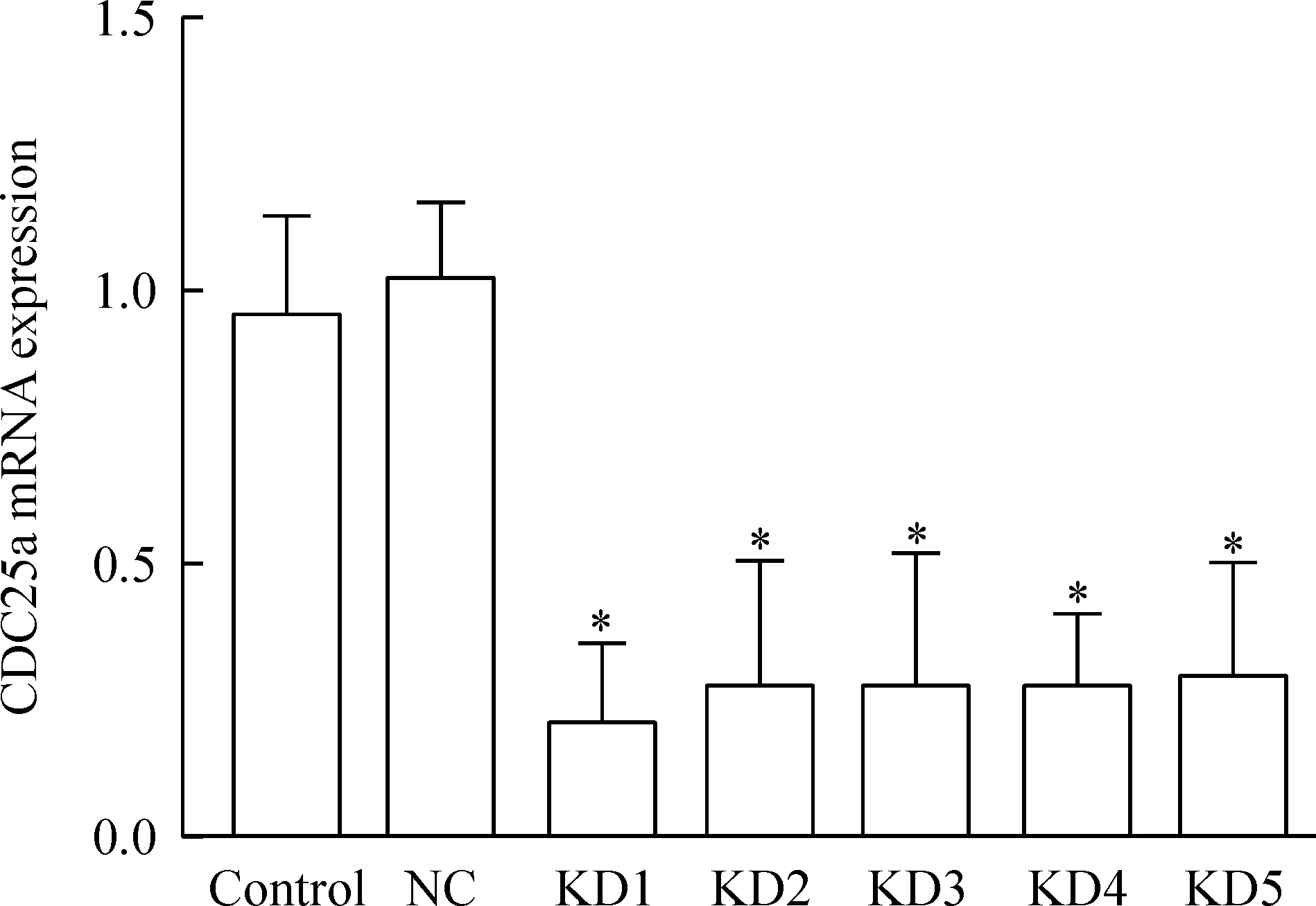
Figure 2.The mRNA expression of CDC25a in control group, NC group and experimental groups. Mean±SD.n=20.*P<0.05vscontrol and NC group.
图2 CDC25a mRNA在各组细胞中的表达

表1 靶点序列
3 CDC25a蛋白表达水平测定结果
以GAPDH作为内参照,5组慢病毒感染组蛋白相对表达量相比阴性对照组相对表达量分别减少了82.61%±0.24%、77.54%±0.81%、78.26%±0.63%、76.09%±0.79%、76.09%±0.68%, 差异均有统计学意义(P<0.05),综合real-time PCR结果可认定LV-CDC25a-RNA(KD1)作为最优靶点,该靶点CDC25a蛋白相对表达量为0.24±0.01,与阴性对照及空白对照组相比,差异有统计学意义(P<0.05),阴性对照组和空白对照组相比,差异无统计学意义(P>0.05),见图3。
4 Cyclin E及CDK2的 mRNA表达水平测定结果
Real-time PCR结果显示cyclin E的mRNA表达量LV-CDC25a-RNAi组为0.493±0.160,阴性对照组为1.093±0.250,空白对照组为1.030±0.210;CDK2的mRNA表达量LV-CDC25a-RNAi组为0.654±0.120,阴性对照组为1.030±0.210,空白对照组为0.981±0.140。LV-CDC25a-RNAi组cyclin E及CDK2 的mRNA表达水平均低于阴性对照及空白对照组,差异有统计学意义,阴性对照组和空白对照组两者比较差异无统计学意义,见图4。
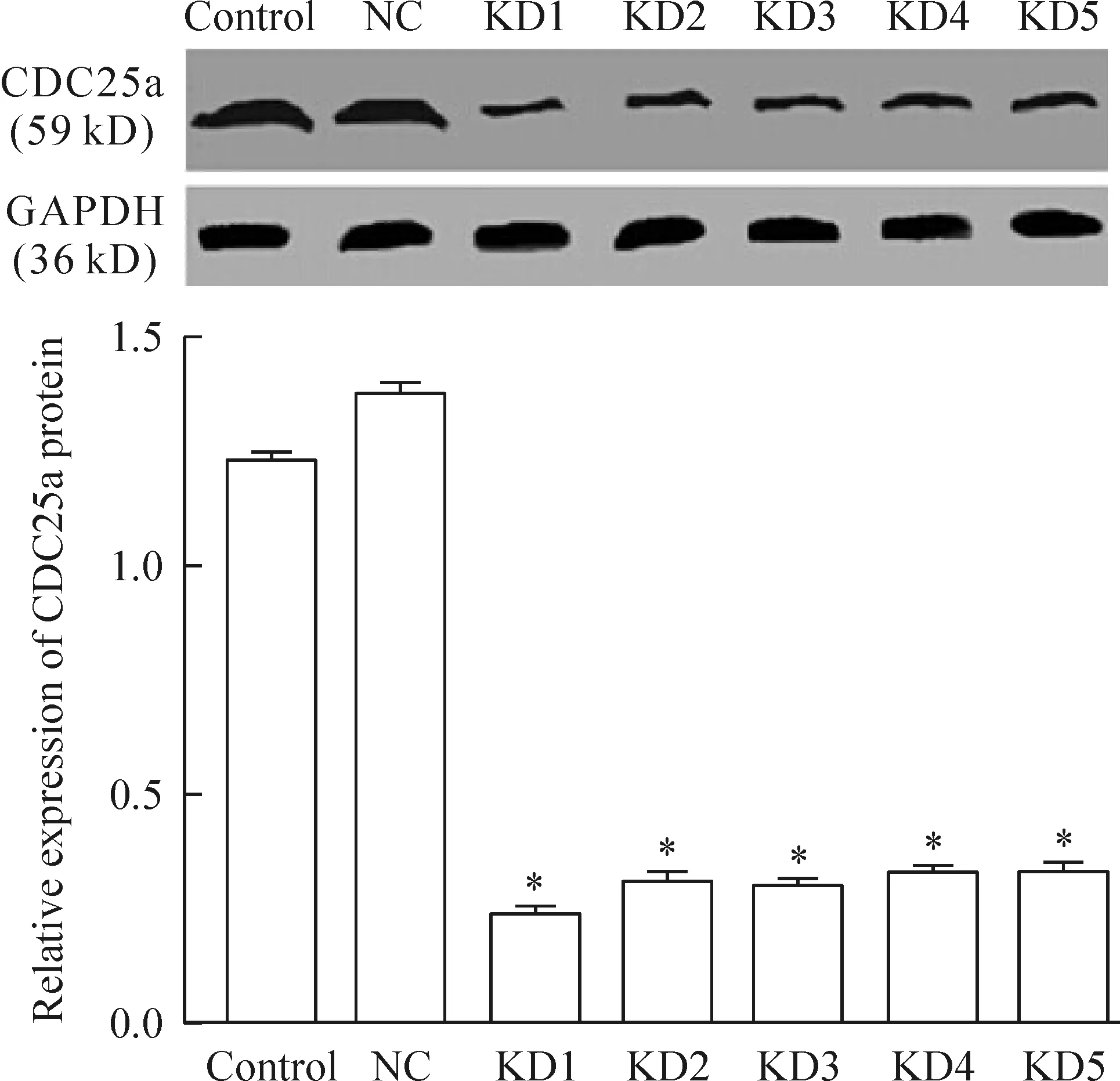
Figure 3.Western blotting analysis of CDC25a proteins level in control group, NC group and experimental groups. Mean±SD.n= 12.*P<0.05vscontrol group and NC group.
图3 CDC25a蛋白在各组细胞中的相对表达量

Figure 4.The mRNA expression of cyclin E (A) and CDK2 (B) in control group, NC group and LV-CDC25a-RNAi groups. Mean±SD.n=20.*P<0.05vscontrol group and NC group.
图4 Cyclin E和CDK2 mRNA的表达量
5 细胞增殖活性结果
与阴性对照及空白对照组相比,转染后各时段LV-CDC25a-RNAi组细胞490 nm处的A值均下降,但24 h时差异无统计学意义(P>0.05),其它4个时点差异均有统计学意义(P<0.05),阴性对照组和空白对照组两者比较差异无统计学意义,见图5。
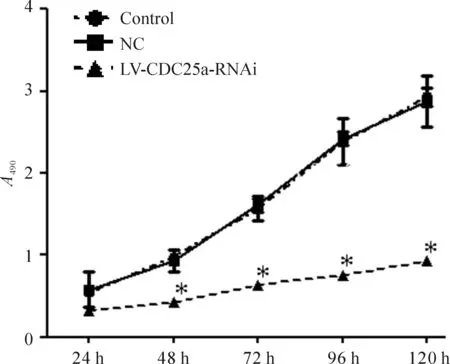
Figure 5.MTT analysis of the cell proliferation in control group, NC group and LV-CDC25a-RNAi groups. Mean±SD.n=20.*P<0.05vscontrol group and NC group.
图5 MTT法检测3组细胞的活力
6 各组细胞克隆数比较
Giemsa染色法检测结果为LV-CDC25a-RNAi组低于阴性对照组及空白对照组,差异有统计学意义(P<0.05);空白对照组与阴性对照组比较,差异无统计学意义,见图6。
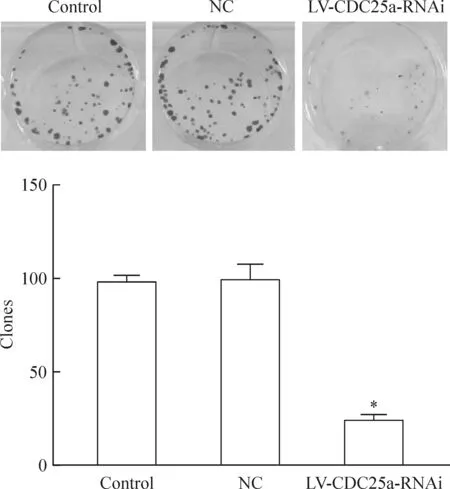
Figure 6.Giemsa staining shows the clones in each groups. Mean±SD.n=10.*P<0.05vscontrol group and NC group.
图6 吉姆萨染色法显示3组细胞的克隆数
7 各组细胞的细胞周期检测结果(流式细胞术)
实验结果显示LV-CDC25a-RNAi组的G1期比例比阴性对照及空白对照组G1期比例升高(P<0.05);LV-CDC25a-RNAi组G2期比例比阴性对照及空白对照组G2期比例降低(P<0.05);LV-CDC25a-RNAi组S期比例比阴性对照及空白对照组S期比例降低(P<0.05),3个时期各组细胞间的差异均有统计学意义,阴性对照组和空白对照组对比两者差异无统计学意义(P>0.05),见图7。
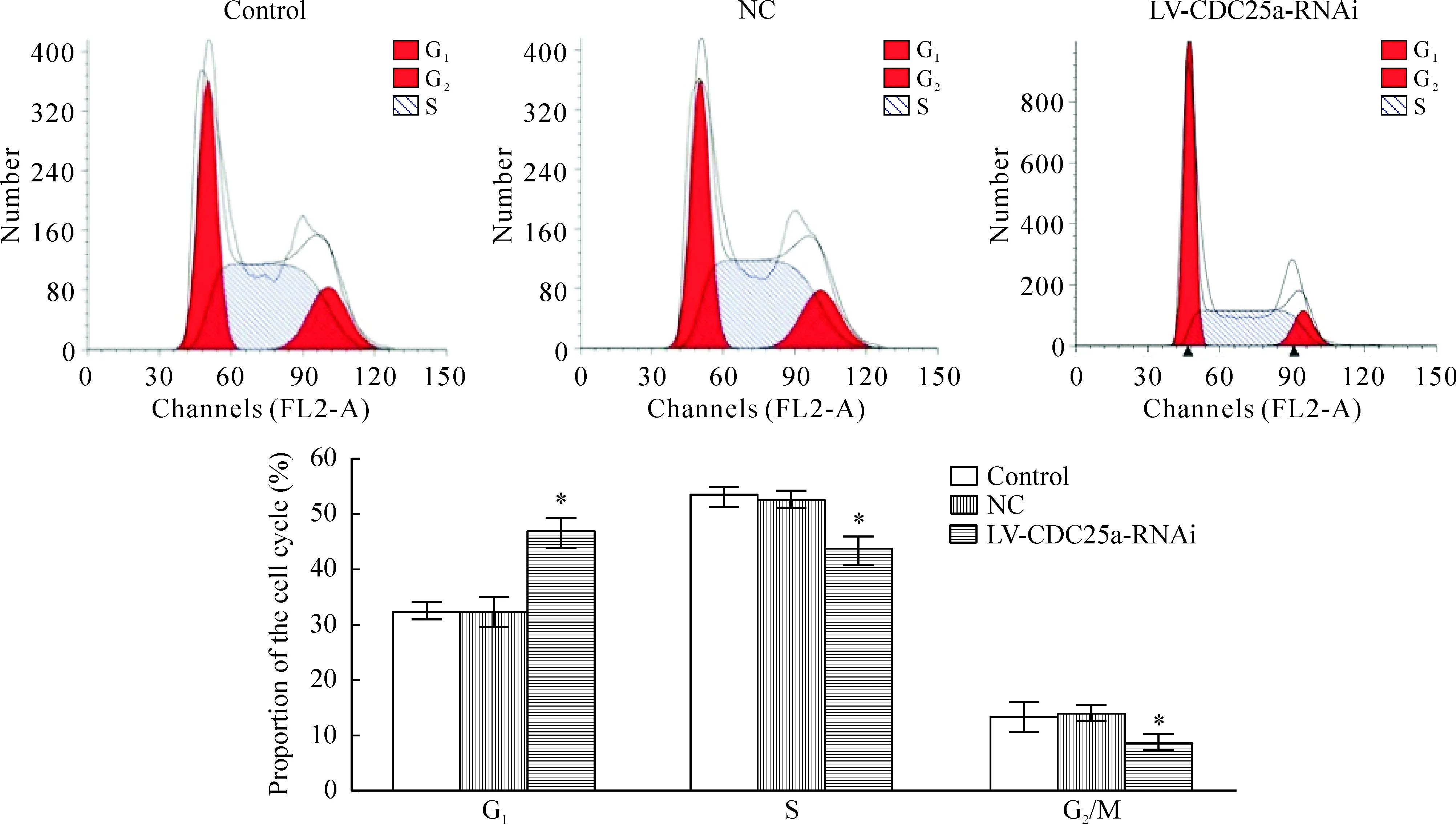
Figure 7.Flow cytometry analysis of the cell cycle in control group, NC group and LV-CDC25a-RNAi groups. Mean±SD.n=20.*P<0.05vscontrol group and NC group.
图7 流式细胞术检测各组细胞的细胞周期比例
讨 论
CDC25基因所表达的蛋白CDC25磷酸酶,属于细胞周期调控蛋白,主要分为CDC25a、CDC25b、CDC25c 3种。CDC25a作用于cyclin A/CDK2和cyclin E/CDK2,促进细胞从G1进入S期[3]。有实验显示,将CDC25a抗体显微注射到增殖细胞中,可将增殖细胞阻滞在G1期[4],提示CDC25a在G1/S期细胞周期进程中有显著作用。另有研究认为,CDC25a在细胞凋亡中的作用存在差异,在胞质中主要起到抑制细胞凋亡的作用,而在胞核中则起到促进凋亡的作用,总的来说,其作用主要以抑制凋亡为主[5]。CDC25a在许多类型的癌症中过度表达,如乳腺癌、肺癌、卵巢癌、结肠癌及非霍奇金性淋巴瘤等[5-9]。Demidova等[10]发现CDC25a的过度表达可能是p53基因突变的结果。
Xu等[11]发现在肝细胞癌中CDC25a基因同样为过度表达状态;郭艳等[12]研究发现CDC25a基因可能在肝癌的发生及转移过程中发挥重要作用,肝癌组织中CDC25a基因的表达与超声影像相结合可为肝癌临床治疗及预后判断提供理论依据。本课题组前期研究发现CDC25a不仅在人肝癌组织中呈现高表达,在大鼠及树鼩肝癌模型中同样为高表达状态,提示CDC25a表达水平的改变在肝癌的发生发展中起到重要的作用[2]。本实验中我们设计合成了CDC25a小分子干扰RNA,利用慢病毒作为载体,将含有CDC25a小分子干扰RNA的质粒转染至人肝癌HepG2细胞中。通过real-time PCR及Western blotting实验检验CDC25a基因被敲减的效果,并筛选出相对于阴性对照及空白对照组来说沉默效率最高的1号靶点。将1号靶点为最佳靶点转染细胞并大量培养,进行后续的细胞功能实验。MTT实验结果显示,实验组增殖活力明显低于阴性对照及空白对照组,表明CDC25a沉默后的细胞增殖能力下降;Giemsa染色法检测提示转染后的细胞克隆能力比阴性对照及空白对照组的细胞弱;流式细胞术结果则显示细胞被滞留于G1期,提示细胞增殖受到抑制。
上述细胞功能实验结果显示,RNA干扰CDC25a基因后肝癌细胞的周期受到阻滞,细胞停留在G1期无法进入S期进行增殖,其增殖功能受到明显抑制。有学者[15]提出CDC25a可作为癌症药物的一个潜在靶点[13-14],2008年有学者提出可以将CDC25a作为肝癌药物治疗的靶点。肝癌作为常见的消化系统肿瘤,具有发现晚,死亡率高的特点,治疗手段主要以早期手术治疗为主。目前国内尚无沉默肝癌细胞中的CDC25a基因并观察沉默细胞增殖能力变化这方面的研究,本实验从内源性将肝癌细胞中的CDC25a基因沉默并后续进行沉默细胞的增殖能力检测,其结果为CDC25a基因成为肝癌药物治疗的一个有效靶点提供更加有利的依据。
[1] Shen T, Huang S. The role of Cdc25A in the regulation of cell proliferation and apoptosis[J]. Anticancer Agents Med Chem, 2012, 12(6):631-639.
[2] 卢晓旭,曹 骥,李 瑗,等.CDC25a在跨种属肝癌组织中的表达及其意义[J]. 中国病理生理杂志,2014,30(5):820-824.
[3] Krauss G. Biochemistry of signal transduction and regulation[M].第3版.北京:化学工业出版社,2005.321-324.
[4] Hoffmann I, Draetta G, Karsenti E. Activation of the phosphatase activity of human Cdc25A by a CDK2-cyclin E dependent phosphorylation at the G1/S transition[J]. EMBO J, 1994, 13(18):4302-4310.
[5] Leisser C, Rosenberger G, Maier S, et al. Subcellular localization of Cdc25A determines cell fate[J]. Cell Death Differ, 2004, 11(1):80-89.
[6] Brunetto E1, Ferrara AM, Rampoldi F, et al. CDC25A protein stability represents a previously unrecognized target of HER2 signaling in human breast cancer: implication for a potential clinical relevance in trastuzumab treatment[J]. Neoplasia, 2013, 15(6):579-590.
[7] Ma H, Chen J, Pan S, et al. Potentially functional polymorphisms in cell cycle genes and the survival of non-small cell lung cancer in a Chinese population[J]. Lung Cancer, 2011, 73(1):32-37.
[8] Cruz-Bravo RK, Guevara-González RG, Ramos-Gómez M, et al. The fermented non-digestible fraction of common bean (Phaseolus vulgaris L) triggers cell cycle arrest and apoptosis in human colon adenocarcinoma cells[J]. Genes Nutr, 2014, 9(1):359.
[9] Aref S, Fouda M, El-Dosoky E, et al. c-Myc oncogene and Cdc25A cell activating phosphatase expression in non-Hodgkin’s lymphoma[J]. Hematology, 2003, 8(3):183-190.
[10]Demidova AR, Aau MY, Zhuang L, et al. Dual regulation of Cdc25A by Chk1 and p53-ATF3 in DNA replication checkpoint control[J]. J Biol Chem, 2009, 284(7):4132-4139.
[11]Xu X,Yamamoto H, Sakon M, et al. Overexpression of Cdc25A phosphatase is associated with hypergrowth activity and poor prognosis of human hepatocellular carcinomas[J]. Clin Cancer Res, 2003, 9(5):1764-1772.
[12]郭 艳,王 茜,杨志杰.原发性肝细胞癌CDC25A的表达与多普勒超声影像特征的关联性分析[J].世界华人消化杂志,2013,21(26):2649-2654.
[13]Lazo J, Wipf P. Is Cdc25 a druggable target[J]. Anticancer Agents Med Chem, 2008, 8(8):837-842.
[14]Lavecchia A, Di Giovanni C, Novellino E. Cdc25A and B dual-specificity phosphatase inhibitors: potential agents for cancer therapy[J]. Curr Med Chem, 2009, 16(15):1831-1849.
[15]Xu X, Yamamoto H, Liu G, et al. CDC25A inhibition suppresses the growth and invasion of human hepatocellular carcinoma cells[J]. Int J Mol Med, 2008, 21(2): 145-152.
Effects of RNA interference targetingCDC25agene on proliferation of human liver cancer HepG2 cells
LI Wei, CAO Ji, ZHOU Ling-li, LUO Wang, YANG Chun, LUO Cheng-piao, LI Yuan, SU Jian-jia
(InstituteforTreatmentandPreventionofTumor,GuangxiZhuangAutonomousRegion,Nanning530021,China.E-mail:caojicn@163.com)
AIM: To investigate the effect of silencing cell division cycle 25a (CDC25a) gene on the proliferation of human hepatoma HepG2 cells. METHODS:CDC25agene in human hepatoma HepG2 cells was silenced by RNA interference. Real-time PCR was applied to detect the expression of CDC25a, cyclin E and CDK2 at mRNA levels in the HepG2 cells. Western blotting was applied to detect the expression of CDC25a at protein level. In addition, MTT assay, Giemsa staining and flow cytometry were used to measure the proliferation of human hepatoma HepG2 cells. RESULTS: The expression of CDC25a at mRNA and protein levels in RNA silence group was lower than those in negative control group and normal control group (P<0.05). The mRNA expression of cyclin E and CDK2 in silence group was lower than that in negative control group and normal control group (P<0.05). The cell proliferation in silence group was lower than that in negative control group and normal control group (P<0.05). The results of flow cytometry revealed that the cells in silence group were blocked in G1phase. CONCLUSION: Infection of LV-CDC25a-RNAi recombinant to the HepG2 cells effectively inhibits theCDC25agene expression and the proliferation of human hepatoma cells, and arrests the cells in G1phase, suggesting thatCDC25agene may be a key target for the treatment of liver cancer.
Genes,CDC25a; RNA interference; Liver neoplasms
1000- 4718(2014)12- 2142- 06
2014- 07- 24
2014- 10- 31
国家自然科学基金资助项目(No. 30960428); 广西科技基础条件平台建设项目(No. 10-108-25); 广西科学基金资助项目(No. 2013GXNSFAA019210)
R73-3
A
10.3969/j.issn.1000- 4718.2014.12.005
△通讯作者 Tel: 0771-5310593; E-mail: caojicn@163.com
