Livin基因在Ⅱ~Ⅲ期结直肠癌组织中的表达及临床意义
2014-07-18刘帅峰
刘帅峰
·临床医学·
Livin基因在Ⅱ~Ⅲ期结直肠癌组织中的表达及临床意义
刘帅峰
目的 探讨组织Livin mRNA表达在直肠癌病理分期Ⅱ、Ⅲ期的差异性, 并对其临床意义进行分析。方法 选取本院收治的Ⅱ、Ⅲ期直肠癌患者各30例, 行外科根治术;取术后病理组织及周边健康组织, 分别以RT-PCR的方法检测Livin mRNA的阳性表达率, 对比其差异性;同时, 结合肿瘤体积、病理形态、Dukes分期、进展情况及患者预后等情况分析该差异表达基因所代表的临床意义。结果 Ⅱ期直肠癌患者病理组织及周边健康组织的Livin mRNA阳性表达率分别为63.3%、6.67%,Ⅲ期直肠癌患者相应数据为86.7%、10%;两组患者病理组织Livin mRNA阳性表达率均显著高于周边健康组织(P<0.05), 且Ⅲ期患者病理组织Livin mRNA阳性表达率显著高于Ⅱ期患者病理组织(P<0.05)。Livin mRNA的阳性表达率与肿瘤分化程度及患者术后复发密切相关(P<0.05), 而与其大小、病理形态及Dukes分期无显著关联(P<0.05)。结论 Livin 可能通过激活肿瘤细胞的分化过程发挥致癌活性, mRNA呈阳性表达患者的肿瘤细胞可能具备更高的分化能力和术后复发率。
Livin;mRNA表达;直肠癌;病理分期;临床意义
直肠癌在发病率和致死率上均居于各恶性肿瘤前列, 据流行病学调查结果显示, 其发病年龄日趋年轻化, 发病群体日趋多极化, 已逐渐成为现代医学发展道路上有待解决的紧迫问题之一。Livin是凋亡抑制蛋白(inhibitor of apoptosis protein, IAP)家族成员之一, 在消化系统、呼吸系统、生殖系统、循环系统等恶性肿瘤中均有高表达现象[1-3]。本实验以直肠癌为研究重点, 探讨Livin mRNA表达在直肠癌Ⅱ、Ⅲ期的差异性及其临床意义, 报告如下。
1 资料与方法
1.1一般资料 选取本院收治的Ⅱ、Ⅲ期直肠癌患者各30例, 所有患者均行择期外科根治术。两组患者在年龄、性别及肿瘤Dukes分期等方面差异无统计学意义(P>0.05)。
1.1.1Ⅱ期:男14例, 女16例, 年龄33~72岁, 平均(57.4±14.7)岁。分化程度:低分化7例;中分化13例;高分化10例。Dukes分期:A期4例;B期11例;C期9例;D期6例。
1.1.2Ⅲ期:男15例, 女15例, 年龄31~71岁, 平均(57.7±15.9)岁。分化程度:低分化4例;中分化12例;高分化14例。Dukes分期:A期5例;B期10例;C期8例;D期7例。
1.2主要仪器 低温超速离心机(Beckman, XL90);葡聚糖凝胶电泳及其配套装置(北京六一仪器厂,DYY-4);全自动紫外-可见分析装置(上海复日, FR200);Mastercycler pro梯度PCR仪(eppendorf, Mastercycler pro);微量电动组织匀装器(美国KIMBLE, 749540);核酸蛋白测定仪(Eppendorf 公司, Biophotometerplus)等。
1.3主要试剂
1.3.1RNA提取:总RNA提取试剂盒提取试剂盒(北京鼎国昌盛生物技术有限责任公司, NEP019-1);氯仿、无水乙醇等其他试剂均为国产分析纯。
1.3.2RT试剂:Oligod (T)18 primers (TaKaRa 公司, D511);M-MLV RT (Promega 公司, M1701 );Ribonuclease Inhibitor (TaKaRa 公司, D2313A);10 mmol dNTP Mixture (TaKaRa公司, D4030RA);DEPC (Sigma 公司)等。
1.3.3PCR试剂:2.5 mmol dNTP Mixture (TaKaRa公司, D4030A);rTaq酶 (TaKaRa公司, DRIOOA);DL500marker (TaKaRa公司, DL )等。
1.3.4凝胶电泳试剂:琼脂糖(BIOWEST, 91622);DNA green (北京天恩泽, 70303)等。
1.4研究方法
1.4.1RT-PCR方法 以总RNA提取试剂盒提取组织mRNA,使用Mastercycler pro梯度PCR仪自动完成常规反转录和扩增过程, 各反应体系依据产品说明书设定。
反转录条件:42℃ 30 min;82℃ 5 min。扩增条件:94℃ 2 min预变性;(94℃ 45 s, 55℃ 45 s, 72℃ 45 s)32循环;72℃延伸5 min。扩增后所得产物进行3%琼脂糖凝胶(含DNA green)电泳, 稳压100 V, 电泳40~50 min, 以全自动紫外-可见分析装置观察, 计算相对光度值。基因引物序列见表1。
1.4.2统计学方法 所得Livin mRNA阳性表达数据均以率或构成比表示, 以统计学软件SPSS17.0行χ2检验, 检验标准:α=0.05, P<0.05表示差异有统计学意义。
2 结果
2.1Ⅱ、Ⅲ期患者的Livin mRNA表达阳性率比较 两组患者病理组织Livin mRNA阳性表达率均显著高于周边健康组织(P<0.05), 且Ⅲ期患者病理组织Livin mRNA阳性表达率显著高于Ⅱ期患者病理组织(P<0.05)。见表2。
2.2Livin mRNA的阳性表达率与肿瘤情况及患者预后的关系 Livin mRNA的阳性表达率与肿瘤分化程度及患者预后复发密切相关(P<0.05), 而与其大小、病理形态及Dukes分期无显著关联(P<0.05)。见表3。
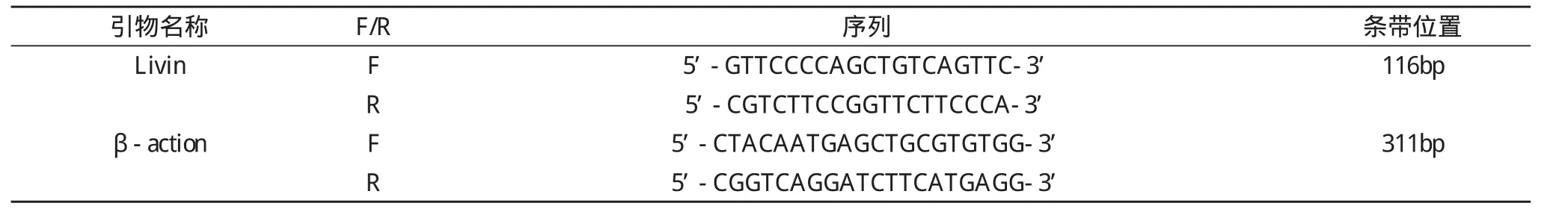
表1引物序列

表2Ⅱ、Ⅲ期患者的Livin mRNA表达阳性率结果统计(n, %)

表3Livin mRNA的阳性表达率与肿瘤情况及患者预后的关系(n, %)
3 讨论
随着恶性肿瘤研究领域的扩展及研究层次的递进, 其分子生物学机制得到进一步挖掘;当前研究表明, 细胞无限制增殖和生长的异常行为过程是恶性肿瘤生成和进行性发展的重要条件, 凋亡因子及凋亡抑制因子的共调节在这一过程中起决定性作用[4]。Livin为近年发现的新型抗凋亡蛋白, 属IAP家族成员之一, 基于其在多种恶性肿瘤中的广泛性表达,迅速成为当前癌症研究领域的热点问题。研究表明, Livin的相关抗凋亡机制主要集中于两条途径[5,6]:①直接抑制凋亡蛋白酶活性;②通过活化TAK1/JNK1及PI3K/Akt信号传导阻止TNF-α和IL诱导的细胞凋亡。
本研究结果显示, 直肠癌患者病理组织的Livin mRNA阳性表达率显著高于周边健康组织;且Ⅲ期癌患者病理组织的Livin mRNA阳性表达率显著高于Ⅱ期患者;提示Livin mRNA阳性表达率与直肠癌的发生和进展有关。经单因素分析, Livin mRNA的阳性表达率与肿瘤分化程度及患者预后复发密切相关, 而与其大小、病理形态及Dukes分期无显著关联。进一步提示Livin可能通过激活肿瘤细胞的分化过程发挥致癌活性;同时, 也说明其mRNA呈阳性表达患者的肿瘤细胞可能具备更高的分化能力和术后复发率。
[1] Chen H, Jin Y, Chen T, et al.The antitumor effect of human cord blood-derived dendritic cells modified by the livin α gene in lung cancer cell lines.Oncol Rep, 2013, 29(2):619-627.
[2] Ye L, Li S, Ye D, et al.Livin expression may be regulated by miR-198 in human prostate cancer cell lines.Eur J Cancer, 2013, 49(3):734-740.
[3] Liang YZ, Fang TY, Xu HG, et al.Expression of CD44v6 and Livin in gastric cancer tissue.Chin Med J (Engl), 2012, 125(17):3161-3165.
[4] 崔阳阳,陆建波.Livin及其相关因子的最新研究进展.医学综述, 2012,18(5):651-653.
[5] Zhu Z, Sun H, Ma G, et al.Bufalin Induces Lung Cancer Cell Apoptosis via the Inhibition of PI3K/Akt Pathway.Int J Mol Sci, 2012, 13(2):2025-2035.
[6] 李辰生,王吉文.Livin抑制凋亡的作用机制及其与肿瘤治疗的关系的研究进展.中国普通外科杂志, 2013,22(1):104-108.
471000 郑州大学附属洛阳中心医院胃肠胰腺外科
