蛙皮素对大鼠IL-1β性发热反应及下丘脑中HSP70含量的影响
2014-07-18杨智航张量孟庆超闫安
杨智航 张量 孟庆超 闫安
·实验研究·
蛙皮素对大鼠IL-1β性发热反应及下丘脑中HSP70含量的影响
杨智航 张量 孟庆超 闫安
目的研究蛙皮素(BN)对白细胞介素-1β(IL-1β)引起的发热反应的影响, 并探讨其与热休克蛋白70(HSP70)表达的关系。方法成年健康SD雄性大鼠80只, 随机分为四组:对照组(Control组)、蛙皮素组(BN组)、白细胞介素-1β组(IL-1β组)、蛙皮素+白细胞介素-1β组(BN+IL-1β组), 检测大鼠体温变化情况, 采用Western blot方法测定大鼠下丘脑中HSP70表达的变化。结果与Control组相比, IL-1β组大鼠体温升高, 下丘脑中HSP70含量显著升高(P<0.05);BN组大鼠体温降低,下丘脑中HSP70含量显著降低(P<0.05);BN+IL-1β组预先10 min侧脑室注射BN, 能明显抑制大鼠IL-1β性发热, 且体温及下丘脑中HSP70含量变化范围介于IL-1β组与BN组之间(P<0.05)。结论蛙皮素对IL-1β性发热反应具有拮抗作用, 其机制有可能与HSP70表达水平有关。
蛙皮素;白细胞介素-1β;热休克蛋白质70;发热
体温是反应机体稳态的重要指标, 长期发热或高热会影响机体正常新陈代谢, 引起下丘脑体温调节中枢合成热休克蛋白70(Heat Shock Protein 70, HSP70)增多, 以增强细胞对损害的耐受程度, 维持细胞的正常功能代谢。蛙皮素(bombesin, BN)具有强烈的降低体温作用, 但其作用机制尚无一致性结论。本研究旨在探讨BN的降温作用与HSP70表达之间的关系, 分析BN降低体温中HSP70的作用, 进而为BN在临床治疗发热奠定理论基础。
1 材料与方法
1.1药品与仪器 BN, IL-1β(北京宝赛生物技术有限公司产品), HSP70抗体。SN-2型立体定位仪(日本东京仪器厂), SN2202型数字温度计(北京司南仪器厂)。
1.2实验动物及分组 由沈阳医学院实验动物中心提供成年健康雄性SD大鼠, 体重180~210 g。在室温(22±2)℃、湿度(50±2)%、光照6:00~18:00的条件下单笼饲养, 自由进食水。80只大鼠随机分为四组, 每组20只:Control组侧脑室注射人工脑脊液10 μl;BN组侧脑室注射BN 0.7 μg/10 μl;IL-1β组侧脑室注射IL-1β 0.1 μg/10 μl、BN+IL-1β组侧脑室先注射BN 0.7 μg/10 μl, 10 min后再注射IL-1β 0.1 μg/10 μl。
1.3侧脑室插管、给药及体温测量 大鼠称重麻醉后, 用立体定位仪固定, 按Pellegrine 图谱向右侧脑室置入P10~P20组合的脑室插管, 用牙科水泥固定, 生理盐水测试插管通畅,加热封闭插管上端塑料管[1]。常规、单笼饲养1周后开始实验, 剪去封闭的塑料管, 经侧脑室插管给药, 单次剂量均为10 μl。
实验前对大鼠测温7 d, 使其习服操作人手法。数字温度计探头插入大鼠直肠6 cm, 数字稳定后读数。将给药前1 h内测得的3次直肠温度的平均值作为大鼠的基础体温, 可用范围(37.5±1.0)℃。经侧脑室给药后分别记录下15、30、45、60、90、120、180 min时的大鼠直肠温度值, 输入计算机进行数据处理, 获得发热潜伏时、ΔT(即时体温与基础体温之差)、发热高峰时, 利用这些数据做出发热标准曲线, 体温变化情况采用发热高峰ΔTmax和体温反应指数(temperature response index, TRI)分析。
1.4Western blot法检测HSP70的表达水平 根据各组温度曲线, 在IL-1β体温达到峰值时间点, 即给药后90 min断头取下丘脑, 即刻置液氮冷冻, 而后-80℃保存。HSP70为小鼠抗大鼠抗体, 稀释比1:200, 以β-actin为内对照, 采用Fluor Chen 2.0软件对各条带的整合光密度值(integrated density value, IDV)进行定量分析, 结果以HSP70/β-actin的IDV比值表示。
1.5统计学方法 采用SPSS13.0统计学软件对实验数据进行统计分析, 计量资料以均数±标准差表示, 采用t检验。P<0.05为差异具有统计学意义。
2 结果
2.1侧脑室给药后各组体温反应曲线 通过留置于SD大鼠侧脑室的插管给药10 μl后, 见图1:Control组注射人工脑脊液后无明显发热, 各时间点体温变化不大;IL-1β组注射0.1 μg/10 μl IL-1β后体温逐渐升高, 90 min时达到峰值, 而后逐渐下降, 各时间点体温均高于Control组, 差异具有统计学意义(P<0.05);BN组注射0.7 μg/10 μl BN后体温先逐渐下降, 60 min时达到最低点, 而后逐渐上升, 各时间点体温均低于Control组, 差异具有统计学意义(P<0.05);BN+IL-1β组先注射0.7 μg/10 μl BN, 10 min后注射0.1 μg/10 μl IL-1β,体温反应曲线呈“S”型, 各时间点体温值基本介于IL-1β组和BN组之间, 且90 min前低于Control组, 90 min后高于Control组, 最低点和最高点分别出现在30 min和120 min, 除 90 min点外, 其余各时间点体温与Control组相比较差异具有统计学意义(P<0.05)。与Control组相比, 各实验组体温均有改变, 且差异具有统计学意义(P<0.05), ΔTmax从低到高的顺序:Contorl组<BN+IL-1β组<BN组<IL-1β组, 各组TRI3的变化趋势与ΔTmax相同。实验过程中各组的最大体温变化值(ΔTmax)及体温反应指数TRI3数据见表1。

图1 不同组大鼠体温变化曲线
表1不同组最大体温变化值及体温反应指数比较
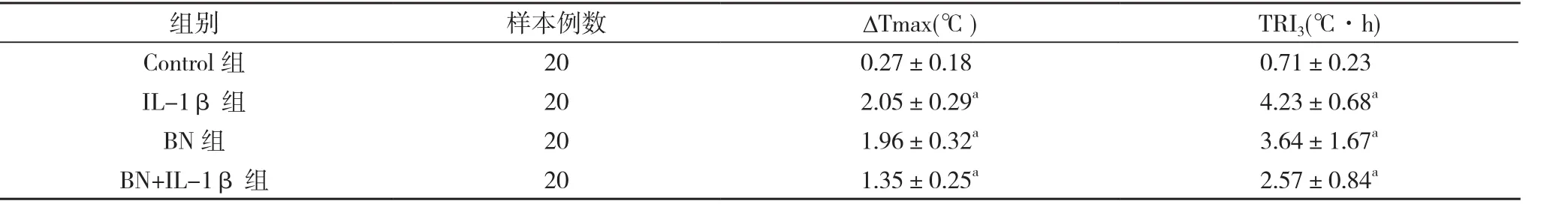
表1不同组最大体温变化值及体温反应指数比较
注:与Control组比较,aP<0.05
组别样本例数ΔTmax(℃)TRI3(℃· h) Control组200.27±0.180.71±0.23 IL-1β组202.05±0.29a4.23±0.68aBN组201.96±0.32a3.64±1.67aBN+IL-1β组201.35±0.25a2.57±0.84a
2.2Western blot法测定HSP70的表达水平 Control组和BN+IL-1β组下丘脑组织中HSP70表达水平相近, 且明显低于IL-1β组, 而高于BN组。 各组条带HSP70/β-actin的IDV比值, 由低到高顺序为BN组(0.1545±0.0146)<Control组(0.2348±0.0221)< BN+IL-1β组(0.2432±0.0235)<IL-1β组(0.3147±0.0327), 除Control组和BN+IL-1β组两组间差异无统计学意义(P>0.05)外, 其余各组两两比较, 差异均有统计学意义(P<0.05)。各组下丘脑组织中HSP70蛋白的表达,见图2。

图2 各组下丘脑组织中HSP70的表达
3 讨论
作者的研究结果显示:侧脑室注射外源性IL-1β后,可引起大鼠体温逐渐升高, 90 min时达到峰值, 同时HSP70的表达水平也显著高于Control组及其他实验组(P<0.05)。这提示发热可以使机体处于应激状态, 诱导HSP70这种重要的应激反应蛋白表达增高, 发挥保护性作用。Mathur 等[2]认为,若高温应激未能引起HSP70的高表达, 则中暑发生的风险性更大。其机制可能是由于HSP70可以通过保护蛋白质的结构, 修复高温引起的蛋白质和DNA损伤, 调节重要功能蛋白质的分布, 并促进其功能实现, 以维持细胞的内稳态, 增强细胞抗御损伤的能力[3]。马中女等[4]研究证实, 外源性致热源脂多糖(LPS)引起发热时, 可激活HSP70, 进而抑制肿瘤坏死因子-α(TNF-α)、IL-1β等内生致热源的产生而控制体温升高。
BN是一种具有广泛生物学活性的脑肠肽, 参与体内多种生理功能的调节, 尤其是在体温调节方面发挥着重要作用。有研究证明:BN具有调节内源性精氨酸加压素(AVP)的释放能力, 在干扰素(IFN)引起发热时, 可能通过增加AVP的释放量, 使体温恢复正常[5];BN还具有抑制前列腺素(PGE)[6]或cAMP的合成与释放的作用, 这可能是BN降低大鼠正常体温和抑制IL-1β的致热作用的关键。研究结果显示:侧脑室注射BN可使大鼠体温降低, 其下丘脑中HSP70含量显著降低(P<0.05);预先10 min侧脑室注射BN, 能明显抑制大鼠IL-1β性发热, 且体温及下丘脑中HSP70含量变化范围介于IL-1β组与BN组之间(P<0.05), 提示BN拮抗IL-1β性发热可能与降低HSP70的表达水平有关。但BN引起的HSP70的表达降低后通过哪种信号传导路发挥作用, 尚需进一步研究证实。
本研究结果表明:大鼠下丘脑HSP70蛋白含量在IL-1β性发热时明显增加, 在BN引起降温作用时则降低, BN能够拮抗IL-1β性发热, 这种拮抗作用可能与HSP70表达水平有关。
[1] 张琪, 谭颖颖.侧脑室慢性灌流(pyr1)apelin-13对大鼠心血管功能的影响.中国药理学通报, 2014, 30(1):144-145.
[2] Mathur S, Walley KR, Wang Y, et al.Extracellular heat shock protein 70 induces cardiomyocyte inflammation and contractile dysfunction via TLR2.Circ J, 2011, 75(10):2445-2452.
[3] Luo Q, Jiang L, Chen G, et al.Constitutive heat shock protein 70 interacts with α-enolase and protects cardiomyocytes against oxidative stress.Free Radic Res, 2011, 45(11-12):1355-1365.
[4] 马中女, 杨丽娟, 蒋淑君, 等.家兔发热过程中单核细胞热休克蛋白70表达与白细胞介素-1β、肿瘤坏死因子-α mRNA表达的关系.中国现代医学杂志, 2014, 24(3):16-20.
[5] 周晓阳, 张 量, 赵书芬.蛙皮素对大鼠IFN性发热反应及脑内AVP含量的影响.中国应用生理学杂志, 2004, 20(3):393-396.
[6] 张量, 孙大宇, 江敏.低温时蛙皮素对IL-1β致热大鼠的降温作用及与PGE2的相关性.中国医药导报, 2011, 8(5):21-23.
2014-08-01]
辽宁省科技计划项目(项目编号:2011225020)
110034 沈阳医学院基础医学院生理教研室
张量
