枸橼酸作用下纳米铁氧化物晶体的形成研究
2014-07-16孙百虎
孙百虎
(石家庄职业技术学院 化学工程系,河北 石家庄 050081)
顺磁性纳米级铁氧化物在临床靶向制剂的载体研发和磁性辅助治疗上具有很大的潜力.这种纳米级的铁氧化物在临床上具有巨大优势,主要体现在静脉注射毒性小,所载药物结构分散、稳定,施药安全等方面.尽管如此,纳米级铁氧化物仍需要在晶型稳定性、结构分散性和晶体纳米级别等几个方面开展深入的研究.
纳米级铁氧化物粒子较小,且粒子之间存在着磁性引力和范德华力,使用时容易发生凝聚.汪汉斌、刘祖黎、卢华强等[1]引入枸橼酸根,在氧化沉淀法中利用枸橼酸根同Fe3+发生反应而抑制铁氧化物晶粒的继续生长,得到了小于5nm的Fe3+纳米级粒子,且枸橼酸根浓度越大,对铁氧化物的抑制作用越强,得到的纳米级粒子粒径就越小.黄光斗、贾泽宝、胡兵等[2]认为,Zeta电位和电荷密度是对分散剂的分散性进行检测和考量的有效参数,其采用目前比较常见的氧化沉淀法,向反应体系中加入枸橼酸,通过调节pH值的变化范围,使铁氧化物在等电点时带负电,根据同电相斥原理,对铁氧化物结晶颗粒起到分散作用,从而得到纳米级铁氧化物.
不同结晶方式会产生不同粒径的铁氧化物,呈现的纳米性质也不同,如粒径小于10nm常常表现出超顺磁性[3],在临床上有巨大的应用价值.铁氧化物的颗粒分散于吸附表面活性剂的载液中可生成磁性液体材料.但是,普通方法得到的纳米铁氧化物的顺磁性差,容易发生团聚,不易分散.尽管目前使用有机铁为原料制备的铁氧化物产物的分散性较好,但成本较高,所以探索制备低成本、粒径可控的、安全性高、分散性好的纳米级铁氧化物的方法具有重要的应用价值[4-5].
1 试验仪器和试剂
1.1 仪器
磁力搅拌器、高压反应釜、马福炉、德国布鲁克公司的D8DSADVANCE型X射线衍射仪(Cu靶、Ka、λ=1.541 8Å、扫描范围为50°~80°、扫描速度为2.4°/min、闪烁计数器线性范围为2×10-6次/s、测角仪角度重现性为0.000 1度)、PHS-3C型数字酸度计、分析天平、烧杯、滴定管、容量瓶等.
1.2 试剂
硫磷混酸、枸橼酸溶液、重铬酸钾、1mol/L FeSO4溶 液、1mol/L NaOH 溶 液、0.01mol/L K2Cr2O7标准溶液、浓盐酸,以上试剂均为A.R..
2 试验过程
2.1 溶液的配置及标定
2.1.1 溶液的配制
(1)二苯胺磺酸钠指示剂
将0.25g二苯胺磺酸钠溶于50mL去离子水中,待溶液体系稳定后,缓慢滴加2~3滴98%的浓硫酸待用.
(2)硫磷混酸
将150mL浓硫酸缓慢加入五倍体积的去离子水中(一边搅拌一边加),待体系冷却后再加入约等于混合液1/6体积的浓磷酸,用玻璃棒缓慢搅拌,待体系冷却后备用.
(3)0.01mol/L K2Cr2O7标准溶液
将K2Cr2O7在预先调温145℃~155℃的烘箱中烘干24h,待冷却后用分析天平准确称取1.94g,用150mL去离子水溶解,定容至1000mL备用.
(4)10%枸橼酸溶液
将2g柠檬酸溶于18mL去离子水中,完全溶解后收入试剂瓶中备用.
(5)1mol/L FeSO4
称取56g低碳铁,用25%的硫酸溶液溶解,用化学计量法计算出适量的浓度,抽滤,得浅绿色FeSO4溶液,放至试剂瓶中备用.
2.1.2 FeSO4溶液的标定
取20mL FeSO4溶液加入锥形瓶中,再加入约400mL的硫磷混酸,滴入2~4滴二苯胺磺酸钠指示剂,用0.01mol/L K2Cr2O7标准溶液进行滴定,至体系呈紫色,30s不褪色即为终点.反应原理为:6Fe2++Cr2O72-+14H+=6Fe3++2Cr3++7H2O.计算公式为:cFeSO4=c×V×6.其中,c为 K2Cr2O7标准溶液的浓度(mol/L),V为消耗K2Cr2O7标准溶液的体积(mL).
2.2 产物的制备、处理及表征
2.2.1 产物的制备
准确量取20mL FeSO4溶液置于圆底套杯中,加入去离子水,开动磁力搅拌器,滴加少量枸橼酸,用NaOH溶液调节体系初始pH至预定值,定容至100mL.通入空气,控制流速,并控制体系温度为20℃.在反应过程中,反应液的颜色起始为灰白色,待反应一段时间体系变为墨绿色粘稠状物体,最后,产物变为棕黑色,停止搅拌,关闭空气阀.用滤斗过滤产物,并用去离子水洗涤,放入马福炉200℃烘干.
2.2.2 产物的处理
将抽滤所得产物先用去离子水洗涤一次,再用1mol/L的氨水溶液对产物洗涤数次,而后再用去离子水洗涤三次以除去铵根离子,将其放于真空干燥箱中,设定温度60℃,干燥24h,取出产物在研钵中研磨成细粉状,装入洁净的真空自封袋,存于干燥器中备用.
2.2.3 产物的表征
采用德国布鲁克公司的D8DSADVANCE型X射线衍射仪来测定产物的XRD图谱[6],并对得到的图谱进行分析.
3 结果讨论
3.1 当pH=8时,枸橼酸对制备纳米铁氧化物的影响
具体情况见图1.
由图1知,当体系中没有添加枸橼酸时,得到碱性且结晶形状不好的α和γ纳米铁氧化物的混合物相.当添加枸橼酸5mL时,产物多半属于γ型碱性铁氧化物,结晶形状不理想.当继续增加至10mL和20mL时,得到γ-FeOOH,晶形更差.随着枸橼酸加入量的增加,产物基本无定型,说明枸橼酸的浓度增大会抑制铁氧化物晶体的生长.

图1 pH=8时纳米铁氧化物的XRD图谱
3.2 当pH=8.5时,枸橼酸对制备纳米铁氧化物的影响
具体情况见图2.
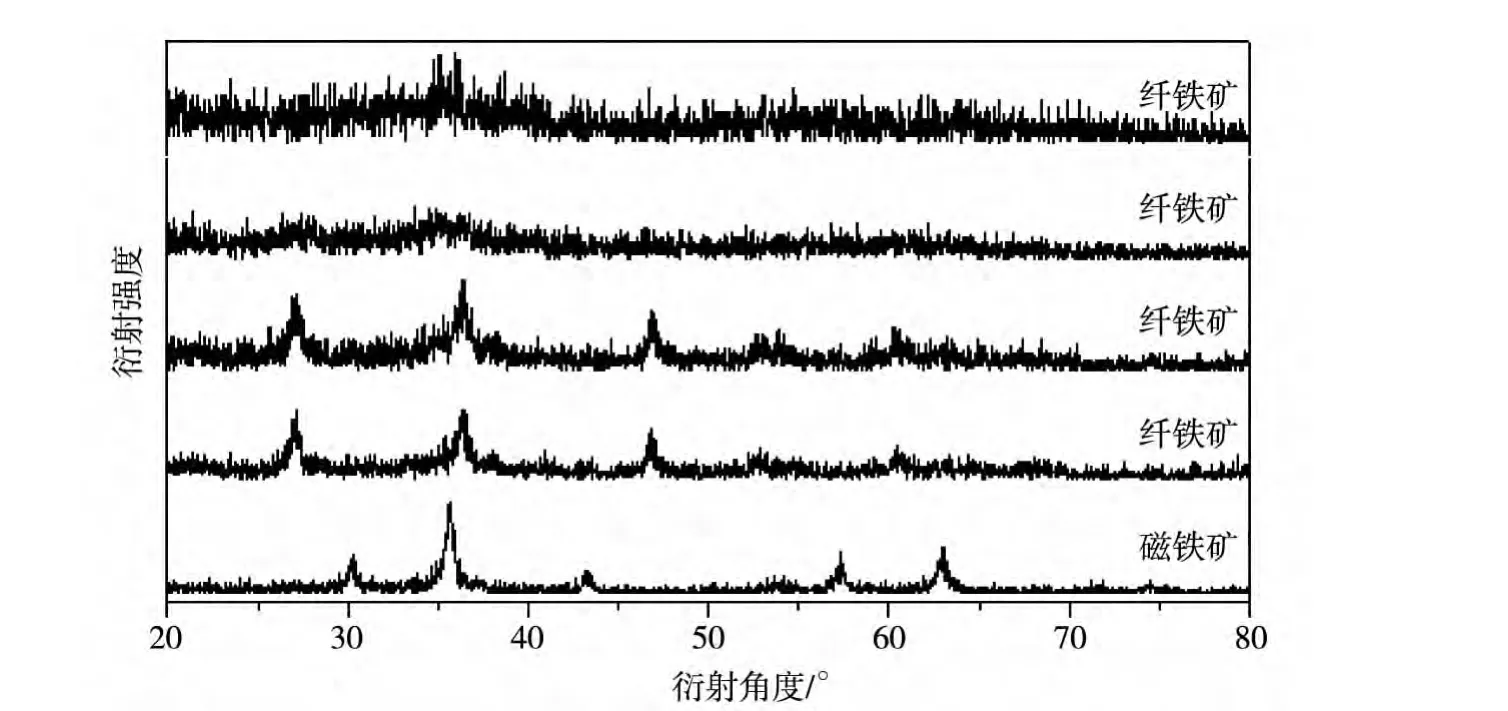
图2 pH=8.5时纳米铁氧化物的XRD图谱
由图2知,当pH=8.5时,加入1mL枸橼酸得到晶形一般的Fe3O4;加入2mL枸橼酸得到晶形不够理想的γ-FeOOH;再增加枸橼酸至20mL时,晶型更加不好,原有的结晶峰逐渐消失.
3.3 当pH=9时,枸橼酸对制备纳米铁氧化物的影响
具体情况见图3.

图3 pH=9时纳米铁氧化物的XRD图谱
可以看出,当pH=9时,在未添加枸橼酸的情况下,反应可得到晶形较好的Fe3O4;当加入0.5 mL枸橼酸时也得到纯相晶形好的Fe3O4;当枸橼酸的量增至2mL时,得γ-FeOOH,其峰宽、晶形均不好;增至8mL时晶形更加不好,但仍为γ-FeOOH;当加入枸橼酸增加到20mL时,XRD图谱发生了较大变化,γ型碱性铁氧化物的吸收峰消失.
4 结论
综上可知,在以FeSO4为原料,NaOH为沉淀剂,用空气氧化法制备纳米FeOOH和Fe3O4以研究枸橼酸对纳米铁氧化物的影响时,可以得出以下结论:(1)在pH=8时,不加枸橼酸,得到碱性的、晶型不够理想的α和γ铁氧化物的混合相.少量的枸橼酸有利于γ铁氧化物的形成,而抑制α型铁氧化物的生成.随着枸橼酸浓度的升高,生成的α和γ铁氧化物晶体逐渐消失.(2)在pH=8.5时,枸橼酸抑制Fe3O4的生成.低浓度可得到晶型不好的γ-FeOOH,高浓度无晶体产生.(3)在pH=9且无枸橼酸时,抑制Fe3O4的生成;枸橼酸浓度适当时,可产生γ-FeOOH,但晶型不好;继续增加枸橼酸的量时,最终产物没有晶体产生.这说明,在pH为8~9时,少量枸橼酸有利于铁氧化物晶体的产生;随着pH的升高和枸橼酸浓度的增大,产物结晶消失.
[1]汪汉斌,刘祖黎,卢华强,等.枸橼酸根对Fe3O4纳米颗粒的生长及性能的影响 [J].无机化学学报,2004,20(11):1279-1283.
[2]黄光斗,贾泽宝,胡兵,等.透明氧化铁黄颜料的制备 [J].无机盐工业,1999,31(5):12-14.
[3]MISWA T,HASHIMOTO K,SHIMIDAIRA S.The Mechanism of Formation of Iron Oxide and Oxyhydroxides in Aqueous Solution at Room Temperature[J].Corrosion Scice,1974,14(2):131-149.
[4]SADA E,KUMAZAWA H,AOYAMA M.Reaction Kinetics and Controls of Size and Shape of Goethite Fine Particles in the Pro-ductio Process by Air Oxidation of Alkaline Suspension of Ferrous Hydroxide[J].Chem Eng Commun,1988(71):73-82.
[5]TAMAURA Y J.Studies on the Oxidation of Iron(II)ion During the Formation of Fe3O4andα-FeOOH by air Oxidation of Fe(OH)2Suspensions[J].Chem Soc Dolto Trans,1981(197):1807-1811.
[6]GÉNIN JEAN-MARIE R,RUBY CHRISTIAN,GÉHIN ANTOINE,et al.Synthesis of Green Rusts by Oxidation of Fe(OH)2,Their Products of Oxidation and Reduction of Ferricoxyhydroxides;Eh-pH Pourbaix Diagrams[J].C R Geoscience,2006(338):433-446.
