土壤中金属的生物可给性及其动态变化的研究
2014-07-16尹乃毅崔岩山张震南王姣姣王振洲蔡晓琳
尹乃毅,崔岩山,张震南,王姣姣,王振洲,蔡晓琳
中国科学院大学资源与环境学院,北京 100049
土壤重金属污染已成为全球最为严重的环境问题之一。其中砷、铅、镉、镍、铬、锰均被收录在2011年有害物质优先处理清单中,砷更是排在第一位(Atsdr,2011)。土壤中金属元素进入人体的途径包括食物链、无意口部摄入、呼吸和皮肤接触等,其中食物链途径是土壤金属元素进入人体的主要途径(Abrahams,2002),而无意口部摄入的重金属污染土壤对人体,尤其对儿童体内有害金属的摄入量的贡献率越来越高,甚至成为主要途径。目前,在人体健康风险评价中,研究者主要通过动物实验(in vivo,测定生物有效性)和体外实验(in vitro,测定生物可给性)进行评估。但动物实验存在着费用高、试验周期长、动物的个体差异等一些不足。相对而言,in vitro方法因操作简单、费用低、结果较为准确等优点而受到国内外研究者的广泛关注(崔岩山等, 2010)。近些年,in vitro方法已相对成熟,研究者在生物可给性、影响因素及其在人体健康风险评价方面的应用等方面进行了大量的研究。
目前,in vitro方法主要基于生理学研究结果将胃和小肠阶段的提取时间分别设定为1~3 h、2~6 h。胃阶段,PBET(Physiologically based extraction test)、UBM(Unified BARGE Method)、SBET(Simple bioaccessibility extraction test)和IVG(In vitro gastrointestinal)方法选用的提取时间为1 h,DIN(Method E DIN)方法选用了2 h,而SHIME(Simulator of Human Intestinal Microbial Ecosystems of Infants)的提取时间最长,为3 h;小肠阶段,IVG选择的时间最短,为1 h,PBET、UBM方法选用了2 h,SHIME选用的提取时间为5 h,提取时间最长的是DIN方法的6 h。虽然不同方法之间的对比已有一些报道,但提取时间的不统一不可避免地造成了研究结果的的差异。
通常,in vitro方法在胃肠阶段的提取时间是某特定值,但食物、土壤在人体胃肠的实际停留时间是一个范围值,在相应的停留时间内,土壤中金属的溶出量是否一致,国内外鲜有报道。研究表明,食物在国内外人体的胃肠阶段的停留时间是不同的。对于欧美人群,食物在胃、肠阶段的停留时间分别为2~4 h、5~6 h(John和Ma, 2007);而食物在我国人体胃、肠的停留时间分别为4~6 h、8~9 h(朱大年等, 2008)。目前已有研究者对土壤金属在胃肠阶段的生物可给性进行了大量的研究,但土壤进入胃肠后,土壤中金属在提取时间内的溶出及吸收动态情况的有关研究却很少。本研究将在我国某些已受重金属污染的地区采集土壤,利用改进的PBET方法分析这些土壤中8种金属元素(As、Al、Cd、Cr、Fe、Mn、Ni、Pb)在胃肠阶段提取时间内的溶出动态现象,探讨造成金属溶出动态变化的影响因素,对其溶出机理进行初步探究。研究结果将对土壤中金属在胃肠阶段的提取时间进行优化确定,对不同in vitro方法之间的对比起到一定的参考作用,并对土壤中金属在我国人群胃肠系统中消化吸收的动态行为的研究起到一定的推动作用。
1 材料与方法
1.1 土壤
本研究所用的5个土壤,分别采自我国不同地区的农田和矿区,详情见表1。土壤样品采集后风干,过20目、60目及100目筛,分别保存以备用,其中过20目、100目筛土壤用于土壤基本理化性质分析,过60目筛土壤用于土壤中金属含量的分析和in vitro实验。
1.2 土壤理化性质
土壤pH值:采用水提法,土液比为1﹕2.5,pH计(METTLER TOLEDO SG,CH)测定(鲁如坤,2000);土壤有机质采用重铬酸钾外加热法(鲍士旦,2000);粒度采用激光粒度仪测定(Mastersizer 2000,Malvern,UK);土壤金属总量采用王水、HClO4消解,消煮样品中包括试剂空白和标准土壤样品(GSS-5中国地质样品分析研究中心),用以证实消解及分析过程中的准确性和精度。土壤铁锰铝氧化物采用草酸-草酸铵提取法(许祖贻和陈家坊,1980);土壤金属(Al、Cd、Cr、Fe、Mn、Ni、Pb)总量、铁锰铝氧化物和模拟胃肠液样品中金属(As除外)含量的测定仪器为ICP-OES(OPTIMA5300DV,Perkin-Elmer Co,USA)和土壤As总量和模拟胃肠液样品中As含量的测定仪器为HG-AFS(AFS 3000型,海光,中国)。
1.3 in vitro实验
本研究使用的in vitro实验方法主要采用PBET方法(Ruby等,1996),并参考IVG方法(Rodriguez等,1999)进行了改进。它由2个连续的阶段组成,即胃阶段和小肠阶段,具体操作步骤如下:
(1)胃阶段配制模拟胃液(内含NaCl、柠檬酸、苹果酸、乳酸、冰乙酸、胃蛋白酶等,并用浓盐酸将pH值调为1.5),将模拟胃液(mL)及过60目筛的土壤样品(g)以100﹕1的比例混合于反应器内,每种土壤2个平行,置于37 ℃恒温溶出仪中以模拟人体温度,以振速100 r·min-1振荡,同时通入氩气1 L·min-1模拟胃肠的厌氧环境。分别在20、40、60、80 min时,吸取5 mL反应液,过0.45 μm滤膜,4 ℃保存待测。
(2)小肠阶段用NaHCO3粉末将反应液pH调至7.0,加入胰酶、胆盐,继续置于37 ℃恒温溶出仪中,以100 r·min-1振荡,通入1 L·min-1氩气。其间,每隔15 min左右测定反应液pH值,若偏离7.0,则用浓HCl和NaHCO3饱和溶液调节使其维持在7.0±0.1。分别在1、2、3、4、5 h时吸取5 mL反应液,过0.45 μm滤膜,4℃保存待测。
1.4 结果计算
(1)金属的溶解态量
在胃阶段或小肠阶段,能从单位质量的土壤中溶出的铅的质量,称为土壤金属元素在胃阶段或小肠阶段的溶解态量,可由下式计算。
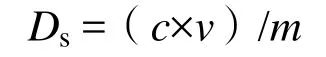
式中,Ds为土壤金属元素在胃阶段或小肠阶段的溶解态量(mg·kg-1);c为in vitro实验胃阶段或小肠阶段反应液中金属的含量(mg·L-1);v为各反应器中反应液的体积(L),胃阶段为0.6 L,小肠阶段为0.59 L;m为反应器中的土壤的质量(kg),胃阶段为0.006kg,小肠阶段为0.0059kg。
(2)溶出率
通常,在PBET方法中,土壤在胃阶段和小肠阶段的停留时间分别定为1 h和4 h,故这两个时间点的溶出率计为 100%,其他时间点的溶出率可由下式计算。
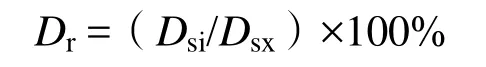
式中,Dr为土壤金属元素在胃阶段或小肠阶段各时间点的溶出率(%);Dsi为某时间点土壤金属元素在胃阶段或小肠阶段的溶解态量(mg·kg-1);Dsx为土壤金属元素在胃阶段1 h或小肠阶段4 h时的溶解态量(mg·kg-1)。
1.5 数据分析方法
采用SPSS18(IBM)和Excel 2010对数据进行分析。
2 结果与分析
2.1 土壤的基本性质
5个土壤的基本理化性质和土壤中金属含量变化范围较大(表1)。pH值变化范围为 3.66~7.28,包括了 1种强酸性土壤(pH<5.0),1种酸性土壤(pH5.0~6.5),3 种中性土壤(pH6.5~7.5)(黄昌勇,2000)。有机质质量分数变化范围为0.88%~4.00%。粘粒质量分数变化范围为0.77%~31.33%。铁、锰、铝氧化物的质量浓度变化范围分别为 0.83~28.20 g·kg-1、0.47~3.61g·kg-1、30.2~539.9 mg·kg-1。
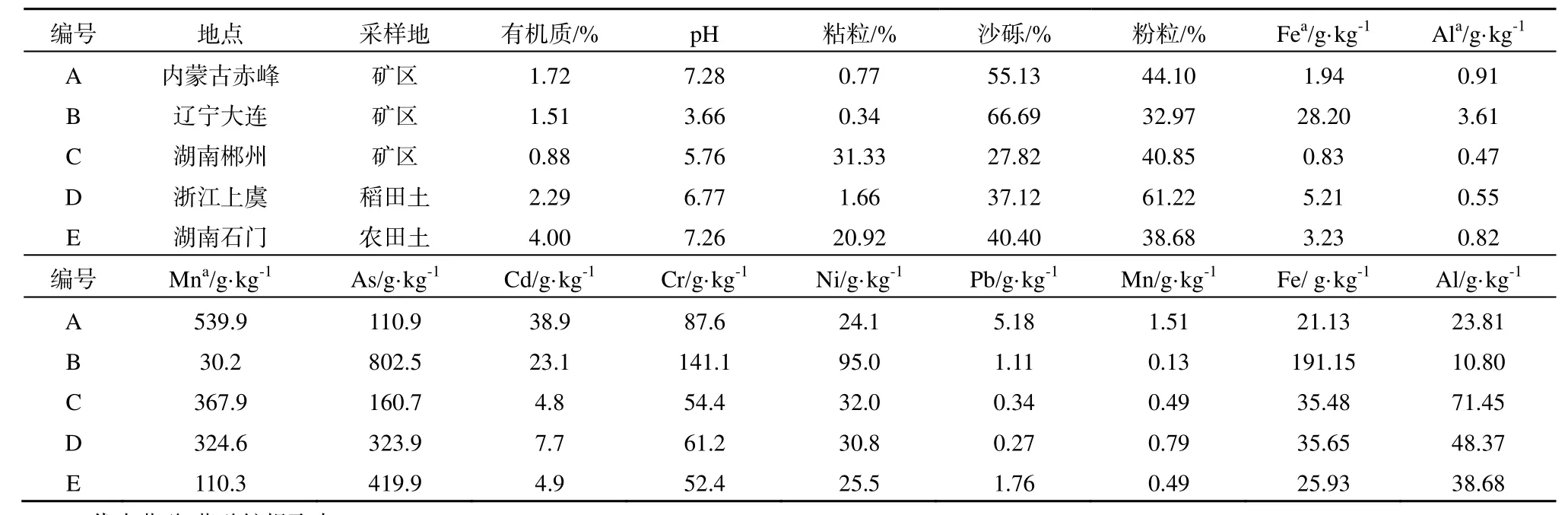
表1 土壤的基本性质Table 1 Basic characteristics of the soils
2.2 胃肠阶段金属的生物可给性(Bioaccessibility,BA)
不同土壤中同一金属的BA在胃肠阶段差异很大。如表2,土壤A中Cd、Cr、Ni及Pb的BA在5种土壤中均是最高,且As在胃阶段的BA最高;土壤B中Al的BA最高,而Cd、Mn、Pb的BA均是最低;土壤C中Al、As、Fe的BA最低,且Cr在胃阶段的BA最低;土壤D中As在小肠阶段的BA最高;土壤E中Mn的BA最高。
此外,同种土壤中不同金属元素的BA也有明显的差异。5种土壤Al和Fe在胃、肠阶段的BA平均值较低,分别为3.3%、3.4%和1.7%、2.3%。而 Cd、为胃阶段的最高值,达 37.6%;Ni为小肠阶段的最高值,达66.1%。小肠阶段各金属元素的BA与胃阶段的相比,Cd、Pb质量浓度呈下降趋势,As、Mn、Cr、Ni均呈现上升趋势,As、Mn均上升了3%左右,Cr、Ni分别上升了29.9%、61.4%。Al、Fe的BA平均值在胃肠阶段基本没变。
2.3 胃阶段金属的溶出动态
不同土壤中同一金属元素的溶出在胃阶段有明显的差异。如图1所示,假定胃阶段1 h时溶出率为100%,20 min时,土壤A中As、Al、Cd、Cr、Fe的溶出率都是最高的,分别达到88.2%、82.6%、93.2%、88.6%、75.0%;土壤B中As溶出率最低,为69.2%,而Mn、Ni的溶出率最高,分别达到82.9%和86.6%;土壤C中Cd、Ni、Pb、Cr的溶出率均是最低,分别为 56.7%、37.5%、60.2%、63.2%;土壤D中Fe的溶出率最低为45.9%,而土壤E中Pb的溶出率最高,达到90.7%。同一金属元素在胃阶段溶出率的变化是相似的,80 min时,Cr的溶出率略有下降,其他金属的溶出率都在增加,但增幅不尽相同。
此外,土壤中不同金属元素的溶出在胃阶段也有明显的差异。20 min时,5种土壤中Fe、Ni的平均溶出率较低,分别为59.3%、56.8%,其他6种金属元素的平均溶出率在71.2%~79.5%,其中 As的平均溶出率最高,达到79.5%。在胃阶段,As、Cd、Pb的溶出速率是先快后慢,Cr和Ni的溶出速率是先慢后快,而Fe、Mn、Al的溶出速率基本保持不变。1 h后,Pb和Cr的溶出率基本保持不变,其他金属的溶出率还在增加,增幅在 8%左右,Ni、Fe的平均增幅很高,分别达到了10.6%、13.9%。这表明土壤中 As、Al、Cd、Fe、Mn、Ni在 1 h 后还在不断溶出。
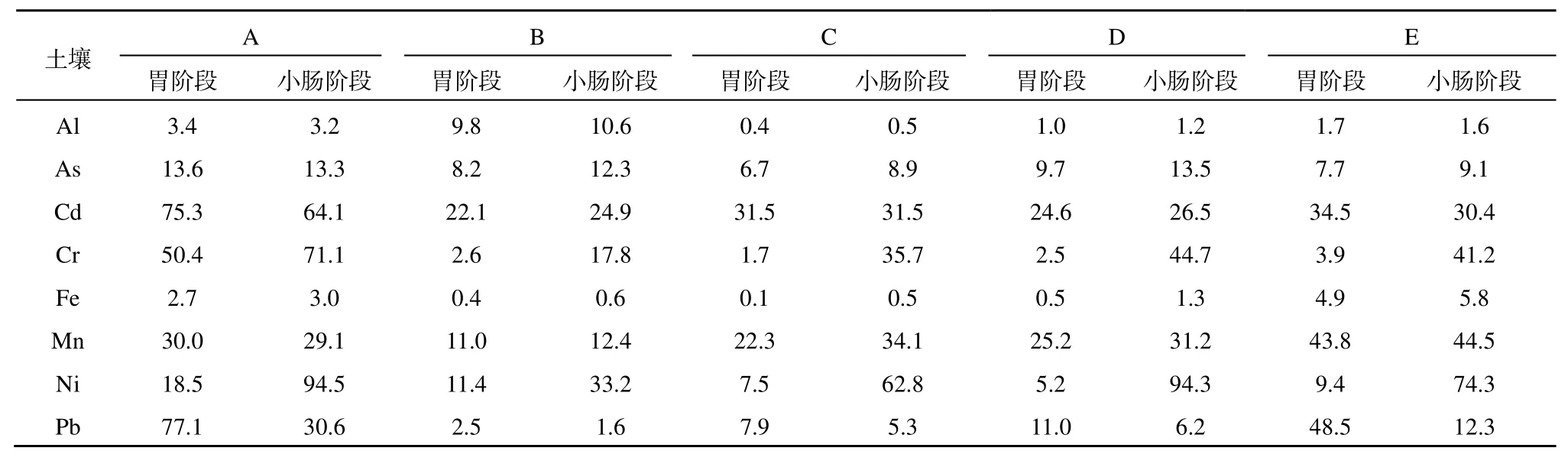
表2 胃肠阶段金属的BA(%)Table 2 Bioaccessibility of metals in gastric and small intestinal phase
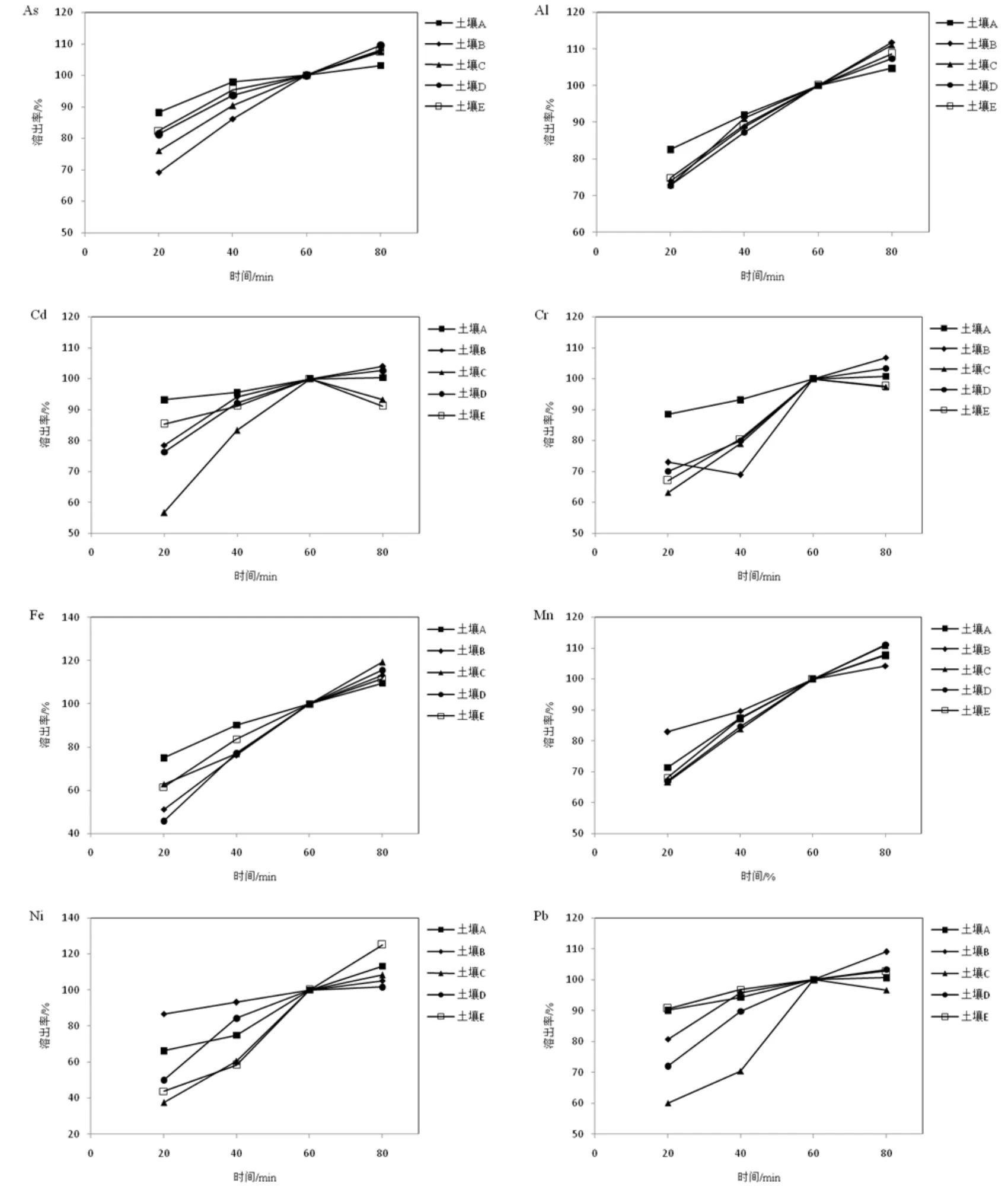
图1 胃阶段金属的溶出动态Fig.1 Dynamic dissolution of metals in gastric phase
2.4 小肠阶段金属的溶出动态
不同土壤中同一金属元素的溶出在小肠阶段有明显的差异。如图2所示,假定小肠阶段4 h时溶出率为100%,5种土壤中Al、As、Cd、Ni、Mn的溶出率变化趋势各自相似。1 h时,土壤C、D中Fe的溶出率较低,分别为 65.9%、70.2%,之后保持上升趋势,而其他三种土壤的溶出率基本保持不变,5 h时,土壤中Fe还在不断溶出,土壤D的溶出率最低,为101.3%,土壤 C的溶出率最大,达到了114.8%。1 h时,土壤A中Cr溶出率最高,达到81.3%,而土壤C中Cr的溶出率最低,为17.4%;在4 h后,溶出率还在不断地增加,土壤C中Cr的溶出率最高,达到119.8%。土壤A和E中Pb的溶出率呈现明显下降的趋势,降幅在20%左右,土壤D中Pb的溶出率基本保持不变,而土壤B和C中Pb在小肠阶段的溶出动态无明显规律。
此外,土壤中不同金属元素的溶出在小肠阶段也有明显的差异。5种土壤中Al、As、Cd、Mn的溶出率基本不变。1 h时,土壤中Cr(土壤A除外)、Ni的平均溶出率最低,分别为 31.5%、32.7%。之后,Fe、Cr、Ni的溶出率一直在上升。5 h时,Fe、Cr、Ni的溶出率还在上升,平均增幅分别达到7.2%、11.3%、16.2%。
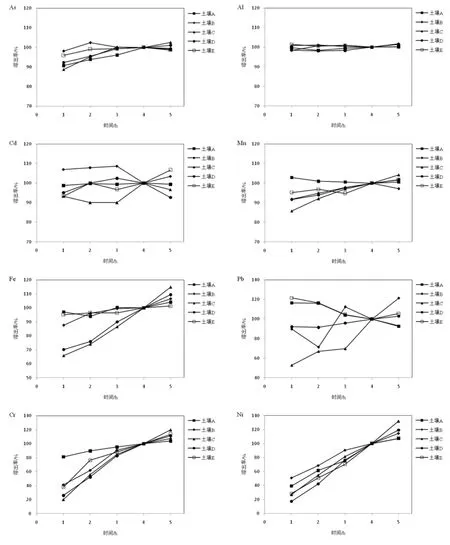
图2 小肠阶段金属的溶出动态Fig.2 Dynamic dissolution of metals in small intestinal phase
3 讨论
3.1 胃肠阶段的BA对比
不同土壤中同一金属的BA在胃肠阶段差异很大。土壤中粘粒、铁氧化物对砷有很强的吸附能力,降低了 As的溶解度(Yang等,2003;Kumpiene等,2008;Wragg等,2011)。本实验中,土壤C、E中粘粒较高,土壤 B中铁氧化物较高,故导致As的BA较低。土壤pH对Pb、Cd、Fe、Al的BA有很大的影响。土壤pH较低时,土壤中有机质对Fe、Al、Pb、Cd的吸附很强(Jansen等,2003;Jalali和Moradi,2013)。本实验中,土壤B的pH最低,这可能导致Fe、Al、Pb、Cd4种金属的BA最低。土壤中土壤 pH越低,土壤对 Cr的吸附能力越强(Stewart,2003;Jardine等,2013),这是导致土壤B、C中 Cr的 BA较低的可能原因。土壤粘粒对Ni有很强的吸附能力(杨定清,1996;谢忠雷等,2006)。本实验中,土壤C、E中粘粒较高的质量分数是导致其中Ni的BA较低的可能原因。
研究者对土壤中金属的BA进行了大量的研究发现,Pb、Cd的BA在胃阶段较高,As、Cr的BA在小肠阶段较高,而对于Ni,有的研究发现胃阶段较高,有的认为小肠阶段较高(Yang等,2003;Wragg等,2011;付瑾和崔岩山,2012)。土壤中不同金属元素的 BA在胃肠阶段的差异主要与in vitropH、粘粒、有机质、铁锰铝氧化物等影响因素有关。从胃阶段到小肠阶段,添加NaHCO3使in vitropH从1.5升高到7.0,导致土壤对Cr的吸附能力降低,并且有机酸可以将残渣态中Cr3+移动到锰氧化物表面而被氧化成Cr6+,增加了Cr的移动性(Guha等,2001;Kim和Dixon,2002);碳酸根增多,其与Cd2+形成难溶性结合态而析出,导致Cd的浓度降低(杜彩艳等,2005;Wragg等,2011);同时,OH-增多,可以替代AsO3-离子,与Fe、Al、Mn结合成氢氧化物沉淀,As的浓度增加并保持了三者浓度的平稳或上升(王金翠等,2011);土壤中有机质逐渐溶出,导致土壤中有机质含量降低,其对Fe、Al、Mn、Cr、Ni、As的吸附能力降低(Tyler和Olsson,2001);土壤中粘粒、铁锰铝氧化物表面负电荷增加,对Cd2+、Pb2+的专性吸附增强,并增加了As的解吸(Yang等,2003;杜彩艳等,2005;王金翠等,2011);此外,实验中通入氩气,保持厌氧环境,可能将As5+还原成As(Ⅲ),增加其溶解度,而且Ni会大量溶出,这可能是与Ni结合的Fe3+等的还原有关(Brown等,1989)。本实验中,与胃阶段相比,小肠阶段土壤中Pb、Cd的BA明显降低,而As、Mn、Cr、Ni均呈现上升趋势,前两者上升了 3%左右,后两者分别上升了 29.9%和55.7%。Al、Fe的BA平均值在胃肠阶段较低,基本保持不变。然而,目前有研究者认为,可以保守的以胃阶段Pb、Cr、Ni的BA以及小肠阶段的BA作为其在整个人体消化系统中的 BA(Rawlins和Wragg,1999;Bradham 等,2014)。
3.2 胃阶段
不同土壤中同一金属元素的溶出的差异可能与土壤理化性质、in vitropH有关。胃阶段,in vitropH较低,有利于土壤中金属的溶出,故20 min时的溶出率均很高。土壤pH越低,土壤对Cr的吸附能力越强。本研究中,土壤A、C中Cr在20 min时的溶出率分别为最高值和最低值,这可能是由于土壤pH导致的。土壤中粘粒对Ni有很强的吸附能力(杨定清,1996),这可能导致了土壤 C、E中Ni在20 min时溶出率较低而土壤B的最高。在酸性土壤下,有机质对 Fe、Al有很强的吸附作用(Jansen等,2003)。本实验中,酸性土壤B中有机质较高,这导致B中Fe、Al在20 min时的溶出率较低(表 3)。土壤 pH、有机质对 Pb、Cd有很大的影响,有机质对两者有很强的吸附能力;而土壤pH越低,水溶态和可交换态的Pb、Cd所占比例越低(杜彩艳等,2005)。本研究中,土壤 C中 Pb、Cd的溶出率最低,而土壤A、E中溶出率都很高。土壤中铁矿物质对 As的吸附能力最强,并且在土壤pH较低时,As(Ⅴ)为主要形式,土壤对其吸附能力很强(Yamaguchi等,2011;王金翠等,2011)。本实验中,土壤B中As在20 min时溶出率最低。
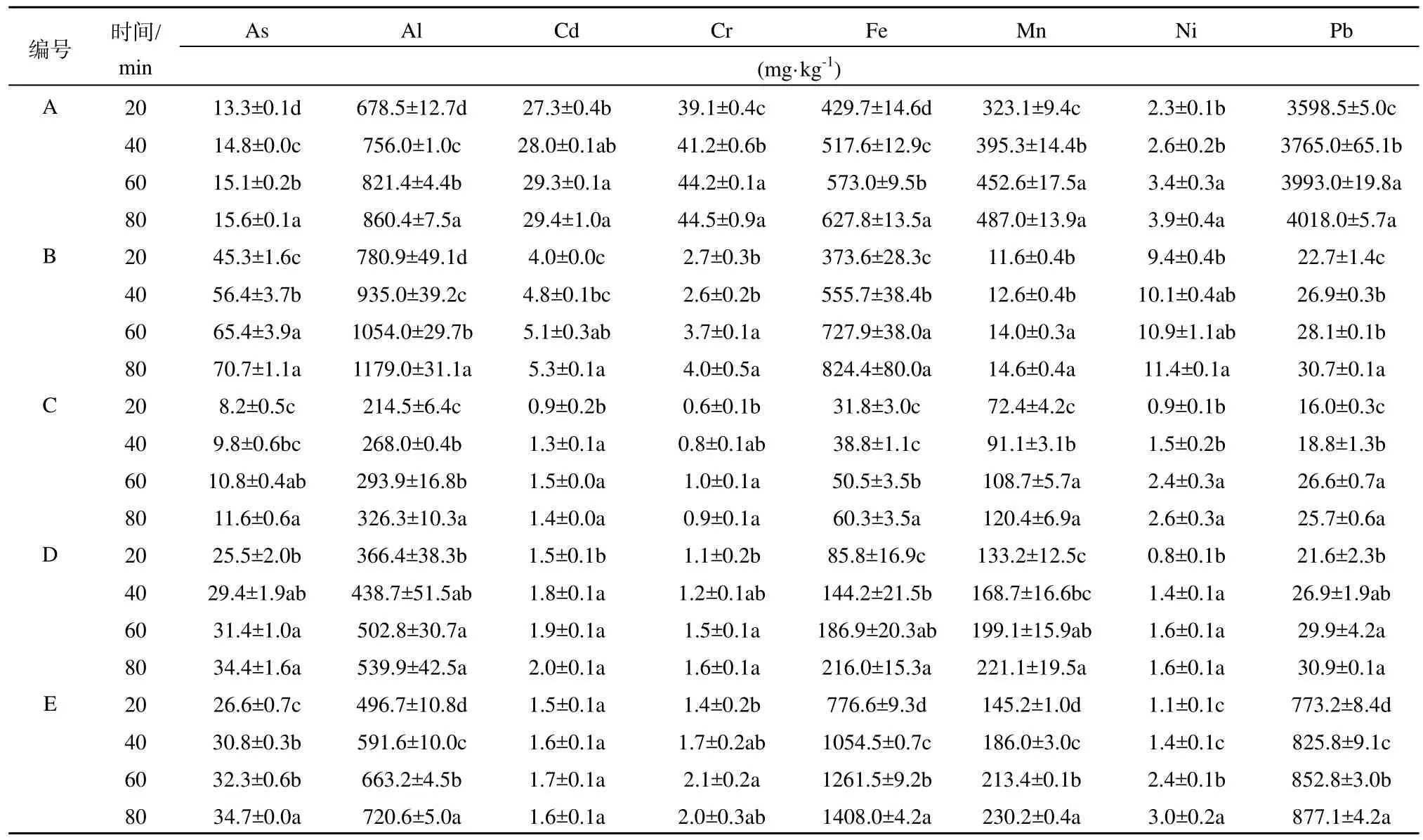
表3 胃阶段金属的溶出量(n=2)Table 3 Dissolution of metals in gastric phase
此外,土壤中不同金属元素的溶出差异可能与其赋存形态、有机质、粘粒、铁锰铝氧化物等有关。土壤中金属以不同的形态赋存,in vitropH较低有利于金属的溶出,最先溶出的为可交换态,之后碳酸盐结合态会溶解,释放出大量的金属离子,而铁-锰氧化物结合态及有机物结合态可能会有一定溶出,残渣态基本不溶出,同时,各形态之间可能会相互转化,进而影响金属的溶出率(Yang等,2003;Bissen和Frimmel,2003;Scancar和Milacic,2006)。土壤中Fe主要以残渣态存在,占全铁的90%以上,这将导致Fe在20 min时溶出率较低。在胃阶段,碳酸盐结合态的溶解,可能使溶液中Cd、Pb迅速大量积累(杜彩艳等,2005)。本实验中,土壤中Cd、Pb的溶出速率先快后慢,之后溶出率趋于平稳。土壤中有机质、粘粒、铁锰铝氧化物对 Cr、Ni有很强的吸附能力,低pH时,三者表面主要带正电荷,导致了 Ni、Cr的解吸(Stewart,2003;Wragg等,2011;Cox等,2013;Jardine等,2013)。本实验中,Ni、Cr的溶出速率先慢后快,溶出率不断增加。对于As,土壤中主要以As(Ⅴ)的无机形式存在,低pH时,土壤中可交换态As大量溶出,主要以砷酸根形式存在,同时,土壤中有机质、粘粒、铁锰氧化物表面带正电荷,会对负离子有很强的吸附能力(Yang等,2003;Kumpiene等,2008;Wragg等,2011;Jardine等,2013),这可能导致了40 min后,As的溶出速率减缓,趋于平稳。此外,土壤中Fe、Mn、Al溶出后主要以正离子形式存在,并且铁锰铝化合物形态会不断地溶出。本实验中,Fe、Mn、Al的溶出率一直在增加。1 h后,随着有机物和铁锰铝氧化物的不断溶出,降低了土壤对某些金属的吸附能力,这可能是导致As、Al、Cd、Fe、Mn、Ni1 h后还在不断溶出的原因。
3.3 小肠阶段
土壤中粘粒、铁铝氧化物、有机质等对 Cr有很强的吸附能力(Stewart,2003;Kumpiene等,2008;Cox等,2013;Jardine等,2013)。本实验中,土壤C中粘粒含量最高,这可能导致了土壤C中Cr在1 h的溶出率最低(表4),同时土壤B、D、E中Cr的溶出率均很低。而土壤A中3种吸附物质的含量均很低,这可能是Cr在1 h时溶出率较高的原因。在小肠阶段,溶液中 CO32-含量增加,会与 Pb2+等离子结合为难溶性的碳酸盐结合态析出,降低了模拟液中Pb的含量(Wragg等,2011)。本实验中,土壤A和E中Pb的溶出率呈现明显下降的趋势,降幅在 20%左右。但是土壤 B、C中 Pb的变化无明显规律,这可能是多种影响因素共同作用导致的。而5种土壤中Al、As、Cd、Ni、Mn的溶出率变化趋势各自相似,这可能是影响因素共同作用的结果。
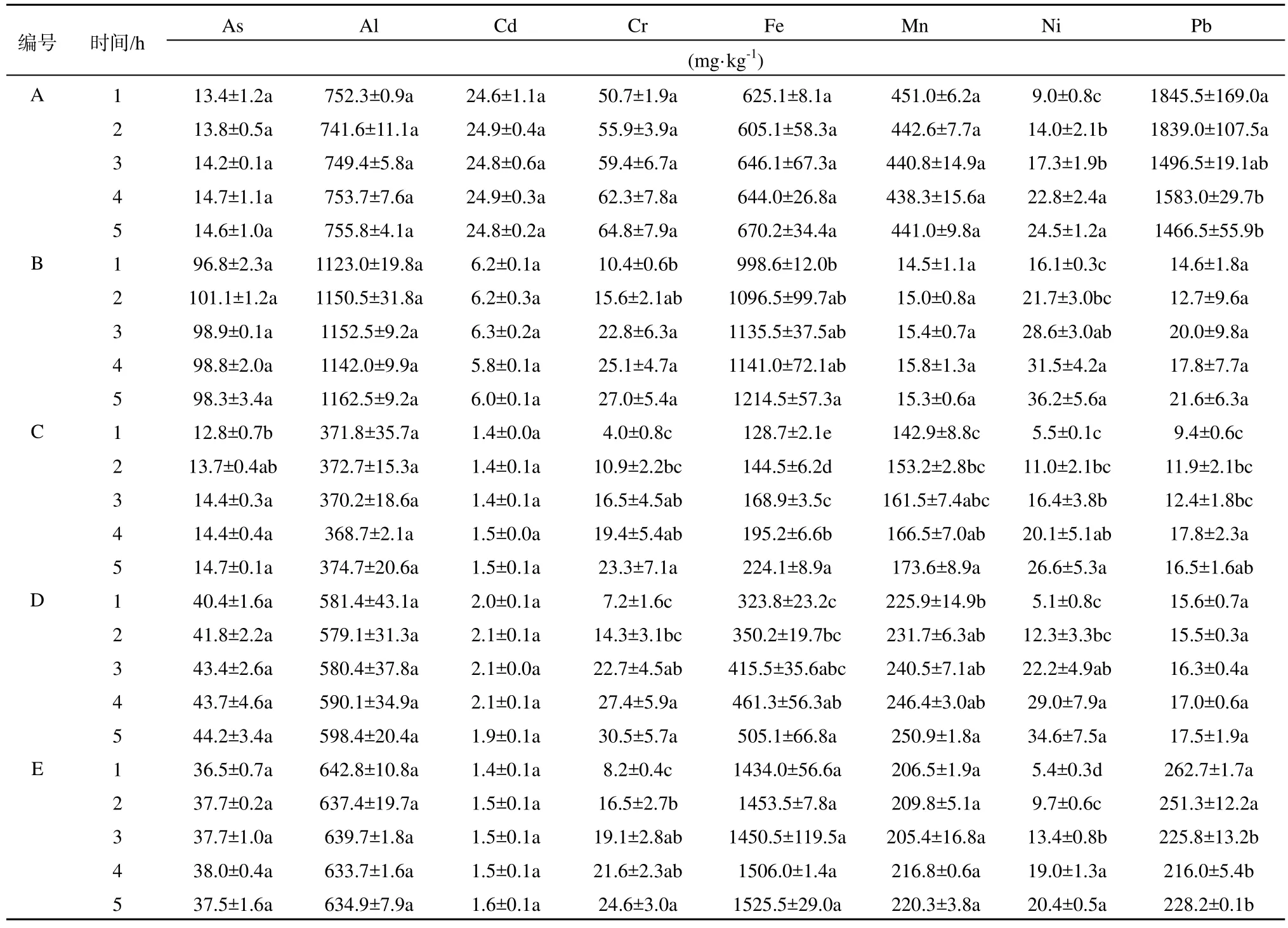
表4 小肠阶段金属的溶出量(n=2)Table 4 Dissolution of metals in small intestinal phase
此外,土壤中不同金属元素的溶出差异可能是多种影响因素共同作用导致的。in vitropH是影响某些金属元素溶出的主要因素。当土壤溶液pH从3逐渐增加到11,Al主要以无机形态转变(Al3+,Al(OH)2+,Al(OH)2+,Al(OH4)−)(Scancar和Milacic,2006)。本研究中,Al在小肠阶段溶出率基本保持不变,这可能与 Al不同形态之间转变有关而保持Al溶出量基本不变。pH升高,土壤对As的吸附能力降低,土壤负电荷增加,亚砷酸盐、砷酸盐被解吸,并迅速达到平衡(王金翠等,2011)。本实验中,As在1 h时略有上升,之后溶出率趋于平稳。而对于 Cd、CO32-的大量增加,促进了碳酸盐结合态的迅速形成而沉淀析出(杜彩艳等,2005;Wragg等,2011),这可能是导致Cd在小肠阶段的溶出率基本保持不变的原因。pH的升高,随着铁铝氧化物和有机质含量的降低,土壤对 Cr的吸附能力降低,并且有机酸可以将残渣态中Cr3+移动到锰氧化物表面而氧化成Cr6+,增加了Cr的移动性(Guha等,2001;Kim和Dixon,2002)。本实验中,1 h时,土壤中Cr(土壤A除外)的平均溶出率最低,为31.5%;之后,溶出率一直在上升。在小肠阶段,OH-含量增加,Fe与OH-结合成氢氧化物的离子形式,增加了溶液中Fe含量。本实验中,Fe的溶出率一直在增加,5 h的溶出率平均增幅达到7.2%。此外,有报道指出,pH升高,土壤对Ni的吸附能力增强,Ni的溶解度会降低,而本实验中通入氩气,保持厌氧环境,这可能营造了还原条件,导致了Fe3+等的还原,而使 Ni大量溶出(Brown等,1989;杨定清,1996)。本实验中,Ni在小肠阶段的溶出率不断增加,5 h的平均增幅最高,达到了16.2%。
4 结论
(1)土壤中不同金属在胃肠阶段的BA有明显差异。Fe、Al的BA较低,在胃肠阶段差异不大。与胃阶段相比,Cd、Pb的BA在小肠阶段呈下降趋势;As、Mn、Cr、Ni的BA在小肠阶段均呈现上升趋势,前两者上升了 3%左右,后两者分别上升了29.9%和61.4%。
(2)土壤中不同金属在胃肠阶段的溶出动态是有明显差异的。胃阶段,假定1 h时溶出率为100%。20 min时,土壤中Fe、Ni的平均溶出率较低,分别为59.3%、56.8%,其他6种金属元素的平均溶出率在 71.2%~79.5%。As、Cd、Pb的溶出速率是先快后慢,Cr和Ni的溶出速率是先慢后快,而Fe、Mn、Al的溶出速率基本保持不变。1 h后,Pb和Cr的溶出率基本保持不变,而As、Al、Cd、Fe、Mn、Ni仍在不断溶出。小肠阶段,假定4 h时溶出率为100%。Al、As、Cd、Mn的溶出率基本不变。1 h时,土壤中Cr(土壤A除外)、Ni的平均溶出率最低,分别为31.5%、32.7%,而5 h时,Fe、Cr、Ni的溶出率仍在上升。
ABRAHAMS P W. 2002. Soils: their implications to human health[J].Science of the Total Environment, 291(1-3): 1-32 .
ATSDR. 2011. Detailed Data Table for the 2011 Priority list of Hazardous Substances that will be the Subject of Toxicological Profiles. Available at htpp://www.atsdr.cdc.gov/spl/resources/ATSDR_2011_SPLDetailed_Date_Table.pdf.
BISSEN M, FRIMMEL F H. 2003. Arsenic-a Review. Part I:Occurrence,Toxicity,Speciation,Mobility[J]. Acta hydrochim, 31(1):9-18.
BRADHAM K D, LAIRDB D, RASUSSEN P E, et al. 2014. Assessing the bioavailability and risk from metal-contaminated soils and dusts[J].Human and Ecological Risk Assessment, 20: 272-286.
BROWN P H, DUNEMANN L, SCHULZ R, et al. 1989. Influence of redox potential and plant species on the uptake of nickel and cadium from soils[J]. Zeitschrift fur pflanzenernahrung und bodenkunde, 152(1):85-91.
COX F S, CHELLIAH M C, MCKINLEY J M, et al. 2013. The importance of solid-phase distribution on the oral bioaccessibility of Ni and Cr in soils overlying Palaeogene basalt lavas[J]. Northern Ireland.Environmental geochemistry and health, 35: 553-567.
GUHA H, SAIERS J E, BROOKS S, et al. 2001. Chromium transport,oxidation, and adsorption in manganese-coated sand[J]. Journal of Contaminant Hydrology, 49 (3-4): 311-334.
JALALI M, MORADI F. 2013. Competitive sorption of Cd, Cu, Mn, Ni, Pb and Zn in polluted and unpolluted calcareous soils[J]. Environmental Monitoring and Assessment, 185: 8831-8846.
JANSEN B, NIEROP K G, VERSTRATEN J M. 2003. Mobility of Fe(II),Fe(III) and Al in acidic forest soils mediated by dissolved organic matter influence of solution pH and metal organic carbon ratios[J].Geoderma, 113: 323-340.
JARDINE P M, STEWART M A, BARNETT M O, et al. 2013. Influence of Soil Geochemical and Physical Properties on Chromium(VI)Sorption and Bioaccessibility[J]. Environmental Science Technology,47(19): 11241-11248.
JOHN R D, MA R L. 2007. Approaches to assess the oral bioaccessibility of persistent organic pollutants: A critical review[J]. Chemosphere, 68(8):1399-1407.
KIM J G, DIXON J B. 2002. Oxidation and fate of chromium in soils[J].Soil Science and Plant Nutrition, 48 (4): 483-490.
KUMPIENE J, LAGERKVIST A, MAURICE C. 2008. Stabilization of As,Cr, Cu, Pb and Zn in soil using amendments-A review[J]. Waste Management, 28: 215-225.
RODRIGUEZ R R, BASTA N T, CASTEEL S W, et al. 1999. An in vitro gastrointestinal method to estimate bioavailable arsenic in contaminated soils and solid media[J]. Environmental Science Technology, 33(4) : 642-649.
RUBY M V, DAVIS A, SCHOOF R, et al. 1996. Estimation of lead and arsenic bioavailability using a physiologically based extraction test[J].Environmental Science Technology, 30(2) : 422-430.
SCANCAR J, MILACIC R. 2006. Aluminium speciation in environmental samples: a review[J]. Analytical and bioanalytical chemistry, 386:999-1012.
STEWART M A, BARNETT M O, MEHLHORN T L, et al. 2003.Influence of soil geochemical and physical properties on the sorption and bioaccessibility of chromium(Ⅲ)[J]. Journal of Environmental International Quality, 32(1): 129-137.
TYLER G, OLSSON T. 2001. Concentrations of 60 elements in the soil solution as related to the soil acidity[J]. European Journal of Soil Science, 52: 151-165.
WRAGG J, CAVE M, BASTA N, et al. 2011. An inter-laboratory trial of the unified BARGE bioaccessibility method for arsenic, cadmium and lead in soil [J]. Science of the Total Environment, 409: 4016-4030.
YAMAGUCHI N, NAKAMURA T, DONG D, et al. 2011. Arsenic release from flooded paddy soils is influenced by speciation, Eh, pH, and iron dissolution[J]. Chemosphere, 83: 925-932.
YANG J K, BARNETT M O, JARDINE P M, et al. 2003. Factors controlling the bioaccessibility of arsenic(V) and lead(II) in soil[J].Soil and Sediment Contamination, 12(2): 165-179.
鲍士旦. 2000. 土壤农化分析[M]. (第三版). 北京: 中国农业出版社:30-33.
崔岩山, 陈晓晨, 付瑾. 2010. 污染土壤中铅、砷的生物可给性研究进展[J]. 生态环境学报, 19(2): 480-486.
杜彩艳, 祖艳群, 李元. 2005. pH和有机质对土壤中镉和锌生物有效性影响研究[J]. 云南农业大学学报, 20(4): 539-543.
付瑾, 崔岩山. 2012.In vitro系统评价胃肠液pH及土液比对铅、镉、砷生物可给性的影响[J]. 农业环境科学学报, 31(2): 245-251.
黄昌勇. 2000. 土壤学[M]. 北京: 中国农业出版: 175-176.
鲁如坤. 2000. 土壤农业化学分析方法[M]. 北京: 中国农业科技出版社.
王金翠, 孙继朝, 黄冠星, 等. 2011. 土壤中砷的形态及生物有效性研究[J]. 地球与环境, 39(1): 32-36.
谢忠雷, 杨佰玲, 包国章, 等. 2006. 茶园土壤不同形态镍的含量及其影响因素[J]. 吉林大学学报(地球科学版), 36(4): 599-604.
许祖贻, 陈家坊. 1980. 土壤中无定形铁的测定[J]. 土壤通报, 6: 32-35.
杨定清. 1996. 土壤-植物系统中镍研究进展述评[J]. 西南农业学报, 9(4):109-116.
朱大年, 吴博威, 樊小力. 2008. 生理学[M]. 北京: 人民卫生出版社:180-200.
