固定底物酶底物法与多管发酵法和快速纸片法测定水中粪大肠菌群 (耐热大肠菌群)的比较
2014-07-16朱培瑜
朱培瑜,魏 轲
(无锡市环境监测中心站,江苏无锡 214121)
目前水中粪大肠杆菌群 (耐热大肠菌群)检测方法主要有传统的滤膜法及多管发酵法,并且已经列入环保行业标准方法 (HJPT 347-2007),此两种传统方法被国内环境检测部门广泛采用,但上述方法操作时间需2~5天,步骤较为繁琐,需验证试验,不能对水的卫生学状况做出快速评价,制约了其应用[1]。快速纸片法是《水和废水监测分析方法》(第四版)中的C类推荐方法,操作步骤比较简单,无需验证试验,但此方法同样不能对水的卫生学状况做出快速评价,并且此方法更适用于生活污水或相关工业废水的监测。酶底物法操作简单,耗时短,并可检测有病原学意义的大肠埃希氏菌 (E.coli.),已经在美、日、韩和欧洲许多国家使用。我国《生活饮用水卫生标准》与世界接轨,已经增加大肠埃希氏菌的检测,作为评价饮用水水质的指标。因此,有必要开展酶底物法检测环境水样的大肠埃希氏菌,并检测粪大肠菌群,通过其与多管发酵法及快速纸片法的结果比对,建立新的评价指标,找出替代多管发酵法的简单、快速方法[2]。
酶底物法 (enzyme substrate technique)采用大肠菌群细菌能产生β-半乳糖苷酶 (β-D-galactosidase)分解ONPG(Ortho-nitrophenyl-β-D-galactopyranoside)使培养液呈黄色,以及大肠埃希氏菌产生β-葡萄糖醛酸酶 (β-glucuronidase)分解MUG(4-methyl-umbelliferyl-β-D-glucuronide)使培养液在波长366nm紫外光下产生荧光的原理,来判断水样中是否含有大肠菌群、粪大肠菌群 (耐热大肠菌群)及大肠埃希氏菌 。酶底物法可以采用成品的培养基及试剂,操作方便,无需确认试验,酶底物法检测时间较短,18~24h即可同时判断水样中大肠菌群和大肠埃希氏菌的MPN值。在美国,欧洲及大部分亚洲国家广泛应用于水中总大肠杆菌,粪大肠菌群 (耐热大肠菌群)及大肠埃希氏的检测,并通过美国EPA,《水与废水标准检测方法》以及我国《生活饮用水标准检验方法》认证[4]。
1 材料与方法
1.1 材料与试剂
本试验中酶底物法采用指定受检物检验技术(DST,defined substrate technology),其 MMOMUG培养基、试验材料和仪器由爱德士公司提供,标准菌株采用ATCC 25922(大肠埃希菌)。其它所用培养基与试剂按《生活饮用水卫生规范》(2001版)和《水和废水监测分析方法》 (第四版)准备和配置。
1.2 试验方法
1.2.1 多管发酵法和快速纸片法检测水中粪大肠菌群方法参见《生活饮用水卫生规范》和《水和废水监测分析方法》(第四版)。
1.2.2 酶底物法检测水中粪大肠菌群采用97孔定量盘法,此方法是一种基于MPN的方法。检测所需水样为100mL。用100mL的无菌取样瓶量取100mL水样,加入科立得TM(ColilertR)试剂,混摇均匀使之完全溶解,将水样全部倒入97孔无菌定量盘内,以手抚平定量盘背面以赶除孔穴内气泡,然后用封口机封口 。放入44.5℃ ±0.5℃培养箱中培养24 h后进行结果判读,如果结果为可疑阴性,可延长培养时间到28h,超过28h之后出现的颜色反应不作为阳性结果[5]。将培养24 h之后的定量盘取出观察,如果孔穴内的水样变成黄色则表示该孔穴中含有粪大肠菌群 (耐热大肠菌群)。计算有黄色反应的孔穴数,对照MPN表查出其代表的粪大肠菌群 (耐热大肠菌群)最可能数。
1.2.3 采用无菌水和标准菌种ATCC 25922(大肠埃希菌)标准菌种检验3种方法的假阳性率与假阴性率:标准菌种ATCC 25922经复苏、培养后,采用无菌水稀释,经显微镜初步计数后,采用3种方法分别接种培养后,检验MPN结果与显微镜技术结果有无差异。
1.2.4 数据整理统计方法使用Excel和SPSS17.0软件。
2 结果
2.1 精密度检验
采用标准菌种ATCC 25922(大肠埃希菌)稀释培养液,首先对酶底物法、多管发酵法和快速纸片法进行平行双样的精密度检验,结果3种方法平行双样的对数差值均小于该批数据的精密度判断值3.27R。同时,采用标准菌种ATCC 25922(大肠埃希菌)稀释培养液,进行3种方法的定性确认试验,结果3种方法未出现假阳性或假阴性,即假阳性率与假阴性率为0。
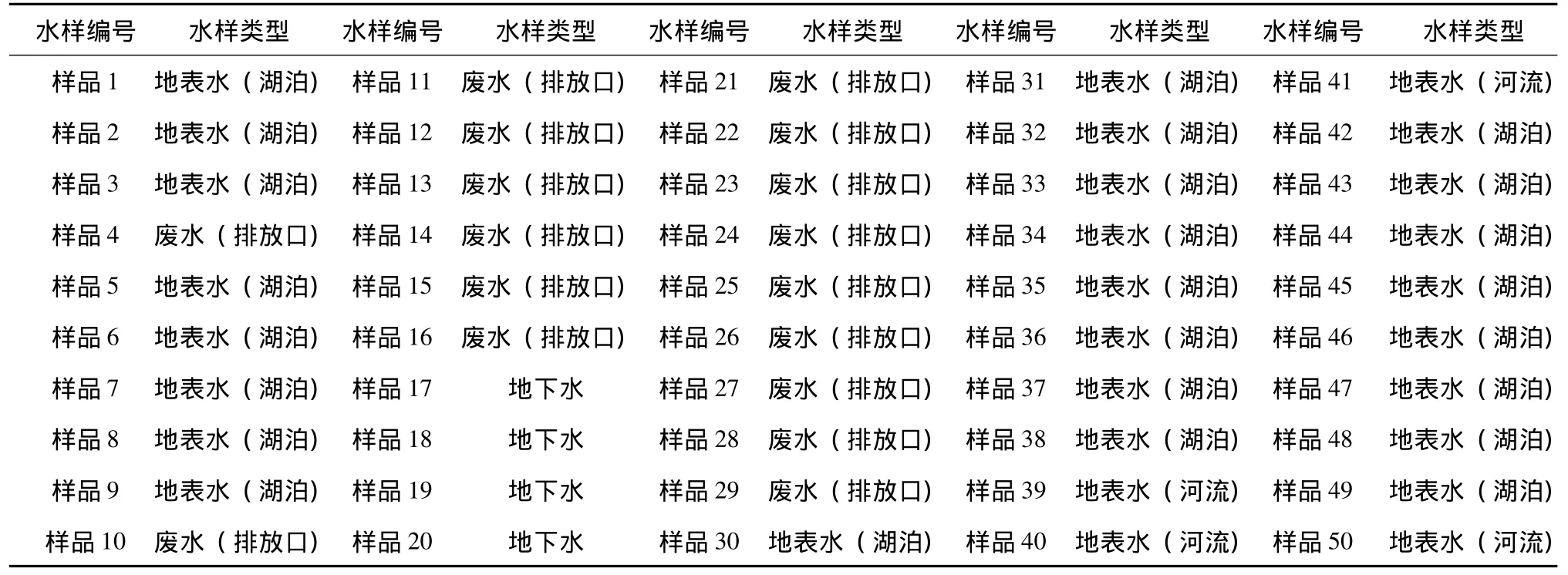
表1 试验水样编号与水样性质Tab.1 Characters of different water samples in various testing water sample numbers
2.2 比对结果
为了检验酶底物法在实际工作中的适用性,采集了污水、地表水、地下水等实际水样进行3种方法的比对试验。比对试验的水样编号与水样性质见表1。
大肠菌群数据结果是由MPN值乘以稀释倍数来计算,因此大肠菌群数据往往是比较大的数值,为了便于查看比对结果,将本次进行比对试验的50组数据结果取lg值来表示。3种方法监测大肠菌群结果lgMPN值见图1。
分别对3种方法所测得的大肠菌群的MPN结果进行配对t检验,为了方便计算,所有的结果值以lg来计算。结果如表2~表4所示。
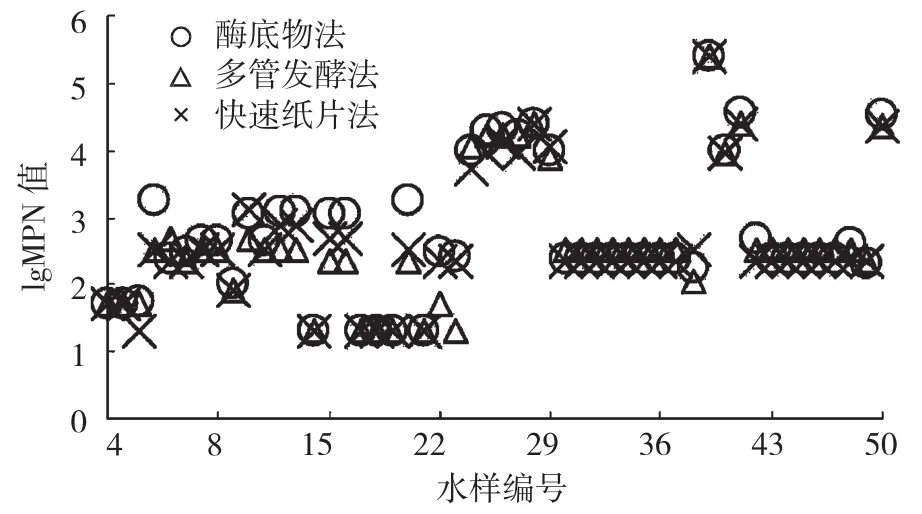
图1 3种方法监测大肠菌群结果比较Fig.1 Comparison of monitor results on coliforms with three methods

表2 酶底物法、多管发酵法和快速纸片法配对变量统计Tab.2 Variable statistics on pairing Enzyme substrate method,multi-tube fermentation method and rapid paper strip method

表3 酶底物法、多管发酵法和快速纸片法配对变量相关性统计Tab.3 Statistics on pairing vaiable relevance of Enzyme substrate method,multi-tube fermentation method and rapid paper strip method

表4 酶底物法、多管发酵法和快速纸片法配对t检验结果Tab.4 Pairing t test results of Enzyme substrate method,multi-tube fermentation method and rapid paper strip method
2.2.1 多管发酵法-快速纸片法配对t检验结果
相关性系数r=0.963,可看出两组数据的相关性很好,P=0,说明两组数据的相关性趋于一致。配对t检验,回归分析结果表明,回归系数t检验t=1.884,P=0.066,P值大于0.05,即差异没有显著意义。可认为多管发酵法与快速纸片法没有区别,效果是相同的。
2.2.2 酶底物法-快速纸片法配对t检验结果
相关性系数r=0.954,可看出两组数据的相关性很好,P=0,说明两组数据的相关性趋于一致。配对t检验,回归分析结果表明,回归系数t检验t=1.575,P=0.122,P值大于0.05,即差异没有显著意义。可认为酶底物法与多管发酵法没有区别,效果是相同的。
2.2.3 酶底物法-多管发酵法配对t检验结果
相关性系数r=0.990,可看出两组数据的相关性很好,P=0,说明两组数据的相关性趋于一致。配对t检验,回归分析结果表明,回归系数t检验t=0.249,P=0.804,P值大于0.05,即差异没有显著意义。可认为酶底物法与多管发酵法没有区别,效果是相同的。
3 讨论
3.1 酶底物法、多管发酵法和快速纸片法的检测结果中快速纸片法MPN值略低,尤其是图1中水样25、水样27、水样41和水样50,这是由于酶底物法和多管发酵法的培养基都是可溶性的,与接种水样可充分混匀;而快速纸片法采用的是纸培养基,与接种水样接触只是浸润,难以达到混匀的效果,这也佐证了快速纸片法更适合生活污水和相关的工业废水等大肠菌群数量较多的水样。
3.2 由于多管发酵法每100mL水样中最低检出限为2个粪大肠菌群,而酶底物法却能抑制200万个异样细菌,精确检测到1个粪大肠菌群,显然酶底物法更适合粪大肠菌群含量较低的水样。
3.3 酶底物法、多管发酵法和快速纸片法主要优缺点比较,见表5。

表5 酶底物法、多管发酵法和快速纸片法主要优缺点比较Tab.5 Comparison of the main advantages and disadvantages of the Enzyme substrate method,multi-tube fermentation method and the rapid paper strip method
[1]高瑞坤,汤 琳,傅 强.水中粪大肠菌群快速检测方法-固定底物酶底物法与多管发酵法的比较[J].中国环境监测,2008,24(4):39-41.
[2]赵春霞,张哲海,厉以强,等.酶底物法与多管发酵法和纸片法监测环境水样大肠菌群的比较[J].环境监测管理与技术,2009,21(2):63-64.
[3]孙宗科,吴 榕,丁 培,等.水中在肠菌群快速检测方法—酶底物法与多管发酵法的比较[J].卫生研究,2006,35(4):1-2.
[4]GBPT 5750.2007:13-2006.生活饮用水标准检验方法[S].
[5]Eaton,Andrew D(EDT),etc.Standard Methods for Examination of Water& Wastewater[M].USA:Amer Public Health Assn,2012.
