冠状动脉光学相干断层成像与血管内超声成像临床应用进展
2014-07-16武德崴综述俞梦越吴永健审校
武德崴 综述 俞梦越 吴永健 审校
( 中国医学科学院 北京协和医学院 国家心血管病中心 阜外心血管病医院 冠心病诊治中心,北京100037)
冠状动脉粥样硬化已成为影响人类健康的重要疾病,对冠状动脉病变程度进行全方位的评价显得越发重要。在冠状动脉复杂病变中,冠状动脉CT、冠状动脉造影等检查已不能满足临床需要,血管内成像技术可作为良好的补充,指导介入治疗。近20年来,血管内成像技术取得了长足的发展和进步,在评价动脉粥样硬化程度、判断斑块性质、分析血管壁的组成成分等新的领域中,发挥了越来越重要的作用。各种新的血管内成像技术不断发展,这些技术为体内实时观察斑块负荷、斑块性质及支架情况提供了重要的临床信息。现今最主要的两项技术包括以声波为观测手段的血管内超声成像技术(IVUS)和以光波为观测手段的光学相干断层成像技术(OCT)。IVUS 和OCT 有着不同的技术特点和优势,现就近些年来对这两种技术进行对比的临床研究进行简要回顾,并对比这两项检查的技术优势及其对临床预后的影响。
1 背景
OCT 是一种利用近红外线及光学干涉原理对生物组织进行成像的技术,具有较高的空间分辨率,但穿透力和成像范围较小,且易受血液中红细胞的影响,成像时需排除红细胞干扰。传统的时域OCT(TDOCT)技术成像时需要用球囊阻塞病变血管近端,操作复杂,引起缺血并发症的概率较大,在一定程度上限制了OCT 的临床应用。新一代频域OCT(FD-OCT)技术具有较快的成像速度,成像时无需阻断病变血管,有效的减少了缺血并发症的发生率。同时,FD-OCT进一步提高了空间分辨率。这些进展使OCT 技术得以在临床中广泛使用[1]。
IVUS 利用超声的组织穿透性显像原理,在介入诊断和治疗中提供冠状动脉解剖结构的直观图像。IVUS 的穿透力和扫描范围较大,可以显示冠状动脉全层的结构。在临床上可用于冠状动脉造影不能明确的斑块性质的测定、管腔的定量测量等。但是,IVUS空间分辨率较低,图像清晰度较差[2]。OCT 和IVUS的技术对比可见表1。
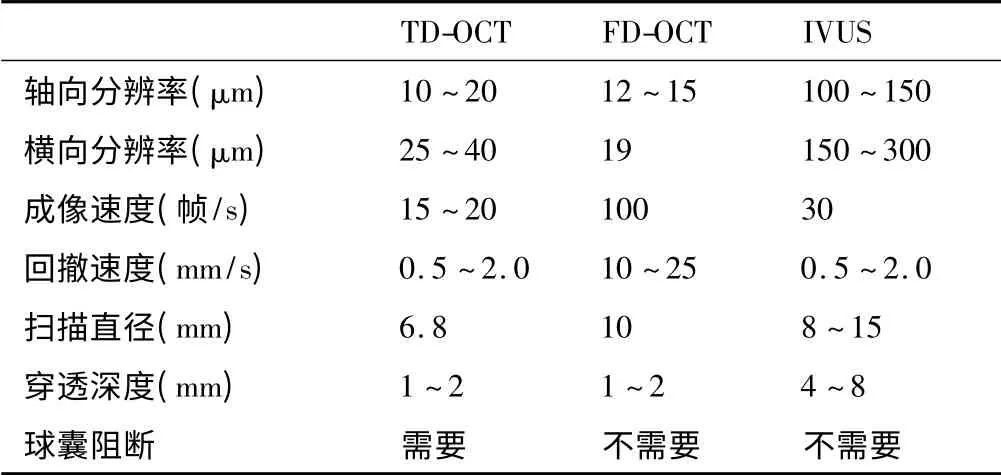
表1 TD-OCT、FD-OCT 和IVUS 的技术对比
2 OCT 与IVUS 临床应用对比
2.1 未放置支架的血管
2.1.1 判断斑块成分
OCT 与IVUS 均可用于对斑块成分的评价。OCT图像中,纤维成分呈高信号,脂质成分呈边界模糊的低信号,钙化成分呈边界清晰的低信号,由此可对斑块成分进行判断[2]。但由于OCT 穿透力有限,所以对于较大的斑块,OCT 难以评估斑块深部的性质。IVUS检查中,斑块回声强度表现为脂质斑块≤纤维斑块≤钙化斑块。然而,在IVUS 图像上不同组织的回声特征有时候是相近的,很难区分,所以对斑块成分的准确解读有赖于检查者对回声信号的经验分析。Guo等[3]从15 例心脏解剖标本中提取了71 处斑块病变分别进行OCT 和IVUS 检查,并与组织学检查进行对比,评价两种检查方式对于不同斑块性质的分辨能力,结果显示OCT 与IVUS 识别脂质斑块、钙化斑块和纤维斑块的敏感性和特异性未见明显统计学差异。
对于钙化病变,OCT 可以清晰地描记病变的轮廓,增加对斑块大小估计的精确度。Kume 等[4]从33例心脏标本中提取91 处钙化病变的血管,分别用OCT和IVUS 对钙化病变大小进行了评估,结果显示IVUS和OCT 都会低估钙化面积,IVUS 的低估程度较OCT更加严重,提示对于钙化病变的评估,OCT 更具优势。然而,OCT 与IVUS 对于纤维、脂质斑块成分判断的准确性尚需进一步的研究。
2.1.2 鉴别易损斑块
易损斑块在急性冠状动脉综合征的发病和进展中起重要作用,其组织学特征包括薄帽纤维粥样硬化斑块(即有较大的脂质核心、薄纤维帽和富含巨噬细胞的斑块)、富含糖蛋白基质或炎症导致内皮受侵蚀的斑块以及血栓形成、钙化结节斑块[5]。IVUS 具有良好的血管穿透性,能够检测脂质池容积,敏感性达到80% ~90%,但是由于其空间分辨率仅100 μm,难以区分纤维帽厚度<70 μm 的易损斑块。OCT 空间分辨率较高,适于检测易损斑块纤维帽的厚度和纤维帽中巨噬细胞的含量。Kume 等[6]对38 个心脏标本中提取的108 个血管病变分别进行OCT、IVUS 和组织学检查,对于组织学检查定义的易损斑块,OCT 诊断的敏感性和特异性分别为90%和79%。而IVUS 对于易损斑块和非易损斑块没有明显的识别作用。Takahashi 等[7]对70 例患者的108 个病变分别用FD-OCT与IVUS 评价薄帽纤维粥样硬化斑块,发现IVUS 对于薄帽纤维粥样硬化斑块的诊断阳性预测值较低,阴性预测值较高,可作为较好的排除标准。Kubo 等[8]也在其研究中得到了相似的结论。故OCT 对易损斑块诊断价值较大,IVUS 对其有辅助作用。
2.1.3 评价管腔狭窄程度
当前对于冠状动脉狭窄程度的评价多基于冠状动脉造影检查结果,对于单一、狭窄程度严重(>70%)的病变,冠状动脉造影评价对于治疗决策的选择有很大的指导意义。然而,对于多支、中度狭窄的病变,则需要其它辅助检查手段决定是否对其干预。OCT 和IVUS 均可用于精确测定冠状动脉管腔面积及狭窄程度。有研究提示IVUS 测得最小管腔面积<3 mm2是血管功能性狭窄的良好监测指标[9]。
多项研究对OCT 和IVUS 对管腔面积的测定能力进行了对比。Bezerra 等[10]对56 例病变血管分别进行IVUS 和OCT 检查,并对相同横截面进行比对,结果显示OCT 测得最小管腔面积小于IVUS 测量结果。Ramesh 等[11]通过对19 例病变进行同样的比较,结果也证实OCT 对病变狭窄程度的估计更严重。这种差异出现的原因可能包括:OCT 高估了病变程度;IVUS低估了病变程度。对此,Gonzalo 等[12]以血流储备分数作为标准,评价OCT 和IVUS 对于血管狭窄严重程度的估计能力,结果显示,OCT 和IVUS 对于病变狭窄程度均有低估,在管腔直径>3 mm 的血管中,IVUS 与OCT 的测定能力无明显差异;在直径<3 mm 的小血管中,IVUS 对病变程度的低估比OCT 更加严重。另有研究用组织学检查评价OCT、IVUS 对管腔狭窄的测定能力,同样证实两种检查均低估了病变严重程度,且IVUS 的低估更加严重[13]。
然而,也有研究[14-15]指出,OCT 与IVUS 所测得最小管腔面积无统计学差异。由于现有研究样本量均较小,所以IVUS 与OCT 对管腔面积的测定能力的评价尚待进一步大样本量研究证实。
2.2 经皮冠状动脉介入治疗后血管评价
2.2.1 指导经皮冠状动脉介入治疗术后球囊扩张
支架置入时的贴壁情况与支架内血栓形成有密切的关系。血管内成像技术可以评价支架置入术后即刻支架贴壁情况,对贴壁不良的支架可予高压球囊扩张,改善贴壁情况。Habara 等[16]选取70 例经皮冠状动脉介入治疗(PCI)患者,随机分为两组,在PCI 术前和术后分别进行IVUS 与OCT 检查,依据两项检查得出的支架内面积和支架贴壁情况决定是否进行球囊后扩张。术后再次使用这两种技术对支架面积和贴壁情况进行评估,比较两组支架扩张程度及支架内面积。结果显示,OCT 指导组支架内面积及支架扩张程度显著小于IVUS 指导组,OCT 对PCI 的指导意义差于IVUS。作者分析,出现这一现象主要由于OCT扫描范围较小,在直径较大的血管中无法观察到完整的血管壁边缘。对于无法观测到完整边界的血管,为了防止球囊压力过高造成血管损伤,血管内径及球囊压力均按最小管腔面积估计,故造成某些血管内支架扩张不完全。IVUS 成像范围较大,可以观察到完整的血管腔边界,对于球囊扩张的压力选择较OCT 更为精确,故支架获得了更高的扩张程度。所以,IVUS 对于PCI 的指导更有优势。
2.2.2 PCI 术后即刻并发症评价
由于分辨率较高,OCT 对于PCI 术后血管夹层、支架内组织脱垂及支架贴壁不良有更高的灵敏度。多项研究[10,17-18]已有证实,OCT 与IVUS 相比,可以发现更多的PCI 术后即刻并发症。然而,长期随访显示,仅能在OCT 检查中发现的夹层、脱垂、支架贴壁不良等病变,均可自行愈合,未造成支架内狭窄或血栓形成[17]。因此,OCT 的高灵敏度是否有临床意义尚待进一步探究。
2.2.3 PCI 术后的长期随访
支架内血栓形成是药物洗脱支架置入后的常见并发症,支架内膜覆盖不全是晚期支架内血栓形成的重要原因。研究证实,支架丝内膜覆盖比例达到70%后,晚期支架内血栓的发生率大大下降[19]。因此,在PCI 术后随访过程中,对于支架内膜覆盖程度的评价尤为重要。过去20年来,IVUS 成为评价内膜覆盖程度的主要手段。然而,有研究显示,在西罗莫司药物洗脱支架置入6 个月后的随访中,2/3 的支架丝内膜覆盖厚度<100 μm,中位内膜覆盖厚度为52.5 μm,小于IVUS 的分辨率,故IVUS 对内膜覆盖厚度较薄的支架丝评价不准确[20]。因此,OCT 与IVUS 相比,其高分辨率可以对内膜覆盖厚度做出更准确的评价。
新生内膜增生(NIH)也是造成支架内狭窄的重要原因。IVUS 和OCT 均可通过测定支架内面积、管腔面积及内膜增生面积评价NIH 情况。有动物实验证明,与IVUS 相比,OCT 对于管腔面积的测定与组织学结果更加符合[21]。由于分辨率较高,OCT 可以识别厚度较薄的NIH。Kwon 等[22]对243 例患者进行支架置入术后进行OCT 和IVUS 检查,平均支架置入时间为12 个月,结果显示,OCT 对NIH 的检出率大于IVUS,IVUS 仅对NIH 面积>14.7%的病变有诊断意义,并且OCT 对NIH 组织成分的识别更有优势。Suzuki等[23]的研究也证实了这一点。然而,对于管腔面积的估测能力,不同研究的结果有很大差异。Kawase等[24]研究发现,OCT 与IVUS 所测得管腔面积无明显差异,而前者测得支架内面积小于后者,提示OCT 可能低估了NIH 面积。Gonzalo 等[13]和Kawamori 等[25]的研究发现,OCT 所测得管腔面积小于IVUS 测定结果。Fujino 等[26]对35 例左主干支架置入术后1年的患者进行FD-OCT 和IVUS 检查,结果显示管腔面积和支架面积没有明显差异。Gutiérrez-Chico 等[27]对45例生物可降解支架置入术后6 个月的患者分别进行FD-OCT 和IVUS 检查,结果显示,两种方法所测定的支架内面积和管腔面积没有明显的相关性。
这些研究结果出现较大差异的原因可能包括:OCT 成像时球囊阻断和造影剂注射速度不同,影响管腔压力,造成管腔面积差异;支架材料不同,造成回声、折光性能的差异,影响测定结果的准确性。由于上述研究样本量均有限,故还需进一步大样本研究证明OCT 与IVUS 对于管腔面积测定能力的差异。
对于支架内血栓形成的患者,OCT 可以更好地识别血栓类型,但由于血栓中红细胞的阻挡作用,OCT无法完全显示血栓外侧支架丝的贴壁及内膜覆盖情况。IVUS 可以穿透血栓,显示血栓深部的支架丝,同时,凭借较强的穿透力,IVUS 可以更好的观察动脉重塑的情况[28]。故IVUS 与OCT 有良好的互补作用[29]。
3 OCT 和IVUS 技术的结合
IVUS 技术具有更高的组织穿透力,OCT 有更高的分辨率,二者的结合可以为冠状动脉血管内评价提供更广泛的信息。Räber 等[30]选取了9 例患者的OCT和IVUS 图像,吻合各个截面后,将图像进行融合,为血管内斑块性质的研究提供了更多的信息。同时进行OCT 和IVUS 两种检查的技术也在迅速发展。Li等[31-32]在同一导丝上融合了OCT 与IVUS 探头,分别在兔主动脉和体外人冠状动脉中同时进行IVUS 和OCT 检查,先用IVUS 对血管进行宏观扫描,然后用OCT 对感兴趣区域进行细节评价,融合了高穿透力和高分辨率两个优势,与组织学结果更加吻合。由于样本量较小,这些研究未能定量分析新技术对诊断灵敏度和特异度带来的影响,也未能在不同人群和不同病理改变中证实新技术的可行性。未来需要更多的体内研究验证这种成像手段的实用性和安全性。两种技术的融合和优势互补将是未来血管内成像技术的重要发展方向。
4 结语
IVUS 技术的发展已经历了20 余年的时间,在冠状动脉评价中有广泛的应用且效果值得肯定。OCT技术经过10年的发展,逐渐克服了成像时间长,需要血流阻断等技术缺陷,也成为了不可替代的检查手段。IVUS 凭借其较深的穿透能力和较广的成像范围使其在观察动脉壁重构情况,指导PCI 术后球囊扩张等方面拥有较大的优势;OCT 凭借更高的分辨率,在评价易损斑块,判断PCI 术后即刻并发症以及评价支架内膜覆盖程度等方面有更好的效果。而两项技术对于冠状动脉内狭窄程度和NIH 的分析能力的优劣尚需进一步大样本量的研究去证实。两项技术的结合应用可以为冠状动脉评价提供更多信息,必将为未来血管内成像技术的发展提供更加广阔的前景。
[1]Terashima M,Kaneda H,Suzuki T.The role of optical coherence tomography in coronary intervention[J].Korean J Intern Med,2012,27:1-12.
[2]Regar E,Ligthart J,Bruining N,et al.The diagnostic value of intracoronary optical coherence tomography[J].Herz,2011,36:417-429.
[3]Guo J,Sun L,Chen YD,et al.Ex vivo assessment of coronary lesions by optical coherence tomography and intravascular ultrasound in comparison with histology results[J].Zhonghua Xin Xue Guan Bing Za Zhi,2012,40:302-306.
[4]Kume T,Okura H,Kawamoto T,et al.Assessment of the coronary calcification by optical coherence tomography[J].EuroIntervention,2011,6:768-772.
[5]Valgimigli M,Agostoni P,Serruys PW.Acute coronary syndromes:an emphasis shift from treatment to prevention,and the enduring challenge of vulnerable plaque detection in the cardiac catheterization laboratory[J].J Cardiovasc Med,2007,8:221-229.
[6]Kume T,Okura H,Yamada R,et al.Frequency and spatial distribution of thin-cap fibroatheroma assessed by 3-vessel intravascular ultrasound and optical coherence tomography:an ex vivo validation and an initial in vivo feasibility study[J].Circ J,2009,73:1086-1091.
[7]Takahashi K,Kakuta T,Yonetsu T,et al.In vivo detection of lipid-rich plaque by using a 40-MHz intravascular ultrasound:a comparison with optical coherence tomography findings[J].Cardiovasc Interv Ther,2013,28(4):333-343.
[8]Kubo T,Nakamura N,Matsuo Y,et al.Virtual histology intravascular ultrasound compared with optical coherence tomography for identification of thin-cap fibroatheroma[J].Int Heart J,2011,52:175-179.
[9]Takagi A,Tsurumi Y,Ishii Y,et al.Clinical potential of intravascular ultrasound for physiological assessment of coronary stenosis:relationship between quantitative ultrasound tomography and pressure-derived fractional flow reserve[J].Circulation,1999,100:250-255.
[10]Bezerra HG,Attizzani GF,Sirbu V,et al.Optical coherence tomography versus intravascular ultrasound to evaluate coronary artery disease and percutaneous coronary intervention[J].JACC Cardiovasc Interv,2013,6:228-236.
[11]Ramesh S,Papayannis A,Abdel-karim AR,et al.In vivo comparison of Fourier-domain optical coherence tomography and intravascular ultrasonography[J].J Invasive Cardiol,2012,24:111-115.
[12]Gonzalo N,Escaned J,Alfonso F,et al.Morphometric assessment of coronary stenosis relevance with optical coherence tomography:a comparison with fractional flow reserve and intravascular ultrasound[J].J Am Coll Cardiol,2012,59:1080-1089.
[13]Gonzalo N,Serruys PW,Garcia-Garcia HM,et al.Quantitative ex vivo and in vivo comparison of lumen dimensions measured by optical coherence tomography and intravascular ultrasound in human coronary arteries[J].Rev Esp Cardiol,2009,62:615-624.
[14]Kim SJ,Lee H,Kato K,et al.In vivo comparison of lumen dimensions measured by time domain-,and frequency domain-optical coherence tomography,and intravascular ultrasound[J].Int J Cardiovasc Imaging,2013,29(5):967-975.
[15]Jamil Z,Tearney G,Bruining N,et al.Interstudy reproducibility of the second generation,Fourier domain optical coherence tomography in patients with coronary artery disease and comparison with intravascular ultrasound:a study applying automated contour detection[J].Int J Cardiovasc Imaging,2013,29:39-51.
[16]Habara M,Nasu K,Terashima M,et al.Impact of frequency-domain optical coherence tomography guidance for optimal coronary stent implantation in comparison with intravascular ultrasound guidance[J].Circ Cardiovasc Interv,2012,5:193-201.
[17]Kume T,Okura H,Miyamoto Y,et al.Natural history of stent edge dissection,tissue protrusion and incomplete stent apposition detectable only on optical coherence tomography after stent implantation—preliminary observation[J].Circ J,2012,76:698-703.
[18]Gomez-Lara J,Brugaletta S,Diletti R,et al.Agreement and reproducibility of gray-scale intravascular ultrasound and optical coherence tomography for the analysis of the bioresorbable vascular scaffold[J].Catheter Cardiovasc Interv,2012,79:890-902.
[19]Finn AV,Joner M,Nakazawa G,et al.Pathological correlates of late drug-eluting stent thrombosis:strut coverage as a marker of endothelialization[J].Circulation,2007,115:2435-2441.
[20]Matsumoto D,Shite J,Shinke T,et al.Neointimal coverage of sirolimus-eluting stents at 6-month follow-up:evaluated by optical coherence tomography[J].Eur Heart J,2007,28:961-967.
[21]Nishimura S,Kataoka T,Hasegawa T,et al.Detailed observation of arterial healing after stent implantation in swine arteries by using optical coherence tomography[J].Osaka City Med J,2012,58:1-11.
[22]Kwon SW,Kim BK,Kim TH,et al.Qualitative assessment of neointimal tissue after drug-eluting stent implantation:comparison between follow-up optical coherence tomography and intravascular ultrasound[J].Am Heart J,2011,161:367-372.
[23]Suzuki Y,Ikeno F,Koizumi T,et al.In vivo comparison between optical coherence tomography and intravascular ultrasound for detecting small degrees of in-stent neointima after stent implantation[J].JACC Cardiovasc Interv,2008,1:168-173.
[24]Kawase Y,Hoshino K,Yoneyama R,et al.In vivo volumetric analysis of coronary stent using optical coherence tomography with a novel balloon occlusionflushing catheter:a comparison with intravascular ultrasound[J].Ultrasound Med Biol,2005,31:1343-1349.
[25]Kawamori H,Shite J,Shinke T,et al.The ability of optical coherence tomography to monitor percutaneous coronary intervention:detailed comparison with intravascular ultrasound[J].J Invasive Cardiol,2010,22:541-545.
[26]Fujino Y,Bezerra HG,Attizzani GF,et al.Frequency-domain optical coherence tomography assessment of unprotected left main coronary artery disease—a comparison with intravascular ultrasound[J].Catheter Cardiovasc Interv,2013,82(3):E173-183.
[27]Gutiérrez-Chico JL,Serruys PW,Girasis C,et al.Quantitative multi-modality imaging analysis of a fully bioresorbable stent:a head-to-head comparison between QCA,IVUS and OCT[J].Int J Cardiovasc Imaging,2012,28:467-478.
[28]Yamada R,Okura H,Kume T,et al.Relationship between arterial and fibrous cap remodeling:a serial three-vessel intravascular ultrasound and optical coherence tomography study[J].Circ Cardiovasc Interv,2010,3:484-490.
[29]Alfonso F,Dutary J,Paulo M,et al.Combined use of optical coherence tomography and intravascular ultrasound imaging in patients undergoing coronary interventions for stent thrombosis[J].Heart,2012,98:1213-1220.
[30]Räber L,Heo JH,Radu MD,et al.Offline fusion of co-registered intravascular ultrasound and frequency domain optical coherence tomography images for the analysis of human atherosclerotic plaques[J].EuroIntervention,2012,8:98-108.
[31]Li BH,Leung AS,Soong A,et al.Hybrid intravascular ultrasound and optical coherence tomography catheter for imaging of coronary atherosclerosis[J].Catheter Cardiovasc Interv,2013,81:494-507.
[32]Yang HC,Yin J,Hu C,et al.A dual-modality probe utilizing intravascular ultrasound and optical coherence tomography for intravascular imaging applications[J].IEEE Trans Ultrason Ferroelectr Freq Control,2010,57:2839-2843.
