珠江中下游颗粒有机质的碳氮稳定同位素、氨基酸和木质素组成及其地球化学意义
2014-07-14张玉龙
张玉龙, 冉 勇
(1. 中国科学院 广州地球化学研究所 有机地球化学国家重点实验室, 广州 广东 510640; 2. Department of Biological Sciences, University of South Carolina, Columbia, SC 29208, USA; 3. 中国科学院大学, 北京 100049)
0 引 言
全球河流每年向海洋输送约 20×1015g颗粒物,其携带的有机碳(0.2×1015g)占到河流输出有机碳的一半[1]。因此, 对河流颗粒物有机质的来源、降解、传输和归趋的认识是全球碳循环研究的重要方面。陆源有机质作为河流颗粒物的重要来源之一, 可粗略分为不同类型植物(裸子和被子植物、C3和 C4植物)和土壤有机质。它们的来源、迁移和转化直接影响到其在河流和海洋中的归趋[1–2]。
为了揭示河流有机质的生物地球化学行为, 研究者使用了不同的方法手段, 如稳定碳同位素。陆源植物通过光合作用固定无机碳有两种途径, 不同途径合成的有机碳具有显著差别的δ13C值。C3植物固定较少的13C (δ13C = –27‰~ –28‰), 而 C4植物却能富集大量的13C (δ13C = –13‰)[1–2]。淡水浮游生物的 δ13C 值范围较宽–24‰~ –42‰, 平均值为–30‰[2]。除了总有机质(bulk)的指标外, 有机质的分子水平测定可以提供更加详细的来源和降解信息[1]。比如, 木质素是陆生高等植物的生物标志物, 木质素酚中的丁香基酚系列(S)在被子植物中的比例比较大, 而在裸子植物中极少; 肉桂基酚系列(C)在植物的非木质部(叶)和草本植物中的含量较大[3–6]。与木质素不同,氨基酸广泛存在于陆生和水生生物中。通常, 它在浮游生物和微生物中的丰度比在陆生和水生植物中的丰度明显高很多[7–8]。相对于总有机碳(TOC)或总氮(TN), 氨基酸更容易被微生物所降解。所以, 很多研究利用氨基酸碳在总有机碳或氨基酸氮在总有机氮中的比例(TAAC或 TAAN)来指示有机质的降解程度或生物可利用性[8]。
珠江是中国流量第二的河流, 流经亚热带地区,汇入南海。每年珠江向南海输送 330×109m3水和30.64×106t颗粒物[9]。珠江流域的气候受东亚季风控制, 4月至9月为雨季, 12月至次年2月为旱季。其中 80%的径流量和 94%的颗粒物集中在雨季输出[9]。对珠江有机质的生物地球化学研究主要集中在珠江口[9–13], 对珠江流域颗粒有机质的分子水平信息的认识还不充分。木质素作为有效的陆源有机质的生物标志物, 目前在国内主要河流中的应用还比较少, 仅在长江流域有个别报道[14]。本研究的目标是利用碳氮同位素组成、氨基酸和木质素组成来揭示珠江悬浮颗粒物中有机质的来源和组成。
1 材料与方法
1.1 样品采集
从2008年12月到2010年6月, 分别在万绿湖水库(WLH)、石湾(SW)、博罗(BL)、金坑水库(JK)、鱼珠码头(YZ)和莲花山(LHS)等六个采样点采集大量的表层水(深0.5~1 m) (图1)。其中在鱼珠码头和莲花山采样点分别采集了旱季和雨季的样品。运回实验室后, 利用连续流离心机使颗粒物与水分离(10000 转/min, 25 ℃)。颗粒物从转子中取出后, 冰柜保存(–20 ℃)过夜。冷冻干燥后, 研磨备用。
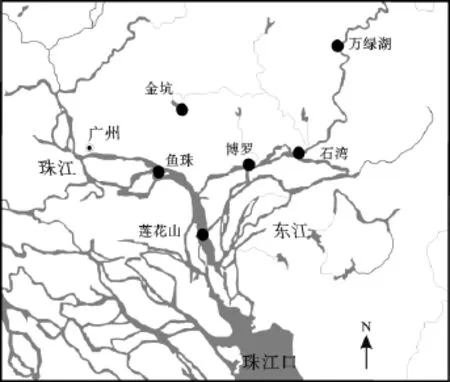
图1 珠江流域采样点图Fig.1 The sampling map in the Pearl River watershed
1.2 分析方法
1.2.1 元素和同位素分析
颗粒物首先经酸化去除碳酸盐。然后, 样品置于烘箱中干燥, 恒重。总有机碳(TOC)和总氮(TN)采用Vario EL Ⅲ Elementar元素分析仪测定。每个样品进样分析2次, 取平均值。相对误差优于5%。稳定同位素使用Finnigan Delta Plus XL气相色谱-稳定同位素比值质谱仪测定。碳、氮同位素组成依据13C/12C和15N/14N比值确定的δ值来表示; 分析标准分别参照二级标准炭黑(换算成PDB标准)和空气。平均分析精度优于0.2‰。
1.2.2 氧化铜法测定木质素
单体木质素依据氧化铜氧化法[15]测定。8.0~110.0 mg的颗粒物与330 mg氧化铜、106 mg碱式硫酸亚铁、10 mg葡萄糖混合。加入氢氧化钠溶液后, 在氮气保护下, 155 ℃反应2.5 h。反应结束后, 反应液转移到试管中, 离心(3000转/min,5 min),取上层清液并调pH到2。再次离心(3000转/min,5 min), 取上清液流经固相萃取柱进行提取。杂质使用甲醇水溶液(甲醇/水为 3∶7)清洗去除, 目标物使用1.5 mL的混合溶液(二氯甲烷/乙酸甲酯/吡啶为75∶20∶5)和1 mL甲醇洗脱。洗脱液用氩气吹干, 溶解在100 µL吡啶中, 冷藏保存。进样前, 样品使用双(三甲基硅烷基)三氟乙酰胺 (BSTFA) 和 1%三甲基氯硅烷 (TMCS) 在75 ℃下衍生化15 min, 然后立即进样安捷伦气相色谱-质谱检测器(GC-MS)分析。升温程序: 初始温度100 ℃, 以4 ℃/min的速度升至 300 ℃。氧化产物的定量基于外标曲线, 且经过内标修正。随机选择2个样品进行重现性分析,结果表明, 分析误差优于10%。
1.2.3 氨基酸测定
氨基酸测定采用Phenomenex公司(美国)的商用方法EZ:faast。将约20 mg颗粒物置于安瓿瓶, 然后缓慢滴加2 mL(6 mol/L)盐酸。火焰封口后在110 ℃下反应 20 h。反应结束后, 样品转移到细胞瓶离心(3000转/min,10 min), 转移上清液。上清液缓慢流经吸附剂, 用水清洗后, 氨基酸用有机溶剂萃取,调pH到3。提取的目标物衍生化1 min去极性, 然后用安捷伦气相色谱-氢离子火焰检测器(GC-FID)检测。进样量2 µL, 分馏比10∶1, 升温程序: 从110 ℃以30 ℃/min的速率升至320 ℃, 保持20 min。16种蛋白氨基酸【甘氨酸(GLY)、丙氨酸(ALA)、丝氨酸(SER)、羟丁氨酸(THR)、胱氨酸(CYS)、缬氨酸(VAL)、亮氨酸(LEU)、异亮氨酸(ILE)、蛋氨酸(MET)、脯氨酸(PRO)、苯丙氨酸(PHE)、酪氨酸(TYR)、天冬氨酸(ASP)、谷氨酸(GLU)、组氨酸(HIS)和赖氨酸(LYS)】和2种非蛋白氨基酸【二氨基庚二酸(Dapa)和羟基脯氨酸(HYP)】单体定量基于外标曲线和内标。方法重现性通过重复检测生物样 Azotobacter Vineladh进行评价。结果表明, 分析误差优于10%。
2 结果与讨论
2.1 颗粒有机质的来源和降解程度
珠江是我国主要河流中含沙量较小的河流(珠江水利网), 我们调查的珠江颗粒物的平均丰度为(21±17) mg/L, 这个值远小于长江(68 mg/L)[16]和密西西比河(152 mg/L)[2]。较低的颗粒物丰度说明了河水的浊度相对较低。除了JK (19.0%)外, 珠江颗粒物的TOC含量(平均3.7%)高于长江(1.1%)[16]和密西西比河(1.6%)[17]。一般认为, 土壤和浮游生物是河流颗粒物的两个主要来源[18]。而土壤的的TOC含量远远低于浮游生物(30%)[7]。珠江流域土壤的平均TOC含量为2.1%[11], 低于珠江颗粒物的TOC含量,说明浮游生物很可能是珠江颗粒物有机质的一个重要来源。植物的 TOC含量通常也非常高(约50%)[7], 是颗粒物的一个潜在来源。但依据木质素的组成, 珠江颗粒物有机质的陆源来源主要为土壤(见下文)。
珠江颗粒物的 TOC含量在 1.4%~19.0%之间,总氮(TN)在 0.13%~3.82%之间。总体上, 如果颗粒物中的氮以有机质形式存在, 那么TOC和TN之间回归曲线的截距应当靠近原点[1]。如图2所示, 除JK外, 基于剩余颗粒物的回归曲线(实线)基本穿过原点, 说明了除JK外的其他颗粒物中的氮主要以有机形式存在。JK颗粒物有极高的TOC和TN含量, 可能与金坑水库附近的垃圾填埋场有关。依据回归曲线(y = 0.16x–0.09, R2= 0.83)的斜率, 整体上, 珠江颗粒物的C/N比值为7.3, 该值落在浮游生物的C/N比值范围内(5.0~8.0)[2]。据报道, 因为显著的土壤有机质的输入, 长江、亚马孙河和大部分美国河流颗粒物的平均C/N比值落在11.0~14.6之间[2,16,19]。珠江颗粒物的C/N比值范围在5.8~12.1之间, 说明浮游生物也并非唯一的有机质来源。但颗粒物的 C/N比值均显著小于植物的特征值(> 15)[2], 说明植物对珠江颗粒有机质的贡献可能较少。
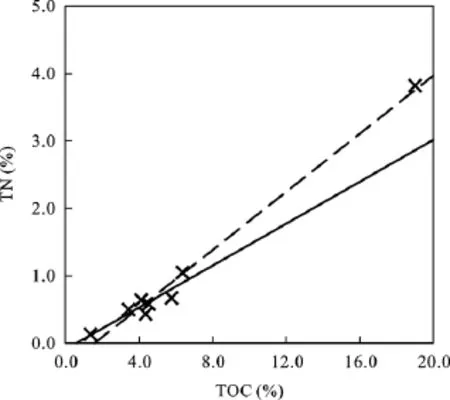
图2 颗粒物的总有机碳(TOC)和总氮(TN)的关系Fig.2 The TOC and TN contents of the Pearl River particles
除 JK外(δ13C = –36.9‰), 颗粒物的 δ13C值的变化范围在–30.9‰~ –26.3‰之间, 平均值为–28.3‰。这与之前对珠江下游及河口颗粒物的报道一致[10,11,20]。与长江(–24.4‰±0.37‰)[16]、密西西比河(–22.4‰)[21]、黄河(–24.4‰)[22]相比, 珠江颗粒物的δ13C更“轻”。Yu et al.[11]报道了珠江流域C4植物、C3植物和土壤有机质的稳定碳同位素组成分别是–13.1‰、–29.0‰和–24.1‰。而淡水浮游生物的平均 δ13C 值为–30.0‰[2]。通过对比, 珠江颗粒物较“轻”的δ13C说明C4植物对颗粒有机质的贡献较小。但是珠江中游广泛地分布着草地(大部分是 C4)[23],下游的农田以水稻(C3)、甘蔗(C4)和玉米(C4)为主要作物[24]。珠江土壤有机质的平均 δ13C值为–24.1‰,说明了 C4来源有机碳对土壤的重要性。结合 δ13C值和C/N比值, 图3定性地反映颗粒有机质主要来源于浮游生物和土壤, 而C3植物贡献较少。这个推测可以进一步用δ15N值和分子水平组成证实。
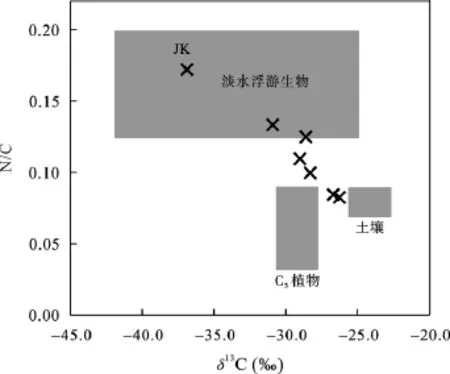
图3 浮游生物、C3植物、土壤有机质和颗粒物有机质的N/C比值和稳定碳同位素组成Fig.3 Atomic ratio of N/C and carbon isotope composition of plankton,C3 plant, soil organic matter and the particulate organic matter in the Pearl River
颗粒物的δ15N值也可以为浮游生物来源提供证据。因为土壤(2.0‰~5.0‰)、植物(3.0‰~7.0‰)和浮游生物(–15.0‰~20.0‰)的 δ15N 值范围是重合的[2],所以δ15N值很少用于区分有机质来源。但是, 一些超出了土壤或植物范围(< 2.0‰ 或> 7.0‰)的极端δ15N值也能指示浮游生物来源[2]。珠江颗粒物的δ15N值范围非常广, 从0.1‰到12.7‰。其中一半的颗粒物样品检测到了极端的 δ15N值, 表明了浮游生物来源的重要性。结合其他浮游生物的特征, 比如, 低的C/N比值和轻的δ13C, 可以进一步说明浮游生物对BL颗粒物的重要贡献。需要注意的是人为来源的有机质会影响 δ15N值, 特别是在一些人口稠密区[9]。
颗粒物中总水解氨基酸(THAA)质量归一化浓度的范围非常大。除了JK颗粒物(156.9 mg/g)外, 其他颗粒物的THAA浓度落在7.1~41.8 mg/g之间, 这与Chen et al.[25]对珠江口悬浮颗粒物的调查结果一致。各颗粒物中氨基酸的相对组成(摩尔分数, %)基本一致(图4), 与珠江口颗粒物中氨基酸的相对组成也十分相似[25]。其中, 中性氨基酸(GLY、ALA、VAL、LEU、ILE、SER、THR 和 PRO)的比例占优, 酸性氨基酸(ASP和GLU)次之, 碱性氨基酸(HIS和LYS)比例最小。几种主要氨基酸的相对丰度从大到小依次为: GLY > ALA > GLU > ASP。不同氨基酸在降解过程中的难易程度不同。根据这个性质, Dauwe et al.[26]利用氨基酸的相对组成和主成分分析得到降解指数(degradation index, DI)来指示氨基酸降解程度的大小。珠江颗粒物样品的DI范围为–0.51~0.79, 对比Dauwe et al.的参照样品, 这些指数说明了有机质经历了轻度到中度的降解。二氨基庚二酸(Dapa)是细菌的生物标志物[27], 在大部分颗粒物中检测到了微量(0.08~0.13 mg/100 mg OC)的 Dapa, 说明细菌也是颗粒有机质的一个来源。
氨基酸碳在总有机碳或氨基酸氮在总有机氮中的比例(TAAC或 TAAN)被广泛用于指示有机质的降解状态[7]。在调查的珠江颗粒物中, TAAC值普遍较高, 从 22.6%~37.4%。其中一半的值落在新鲜浮游生物的 TAAC范围内(23.8%~59.4%)[7], 另一半的值比这个范围略小, 这说明储藏在颗粒物中的氨基酸经历了轻度降解, 仍具有相当的生物可利用性。高等植物、珠江流域的土壤和沉积物的TAAC值分别为2.6%~2.8%[28]、3.2%[29]和 11.7%~16.2%[25]。因此, 尽管珠江颗粒物中氨基酸经历了降解, 但是它们的TAAC值都显著高于其他的氨基酸来源, 这说明浮游生物是珠江颗粒物有机质的一个重要来源。所有颗粒物中YZ2和LHS1的TAAN值最高, 分别为66.1%和 69.9%, 但它们的 TAAC值却比较低 , 这说明除了浮游生物外, 陆源土壤或植物对颗粒物贡献也很显著。YZ2和LHS1颗粒物的C/N比值为11.8和12.1也同样说明陆源有机质贡献比较重要。

图4 单体氨基酸的摩尔分数Fig.4 The mole percentages of individual amino acids
珠江颗粒物中木质素酚 V、S、C系列的 TOC归一化浓度的总和定义为木质素浓度(λ8)。结果显示,颗粒物中木质素的浓度范围为 0.06到 1.12 mg/100mg OC。因为木质素酚仅存在于陆生高等植物中, 所以检测到的木质素酚说明颗粒物中存在陆源有机质[4]。与密西西比河和长江相比[5,6,14,21], 珠江颗粒物中木质素的丰度较低。根据上文讨论, 这可能是由于浮游生物对珠江颗粒物有机质贡献显著,稀释了TOC归一化木质素浓度造成的。
木质素中 V和 S系列的酸醛比(Ad/Al)v和(Ad/Al)s以及二羟基苯甲酸与 V系列的比值3,5-BD/V被广泛用于指示陆源有机质的降解程度,随着降解程度的提高, 这些比值呈增加趋势[30]。木质素是天然生物分子中抗降解能力最强的一类化合物, 它一般只在陆地土壤白腐菌的作用下才能有效降解[6,31]。而在水环境中, 两年内基本观察不到其显著的降解[29]。所以, 高的酸醛比(Ad/Al > 0.4)通常只能在土壤有机质中观察到, 因而可以用来指示土壤有机质来源。珠江颗粒物的(Ad/Al)v和(Ad/Al)s值分别落在0.37~0.75和0.35~0.59的区间内。除了个别略小于 0.4外, 其他均高于 0.4, 说明了土壤有机质来源对于颗粒物的重要性。3,5-BD随着有机质降解或腐殖化过程在土壤中富集, 因此较高的 3,5-BD/V比值(> 0.1)也可以指示土壤有机质来源[32]。而植物的 3,5-BD/V比值通常小于 0.1。珠江颗粒物的3,5-BD/V 比值大部分(0.06~1.12)落在土壤有机质的范围中。
木质素的S、V、C组成也可以用于识别植物来源。颗粒物中高的 S/V 比值(0.72~1.22)说明有机质均来自被子植物。这与珠江流域的森林植被和主要农作物一致: 水稻、甘蔗、玉米(均为被子植物)。颗粒物的C/V比值落在0.27~1.43范围之间, 说明了植物的木质部和非木质部均是颗粒物有机质的来源[6]。
以上对总有机质性质和分子水平组成的分析表明, 珠江下游颗粒物中的有机质主要来源于降解程度高的土壤有机质以及降解程度较小的浮游生物, 而C3植物的贡献很小。我们进一步利用三端元混合模型来对有机质的组成进行定量分析。模型公式如下:
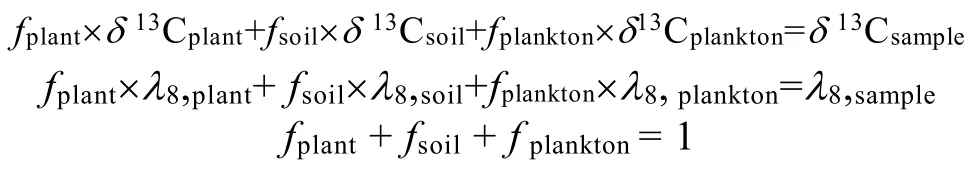
式中: fplant、fsoil和fplankton分别代表C3植物、土壤和浮游生物在颗粒有机碳中所占的比例; δ13C和 λ8代表稳定碳同位素组成和木质素浓度。珠江流域土壤的 δ13C 值(–24.1‰)和 λ8值(0.5 mg/100 mg OC)引自Yu et al.[11]和 Houel et al.[31]; C3植物的 δ13C 值(–29.0‰)和 λ8值(7.0 mg/100 mg OC)引自 Yu et al.[11]和Tesi et al.[33]。因为JK颗粒物表现了一系列新鲜浮游生物的信号, 所以浮游生物的δ13C端元值选为–36.9‰, 其 λ8为 0。
模型结果表明, 土壤占到颗粒有机质的45%~77%, 是颗粒有机质的主要来源; 浮游生物对颗粒物的贡献也很显著, 为 13%~52%; 植物贡献最小, 为0%~11%。土壤对颗粒物的重要贡献和珠江的土壤侵蚀现状是一致的[34]。与世界上其他主要河流(长江、密西西比河、亚马孙河)[5,6,14,19,21]不同, 浮游生物对珠江颗粒物的贡献是比较显著的。这样情况只在少数河流(如密西西比河的一些支流、多瑙河)[2]中有报道。浮游生物的显著贡献也是造成珠江颗粒物中木质素的含量偏低主要原因之一。
2.2 湖泊和河流颗粒物中木质素组成的差异
在木质素含量和组成方面, 珠江流域两个水库(JK和 WLH)采集的颗粒物明显不同于珠江河流中的颗粒物(图5)。首先, 水库表层颗粒物的木质素丰度(0.06~0.07 mg/100mg OC)远低于河流颗粒物(0.38~1.12 mg/100 mg OC)。这是因为在水库中木质素倾向于沉降到底部。另外, 水库表层水体透光度更好, 比较平静, 有利于浮游生物生长, 增加的浮游生物有机质也是造成木质素浓度偏低的一个重要因素。其次, 水库颗粒物的3,5-BD/V比值(0.42~1.12)明显高于河流颗粒物, 说明了其陆源有机质降解程度很高。同时, 其C/V比值(1.12~1.43)也明显高于河流颗粒物, 而这样高的 C/V比值通常在植物中很少发现。但是与Houel et al.[31]报道的矿质土壤中C/V比值一致。水库的颗粒物丰度显著低于河流(表 1),静态水环境有利于颗粒物的沉降, 而粒径小的颗粒物可以选择性滞留在上层水体, 因此, 粒径分异可能是导致以上现象的原因。总结发现, 木质素在水库中的分布机制是: 木质素选择性地沉降到底层,滞留在表层水体的木质素来自于降解程度高的矿质土壤。这与颗粒有机质在边缘海的动力分选(hydrodynamic sorting)机制非常相似: 细小的非木质部有机质和矿质土壤有机质可以选择性地迁移到深海[35]。
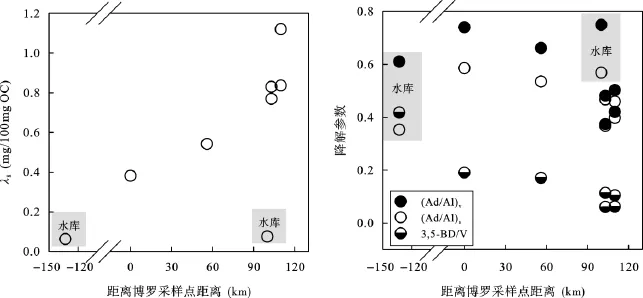
图5 从中游到下游颗粒物的木质素浓度及降解参数的变化Fig.5 Lignin concentration and degradation indicators of the particles from the middle and the lower reaches of the Pearl River
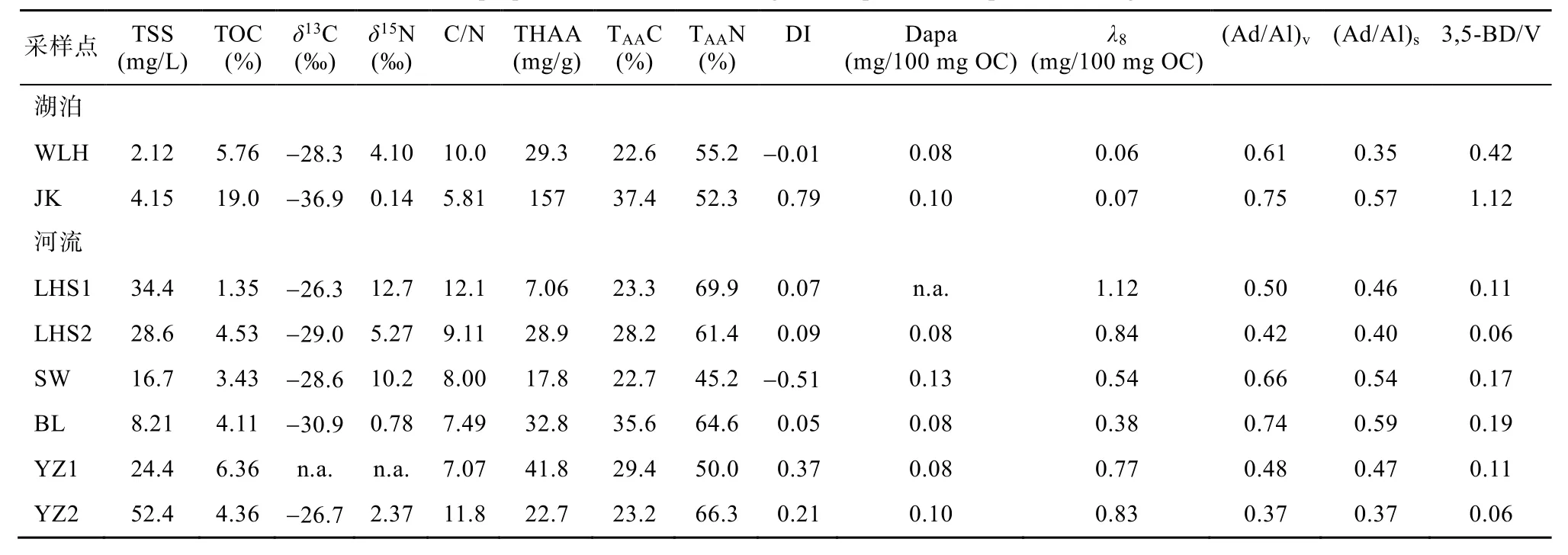
表1 颗粒有机质的性质及氨基酸和木质素组成Table 1 Bulk properties, amino acid and lignin compositions of particulate organic matter
从珠江中游到下游, 木质素组成有明显的变化趋势(图5)。整体上, 从中游到下游颗粒物中木质素浓度呈增加趋势。下游木质素浓度比中游高可能有两个原因造成: 一是木质素含量较高的颗粒物输入;二是其他易降解有机质对颗粒有机质的贡献降低。动力分选会造成非木质、降解程度高的陆源有机质被选择性地传输[35]。假设动力分选在珠江运输颗粒物起作用, 那么运送到河口的颗粒物应当含有高降解程度(高3,5-BD/V和Ad/Al比值)的, 非木质部(高C/V比值)的陆源有机质。但是从中游到下游, 颗粒物的3,5-BD/V和Ad/Al比值是不断减小的, 这说明动力分选并非影响珠江颗粒物中陆源组成的主要因素。下游颗粒物中木质素的增加可能与降解程度较小的木质部陆源有机质输入有关。
此外, 颗粒物的丰度和木质素浓度之间有非常显著的正相关关系(图6), 这可能与浮游生物的贡献有关。颗粒物丰度可以粗略地反映水体浊度: 浊度越大, 水体透光度越差, 浮游生物生长越受限制。浮游生物的颗粒有机质贡献越少, 木质素的浓度就越高。
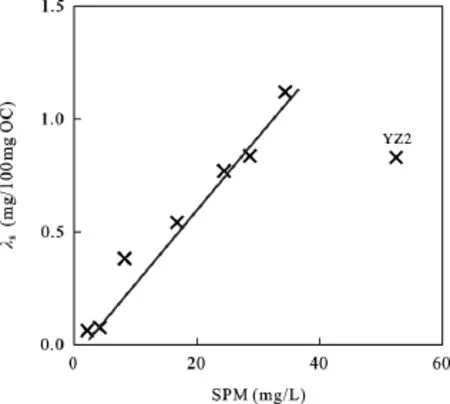
图6 颗粒物丰度(TSS)和木质素浓度(λ 8)之间的关系Fig.6 The relationship between abundance and lignin concentration of suspended particulate matter
3 结 论
调查的一系列指标说明降解程度小的浮游生物和降解程度高的土壤是珠江悬浮颗粒物的两个主要来源。颗粒物的有机质组成有显著的空间差异, 水库中的陆源有机质可能主要源于矿质土壤, 而河流中的陆源有机质主要源于植物或表层土壤。颗粒物丰度的提高, 抑制浮游生物的生长, 使得颗粒物中木质素浓度升高。
特别感谢 University of South Carolina的 Karl Kaiser、Cedric Fichot和Michael Philben博士在木质素和氨基酸检测方法上的指导, 以及张代男和黄文博士在样品采集工作中的帮助。
:
[1] Hedges J I, Keil R G. Sedimentary organic matter preservation:An assessment and speculative synthesis [J]. Mar Chem, 1995,49(2/3): 81–115.
[2] Kendall C, Silva S R, Kelly V J. Carbon and nitrogen isotopic compositions of particulate organic matter in four large river systems across the United States [J]. Hydrol Process, 2001,15(7): 1301–1346.
[3] Hedges J I, Parker P L. Land-derived organic matter in surface sediments from the Gulf of Mexico [J]. Geochim Cosmochim Acta, 1976, 40(9): 1019–1029.
[4] Goñi M A, Ruttenberg K C, Eglinton T I. A reassessment of the sources and importance of land-derived organic matter in surface sediments from the Gulf of Mexico [J]. Geochim Cosmochim Acta, 1998, 62(18): 3055–3075.
[5] Goñi M A, Yunker M B, Macdonald R W, Eglinton T I.Distribution and sources of organic biomarkers in arctic sediments from the Mackenzie River and Beaufort Shelf [J].Mar Chem, 2000, 71(1/2): 23–51.
[6] Gordon E S, Goñi M A. Sources and distribution of terrigenous organic matter delivered by the Atchafalaya River to sediments in the northern Gulf of Mexico [J]. Geochim Cosmochim Acta, 2003, 67(13): 2359–2375.
[7] Cowie G L, Hedges J I. Sources and reactivities of amino-acids in a coastal marine-environment [J]. Limnol Oceanogr, 1992, 37(4): 703–724.
[8] Cowie G L, Hedges J I. Biochemical indicators of diagenetic alteration in natural organic matter mixtures [J]. Nature, 1994,369(6478): 304–307.
[9] Higginson M J, Maxwell J R, Altabet M A. Nitrogen isotope and chlorin paleoproductivity records from the Northern South China Sea: Remote vs. local forcing of millennial- and orbital-scale variability [J]. Mar Geol, 2003, 201(1–3):223–250.
[10] He Biyan, Dai Minhan, Zhai Weidong, Wang Lifang, Wang Kejian, Chen Junhui, Lin Jianrong, Han Aiqin, Xu Yanping.Distribution, degradation and dynamics of dissolved organic carbon and its major compound classes in the Pearl River estuary, China [J]. Mar Chem, 2010, 119(1–4): 52–64.
[11] Yu Fengling, Zong Yongqiang, Lloyd J M, Huang Guangqing,Leng M J, Kendrick C, Lamb A L, Yim W W S. Bulk organic δ13C and C/N as indicators for sediment sources in the Pearl River delta and estuary, southern China [J]. Estuarine Coastal Shelf Sci, 2010, 87(4): 618–630.
[12] Zhang Ling, Yin Kedong, Wang Lu, Chen Fanrong, Zhang Derong, Yang Yongqiang. The sources and accumulation rate of sedimentary organic matter in the Pearl River Estuary and adjacent coastal area, Southern China [J]. Estuarine Coast Shelf Sci, 2009, 85(2): 190–196.
[13] Yang Shouye, Tang Min, Yim W W S, Zong Yongqiang,Huang Guangqing, Switzer A D, Saito Y. Burial of organic carbon in Holocene sediments of the Zhujiang (Pearl River)and Changjiang (Yangtze River) estuaries [J]. Mar Chem,2011, 123(1–4): 1–10.
[14] 于灏. 颗粒态陆源有机物在长江和东海陆架区的迁移和埋藏[D]. 上海: 华东师范大学, 2007.Yu Hao. Transport and burial of particulate terrigenous organic matter in Changjiang (Yangtza River) and East China Sea Shelf — Illustrated by lignin [D]. Shanghai: East China Normal University, 2007 (in Chinese with English abstract).
[15] Kaiser K, Benner R. Characterization of lignin by gas chromatography and mass spectrometry using a simplified CuO oxidation method [J]. Anal Chem, 2012, 84(1): 459–464.
[16] Wu Ying, Dittmar T, Ludwichowski K-U, Kattner G, Zhang J,Zhu Z Y, Koch B P. Tracing suspended organic nitrogen from the Yangtze River catchment into the East China Sea [J]. Mar Chem, 2007, 107(3): 367–377.
[17] Bianchi T S, Wysocki L A, Stewart M, Filley T R, McKee B A.Temporal variability in terrestrially-derived sources of particulate organic carbon in the lower Mississippi River and its upper tributaries [J]. Geochim Cosmochim Acta, 2007,71(18): 4425–4437.
[18] Hedges J I, Keil R G, Benner R. What happens to terrestrial organic matter in the ocean? [J]. Org Geochem, 1997, 27(5/6):195–212.
[19] Hedges J I, Clark W A, Quay P D, Richey J E, Devol A H,Santos U M. Compositions and fluxes of particulate organic material in the Amazon River [J]. Limnol Oceanogr, 1986,31(4): 717–738.
[20] 魏秀国, 沈承德, 孙彦敏, 易惟熙. 珠江水体悬浮颗粒有机碳稳定同位素组成及分布特征[J]. 地理科学, 2003, 23(4):471–476.Wei Xiu-guo, Shen Cheng-de, Sun Yan-min, Yi Wei-xi.Characteristic of the organic carbon-isotope composition and contribution of suspended matter in the Pearl River [J]. Sci Geogr Sinica, 2003, 23(4): 471–476 (in Chinese with English abstract).
[21] Onstad G D, Canfield D E, Quay P D, Hedges J I. Sources of particulate organic matter in rivers from the continental usa:Lignin phenol and stable carbon isotope compositions [J].Geochim Cosmochim Acta, 2000, 64(20): 3539–3546.
[22] Mayer L M, Keil R G, Macko S A, Joye S B, Ruttenberg K C,Aller R C. Importance of suspended particulates in riverine delivery of bioavailable nitrogen to coastal zones [J]. Global Biogeochem Cycles, 1998, 12(4): 573.
[23] 王兆礼, 陈晓宏, 杨涛. 近50a东江流域径流变化及影响因素分析 [J]. 自然资源学报, 2010, 25(8): 1365–1374.Wang Zhao-li, Chen Xiao-hong, Yang Tao. Runoff variation and its impacting factors in the Dongjiang River Basin during 1956–2005 [J]. J Nat Res2010, 25(8): 1365–1374 (in Chinese with English abstract).
[24] Sun Xiangjun, Li Xun, Beug H-J. Pollen distribution in hemipelagic surface sediments of the South China Sea and its relation to modern vegetation distribution [J]. Mar Geol, 1999,156(1–4): 211–226.
[25] Chen Jianfang, Li Yan, Yin Kedong, Jin Hai-yan. Amino acids in the Pearl River Estuary and adjacent waters: origins,transformation and degradation [J]. Cont Shelf Res, 2004,24(16): 1877–1894.
[26] Dauwe B, Middelburg J J, Herman P M J, Heip C H R.Linking diagenetic alteration of amino acids and bulk organic matter reactivity [J]. Limnol Oceanogr, 1999, 44(7):1809–1814.
[27] Jørgensen N O G, Stepanaukas R, Pedersen A G U, Hansen M,Nybroe O. Occurrence and degradation of peptidoglycan in aquatic environments [J]. FEMS Microbiol Ecol, 2003, 46(3):269–280.
[28] Jennerjahn T, Ittekkot V. Organic matter in sediments in the mangrove areas and adjacent continental margins of Brazil: I.Amino acids and hexosamines [J]. Oceanol Acta, 1997, 20(2):359–369.
[29] 王将克. 氨基酸生物地球化学[M]. 北京: 科学出版社:1991: 308p.Wang Jiang-ke. Amino Acid Biogeochemistry [M]. Beijing:Science Press, 1991: 308p (in Chinese).
[30] Opsahl S, Benner R. Early diagenesis of vascular plant tissues:Lignin and cutin decomposition and biogeochemical implications[J]. Geochim Cosmochim Acta, 1995, 59(23): 4889–4904.
[31] Houel S, Louchouarn P, Lucotte M, Canuel R, Ghaleb B.Translocation of soil organic matter following reservoir impoundment in boreal systems: Implications for in situ productivity [J]. Limnol Oceanogr, 2006, 51(3): 1497–1513.
[32] Louchouarn P, Lucotte M, Canuel R, Gagné J-P, Richard L-F.Sources and early diagenesis of lignin and bulk organic matter in the sediments of the Lower St. Lawrence Estuary and the Saguenay Fjord [J]. Mar Chem, 1997, 58(1/2): 3–26.
[33] Tesi T, Miserocchi S, Goñi M A, Langone L. Source, transport and fate of terrestrial organic carbon on the western Mediterranean Sea, Gulf of Lions, France [J]. Mar Chem,2007, 105(1): 101–117.
[34] Wei Xiuguo, Yi Weixi, Shen Chengde, Yechieli Y, Li Ningli,Ding Ping, Wang Ning, Liu Kexin.14C as a tool for evaluating riverine POC sources and erosion of the Zhujiang (Pearl River)drainage basin, South China [J]. Nucl Instrum Methods Phys Res, Sect B, 2010, 268(7): 1094–1097.
[35] Keil R G, Tsamakis E, Giddings J C, Hedges J I. Biochemical distributions (amino acids, neutral sugars, and lignin phenols)among size-classes of modern marine sediments from the Washington coast [J]. Geochim Cosmochim Acta, 1998, 62(8):1347–1364.
