钨掺杂M 型二氧化钒粉体的水解法制备与结构分析
2014-07-13杨修春周石山王胤博
杨修春,陈 超,周石山,王胤博
(1.同济大学材料科学与工程学院,上海201804;2.先进土木工程材料教育部重点实验室,上海201804)
面对日见匮乏的自然资源,从可持续发展战略出发,开发新能源与节约能源并重是人类面对的共同课题。当前中国建筑能耗占社会总能耗的27%左右,建筑能耗中,玻璃门窗的能耗占到全部建筑能耗的40%~50%,窗户的节能是建筑节能中需要重点解决的问题[1--2]。文献[2]研究表明,太阳辐射的主要能量集中在200~2 000nm 波长之间,其中:紫外光区(290~380nm)能量占7%左右;可见光区段(380~760nm)能量占46%;近红外光辐射(760~2 500nm)能量占44%;远红外光区(≥2 500nm)能量占3%。因此,在夏季必须减少可见光区和近红外光区段的太阳辐射能量进入室内,以降低室内温度,而在冬季又必须尽量提高可见光区和近红外光区的太阳能辐射能量进入室内,以提高室内温度。国外在新建建筑上已普遍使用节能玻璃,中国目前也进行了一定推广;尽管如此,人们更希望能开发出一种具有智能调节能力的玻璃,它能根据环境温度、日照强度等自动调节玻璃的光学性能。
自Morin[3]发现VO2的半导体--金属相变现象以来,人们对VO2的半导体--金属相变以及与相变伴随的光学和电学性质的突变产生了浓厚兴趣。文 献[4]研 究 发 现,VO2有 多 种 晶 型,包 括VO2(A)、VO2(B)、VO2(M)和VO2(R)等,其中:VO2(M)是一种单斜结构,在68 ℃以下能稳定存在,呈半导体性,当温度高于68℃时,则转变成为四方结构VO2(R),呈金属性;VO2(B)具有单斜结构;VO2(A)具有四方结构。它们都是亚稳结构相,不具有相变特性。由于金属相VO2(R)中的自由电子导电作用急剧增强,光学特性会发生明显变化,即自由电子对光的吸收会引起光透过率,特别是红外波段的光透过率急剧降低、反射率增大,从而有效阻挡红外线的进入,避免温度继续上升。当温度下降到68 ℃以下时,半导体相的VO2(M)会自动提高对红外光的透过率。这样,VO2(M)就能够循环往复地自动调节室外太阳辐射能流,实现对室内温度的智能控制。纯VO2(M)的相变点偏高,掺入高价金属离子(如W6+、Mo6+和Nb5+等)是降低相变温度的有效方法,其中:W 掺杂的效率最高,达(22~28)℃/1%[5--7]。
目前,关于W 在VO2中的价态存在不同观点,Tang等[8]将高纯V2O5、V2O3和WO2按比例密封在石英容器中制备W 掺杂VO2粉体,W 在VO2中以W6+存在,为保持电价平衡,部分V4+变为V3+,形成W6+-V3+和V3+-V4+配位结构,这就导致单斜结构的VO2不稳定,更容易从金属态转变到半导体态,使相变温度降低。Manning等[9]利用大气压化学气相沉积,制备出W 掺杂VO2薄膜,发现W 以W4+存在。从固溶体形成的电价要求来看,W4+似乎更合理,但W 掺杂量对VO2晶体局部结构有何影响,目前仍不清楚,有必要进一步深入研究。
在前期采用水解法制备纯VO2(M)粉末基础 上[10],以VOSO4和NH4HCO3为 原 料,在 反应体系中加入不同量的Na2WO4,采用水解法制备出不同掺杂量VO2(M)粉末,同时结合多种表征手段分析W 掺杂对VO2粉末结构和相变温度的影响。
1 实验
1.1 样品制备
将4.89g 的VOSO4和4.74g 的NH4HCO3分别溶解于300mL 的H2O 中,配成0.1mol/L 和0.2mol/L的溶液。将一定质量的Na2WO4·2H2O充分溶解于VOSO4溶液中,W 掺杂量分别为1.0%(摩尔分数)、1.5%、2.0%和2.5%。然后将NH4HCO3溶液置于酸式滴定管中,缓慢滴入盛有钨掺杂的VOSO4溶液中。沉淀物经过滤、去离子水洗涤2次、无水乙醇洗涤1次后,在真空干燥箱中于60℃干燥3h,得到褐色的氢氧化钒前驱体。将前驱体置于石英舟中,放入内径为3.75cm 的石英管内,通入纯度为99.99%(体积分数)的氩气作为保护气体,在500℃煅烧3h,得到不同钨掺杂量的黑色VO2(M)粉体。
1.2 样品表征
用D/max2550VB3+/PC 型X 射线衍射仪分析样品的物相组成,Cu靶,Kα射线(0.154 06nm),测量角度为10°~90°。用EQUINOXSS/HYPERION 2000型Fourier变换红外光谱仪测量样品的红外光谱。用Pyris 1型差示扫描量热仪测量样品的相变温度,测量温度范围为0~90℃,升温速率为3℃/min。用Axis Ultra DLD 型多功能电子能谱仪测量样品的XPS谱,测试光源为Al Kα射线,测试功率为300W,测试电压为15kV,分析面积为0.8 mm2,真空度为10--6Pa,采用C1s=284.6eV 对样品的荷电效应进行校准。借助于XAFS 实验站测量样品的X 射线吸收精细结构谱,存储环电子能量为0.8GeV,最大电流强度约为100mA。
2 结果与讨论
图1为不同W 掺杂量VO2粉体的X 射线衍射(XRD)谱。由图1 可知,样品结晶性较好,衍射峰与标准衍射谱(JCPDS 43—1051)匹配良好,表明样品为单斜结构的VO2(M),未发现含W 化合物的衍射峰,但存在VO2(B)的微弱衍射峰,对应于标准衍射卡片JCPDS 31—1481。随W 掺杂量增多,VO2(M)的(011)晶面衍射角变小,与Peng等[11]的研究结果类似。这是因为W 原子的半径(0.202nm)比V 原子的半径(0.192nm)大,W 原子替换晶格中V原子位置后,大半径原子的引入使晶格膨胀,从而导致衍射角变小。
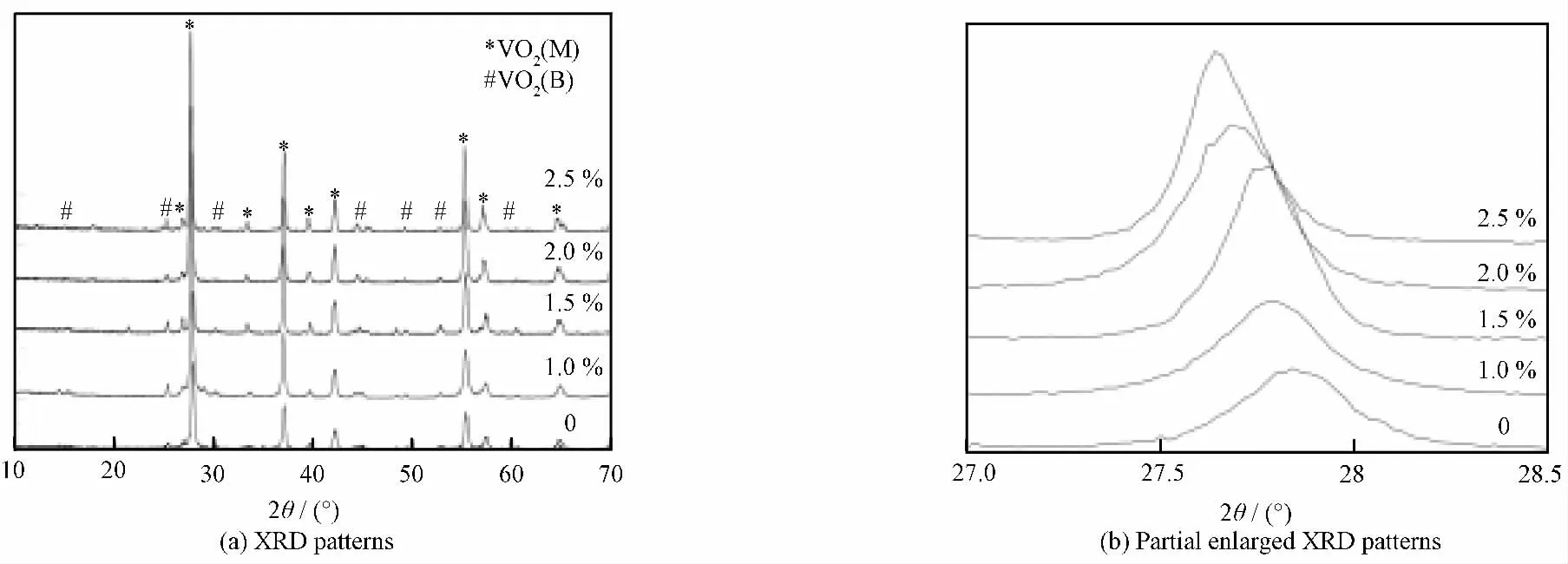
图1 不同W 掺杂量VO2 粉体的XRD 谱Fig.1 XRD patterns of W doped VO2powders with different W contents(mole fraction)
图2 为不同W 掺杂量VO2粉体的红外吸收谱。对于四方结构VO2(R),其结构单元[VO6]属于高对称Oh群,只有振动模式ν3(F1u)(927.0 cm--1)和ν4(F1u)(613.0cm--1),具有红外活性,而振动模式νl(A1g)(756.0cm--1)、ν2(Eg)[466.0cm--1]、ν5(F2g)[531.0cm--1]和ν6(F2u)[437.0cm--1]是红外非活性的;而在相变温度之下的VO2(M),其[VO6]八面体发生畸变,导致所有振动模式都是红外活性的,即出现红外吸收峰。文献[11--14]研究表明:V氧化物的特征吸收峰集中在400.0~1 200.0cm--1范围内,其中:438.5、467.3和530.0cm--1处的吸收峰为V—O—V 八面体角变形引起的弯曲振动峰,随着W 的掺杂,前2个峰消失,第3个峰强度逐渐降低,表明W 的掺杂有利于提高[VO6]八面体的对称性,使振动模式F2u、Eg和F2g逐渐失去红外活性,即红外吸收峰消失或强度降低。927.9cm--1处的吸收峰是由V=O 伸缩振动引起的,W 掺杂导致该峰漂移到1 006.8cm--1处,且随W 掺杂量的提高而增强。628.0~731.0cm--1之间的宽吸收带是钒氧八面体“金红石堆积”的特征峰,属于VO2(M)的特征吸收带,该峰随W 掺杂量的增加逐渐减弱,这是因为W掺杂破坏了VO2(M)主晶格的完整性。
图3 为W 掺杂VO2粉体的X 射线光电子(XPS)能谱及其拟合曲线。对图3 的XPS峰进行Gaussian-Lorenztian拟合,出现5 个峰,结合能分别为35.0、37.1、39.8、41.2 和42.3eV。其 中:35.0和37.1eV 与文献[15--16]报道的6 价W 的4f7/2和4f5/2值一致,且其结合能差值也为2.1,面积比为0.81,接近标准值0.75,表明W 已掺入VO2晶格中,且以6价存在;39.8eV 与4价V 的3p 的文献报道值(40.0eV)一致;42.3eV 与5 价V 的3p 的文献报道值一致[17],表明VO2颗粒表面发生了 氧化;41.2eV 与6 价W 的5p3/2文 献 报 道 值 一致,进一步表明W 以6价存在[15]。
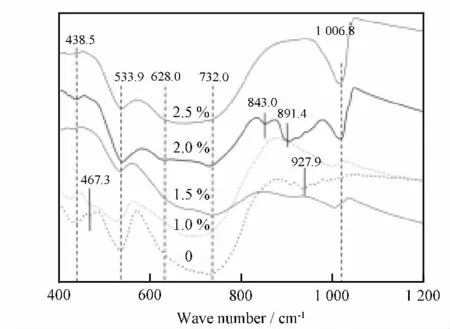
图2 不同W 掺杂量VO2 粉末的红外吸收谱Fig.2 IR spectra of W-doped VO2 powders with different W contents

图3 W 掺杂VO2 粉体的XPS谱Fig.3 XPS spectra and fits of W-doped VO2powder
图4 为不同W 掺杂量VO2粉体的DSC 曲线及W 掺杂量对相变温度的影响。由图4可见,VO2相变温度随W 掺杂量的增加线性下降,当W 掺杂量为2.5%时,相变温度降低到25.6℃,接近室温。Tang等[8]指出:V4+—V4+的同极结合使VO2呈现半导体态,W 的掺杂破坏了V4+—V4+的同极键合结构,形成新的W6+—V3+及V4+—V3+键合,W 掺杂量越高,W6+—V3+及V4+—V3+键合对越多,从而使相变温度降低。
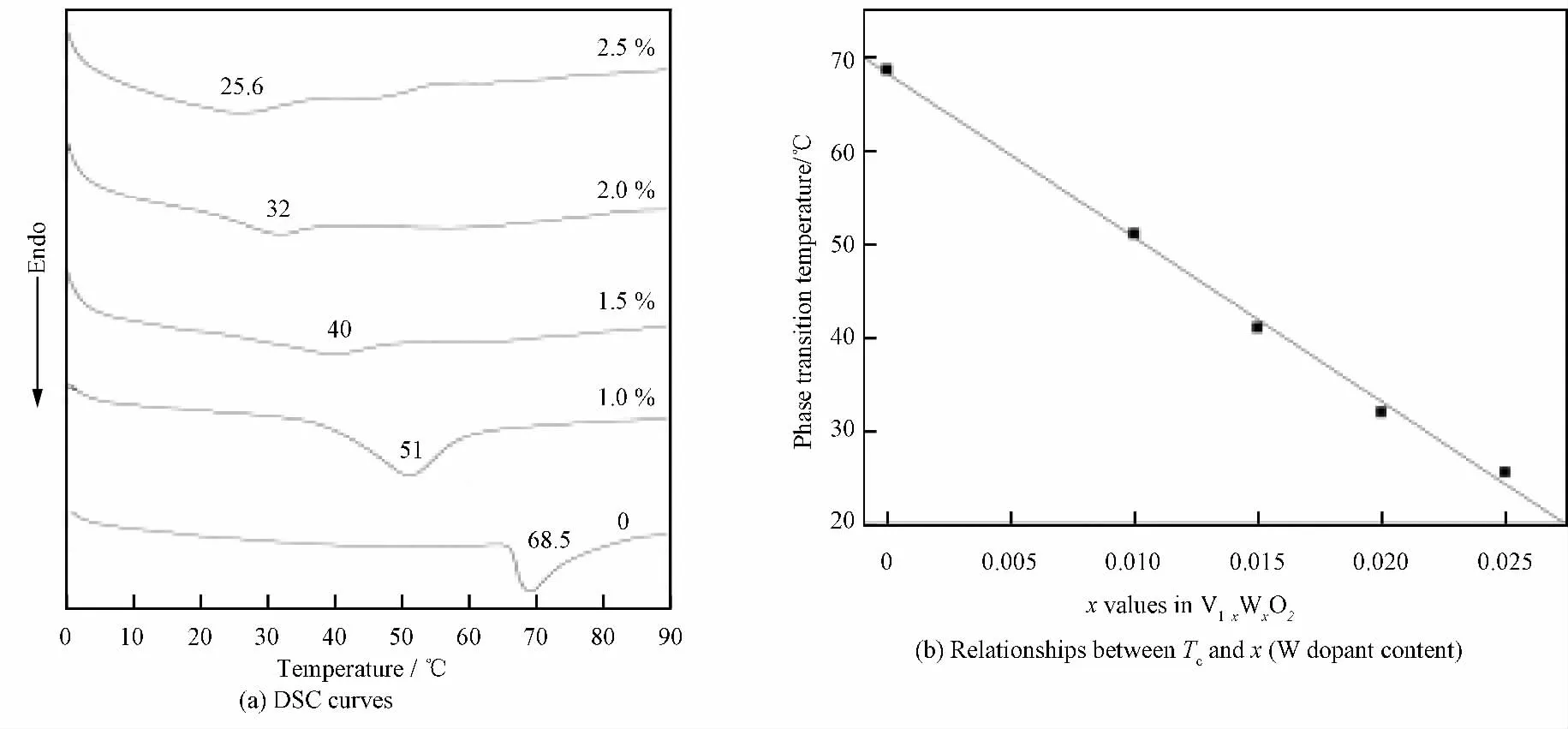
图4 不同浓度W 掺杂量VO2 的DSC曲线及W 掺杂量对相变温度的影响Fig.4 DSC curves of W-doped VO2powders with different W contents and relationships between phase transition temperature(Tc)and W dopant content xin V1-xWxO2
为分析W 掺杂对VO2晶体结构的影响,测量了W 掺杂VO2粉体的V--K边和W--L边的X射线吸收精细结构(XAFS谱)。图5 为VO2的局部结构参数[18--21]。在VO2(R)型结构中,中心钒原子与最近邻的钒原子在一条直线上,V--V 原子间的距离为0.287 nm,钒原子中的d 电子为所有金属原子所共有,因此,VO2(R)呈现金属特性。在VO2(R)型V--O 八面体中,钒原子位于八面体中心,钒原子与2号氧离子间的距离为0.192 2nm,而钒原子与1号氧原子间的距离为0.193 3nm。在VO2(M)型结构中,中心钒原子与最近邻的2个钒原子不在一条直线上,V--V 原子间距按0.265nm 和0.312nm 交替变化,每个钒原子的d电子都定域在这些V--V 键上,导致VO2(M)不再具有金属的导电性,而呈半导体特性。在VO2(M)型V--O 八面体中,钒原子偏离了原来的晶面位置,并向1号、3号和4号氧原子位置靠近,这就使得V--O 八面体发生了畸变,钒原子与6个氧原子间的相对距离都发生了明显变化(见图5d)。

图5 VO2(R)型和VO2(M)型晶体的局部结构Fig.5 Local structures of VO2(R)and VO2(M)crystals
图6 为不同W 掺杂量VO2的V--K 边XAFS谱及对应的k空间振荡谱χ(k)。由图6a可知,样品的XAFS 谱具有相似的基本特征,吸收边在5 462.3eV处,由V 原子的1s→4p 电子跃迁引起,通常称之为白线。样品都存在一个预边峰,由V 原子的1s→3d 电子跃迁引起。理论上讲,1s→3d 电子跃迁是禁止的,因此,一般不会看到预边峰;但在非中心对称结构的畸形八面体和四面体中,存在终态d-p 轨道杂化,使得d 轨道部分具有p 轨道特征,因此能够观察到预边峰。杂化程度越大,预边峰强度越高[22--23]。
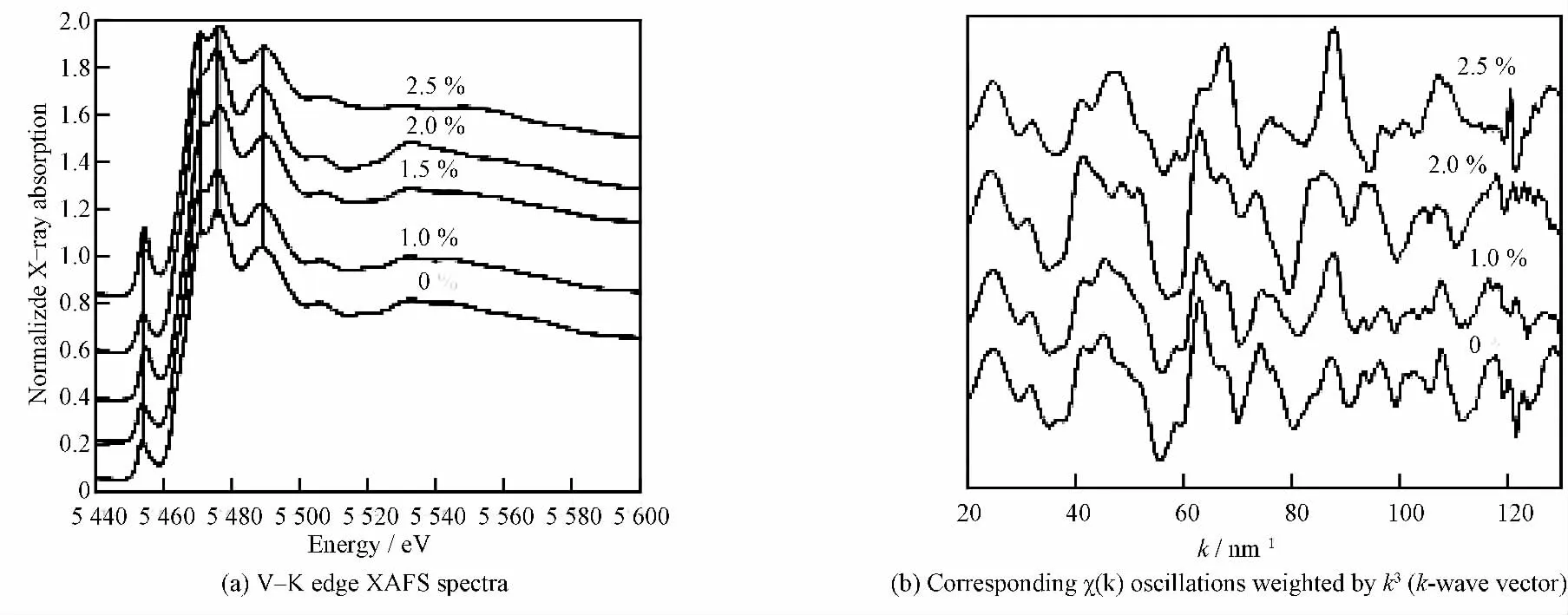
图6 W 掺杂VO2 粉体的V--K 边XAFS谱及对应的χ(k)振荡谱Fig.6 V--K edge XAFS spectra and correspondingχ(k)oscillations of W-doped VO2powders χ(k)—oscillation in kspace.
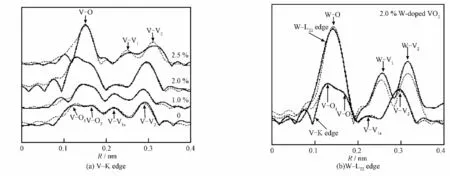
图7 W 掺杂VO2 粉体的V--K 边和W--LⅢ边χ(k)振荡谱的Fourier变换红外光谱Fig.7 Fourier transformation of V--K edge and W--LⅢedge XAFS spectra of W-doped VO2powders
图7 为W 掺杂VO2粉体的V--K 边和W--LⅢ边χ(k)振荡谱的Fourier变换红外光谱。由图7a及其拟合结果可知,没有掺杂时,V--O 峰出现分裂现象,表明V--O 存在2 种配位状态,V--O1的距离较短,V--O2的距离较长,与图5b中的M 型V--O 八面体结构类似。随W 掺杂量提高,V--O1的距离提高,V--O2的距离降低,当W 掺杂量提高到2.5%时,V--O 的2个分裂峰重叠,与图5a中的R 型V--O八面体结构类似,说明随着W 掺杂量的提高,V 周围的O 分布越来越均匀,钒氧八面体结构的对称性逐渐增大。这是因为大半径的W 原子置换了V 原子,使得晶格发生局部畸变,W--O 键长变短,所产生的压应力通过共享顶点O 沿着W--O--V 链传递到邻近的次晶格,造成远程V--O 键长变化,从而促使V 周围的氧分布对称性增大。V--V1a、V--V2配位峰与图5b中的单斜结构较为符合,V--V1b的键长与V--V2的键长接近,但其配位数远低于V--V2的配位数,因此V--V1b的振幅远低于V--V2的振幅,在图7a中表现为V--V1b的峰被V--V2的峰掩盖。对于W 掺杂量为2.5%的VO2,只出现V--V1和V--V2的配位峰,与R 型V--V 配位匹配良好,表明W 掺杂量增大至2.5%时,单斜结构中的V--V1a伸长,V--V1b缩短,两峰合并成金红石结构的V--V1峰,即样品已转变为金红石结构,这与DSC结果相符合。
图7b为2.0%W 掺杂VO2的W--LⅢ边与V--K边的径向分布图。W 的配位环境与R 型VO2中的V 配位环境类似,W--O、W--V1、W--V2峰形类似于2.5%W 掺杂VO2的V--K 边金红石结构的V--O、V--V1、V--V2峰。但 根 据DSC 曲 线 和XRD 谱 结果,W 掺杂量为2.0%的VO2结构仍属于单斜结构,并未发生相变,形成金红石结构,这是因为单斜结构中的W 原子周围形成了局部范围的金红石结构。单斜结构中,由同极键合离子对构成的V--V 链是具有一定扭转角δ 的“之”字形,当温度增大至相变温度,即δ减小至小于1.4°时发生相变,促使“之”字形变成直线形[24--25]。因此,W 掺杂形成的局部金红石结构,当W 掺杂增大到一定量时,具有直线V--V链或类似直线型V--V 链的区域覆盖至整个范围时,即所有δ角都小于1.4°时就会发生单斜结构到金红石结构的相变。
3 结论
当W 掺杂量为2.5%时,可将VO2(M)相变点降低至室温附近的25.6℃,相变温度与掺杂量在一定范围内基本成线性关系,掺杂效率约为18℃/1%W。W 原子替换了晶格中V 原子的位置,大半径原子的引进使晶格发生膨胀畸变,掺杂离子周围V--O键长变短,V--O 短键的伸缩振动加强,同时掺杂离子使VO2晶体结构受损,微观上表现为掺杂使钒氧八面体的对称性增大,掺入原子周围形成了局部金红结构,增大掺杂量会使金红石结构范围扩大,具有直线V--V 链或类似直线型V--V 链的区域覆盖至整体范围时,即发生单斜结构到金红石结构的相变。
志谢:感谢国家同步辐射实验室(合肥)XAFS实验站提供的机时和实验支持。
[1] GRAQVIST C G.Window coatings for the future[J].Thin Solid Films,1990,193/194:730-741.
[2] 杨修春,李伟捷.新型建筑玻璃[M].北京:中国电力出版社,第一版,2009,P42.
[3] MORIN F J.Oxides which show a metal-to-insulator transition at the Neel temperature[J].Phys Rev Lett,1959,3:34-36.
[4] LEROUX C,NIHOUL G,TENDELOO V G.From VO2(B)to VO2(R):Theoretical structures of VO2polymorphs and in situ electron microscopy[J].Phys Rev B,1998,57:5111-5121.
[5] JORGENSON G V,LEE J C.Doped vanadium oxide for optical switching films[J].Sol Energy Mater,1986,14:205-214.
[6] SHI J,ZHOU S,YOU B,et al.Preparation and thermochromic property of tungsten-doped vanadium dioxide particles[J].Solar Energy Mater Sol Cells,2007,91:1856-1862.
[7] PENG Z,JIANG W,LIU H.Synthesis and electrical properties of tungsten-doped vanadium dioxide nanopowders by thermolysis[J].J Phys Chem C,2007,111:1119-1122.
[8] TANG C,GEORGOPOULOS P,FINE M E,et al.Local atomic and electronic arrangements WxV1-xO2[J].Phys Rev B,1985,31(2):1000-1011.
[9] MANNING T D,PARKIN I P,PEMBLE M E,et al.Intelligent window coatings:atmospheric pressure chemical vapor deposition of tungsten-doped vanadium dioxide[J].Chem Mater,2004,16:744-749.
[10] 杨修春,王胤博,周石山,等.水解法制备M-VO2纳米粉体[J].建筑材料学报,2009,13(6)827-830.YANG Xiuchun,WANG Yinbo,ZHOU Shishan,et al.J Building Mater(in Chinese),2009,13(6):827-830.
[11] PENG Z F,WANG Y,DU Y Y,et al.Phase transition and IR properties of tungsten-doped vanadium dioxide nanopowders[J].J Alloys Compd,2009,480(2):537-540.
[12] BOTTO I T,VASSALLO M B,BARAN E J,et al.IR spectra of VO2and V2O3[J].Mater Chem Phys,1997,50:267-270.
[13] HEWSTON T A,NADLER M P.Variable-temperature infrared spectra of VO2[J].Solid State Chem.,1987,71:278-281.
[14] VALMALETTE J C,GAVARRI J R.High efficiency thermochromic VO2(R)resulting from the irreversible transformation of VO2(B)[J].Mater Sci Eng B,1998,54:168-173.
[15] WAGNER C D,NAUMKIN A V,KRAUT-VASS A,et al.NIST X-ray Photoelectron Spectroscopy Database,version 4.1(web version).USA.[2012-9-15].http://srdata.nist.gov/xps/.
[16] HO S F,CONTARINI S,RABALAIS J W.Ion-beam-induced chemical changes in the oxyanions(MOn-y)and oxides(MOx)where M=Cr,Mo,W,V,Nb,and Ta[J].J Phys Chem,1987,91:4779-4788.
[17] SAWATZKY G A,POST D.X-ray photoelectron and Auger spectroscopy study of some vanadium oxides[J].Phys Rev B,1979,20(4):1546-1555.
[18] ZYLBERSZTEJN A,MOTT N F.Metal-insulator transition in vanadium dioxide[J].Phys Rev B,1975,11:4383-4395.
[19] XIONG X M,CHEN L,ZHANG L L,et al.New phase transition associated with configuration of oxygen vacancies in VO1.965nanometer ceramics[J].Appl Phys Lett,2006,88:32906-3.
[20] QU B Y,HE H Y,PAN B C.The dynamical process of the phase transition from VO2(M)to VO2(R)[J].J Appl Phys,2011,110:113517-4.
[21] GOODENOUGH J B.The two components of the crystallographic transition in VO2[J].Solid State Chem,1971,3:490-500.
[22] 杨修春,刘维学,DUBIEL M,等.X 射线吸收精细结构谱在材料科学中的应用[J].功能材料,2005,36(8):1146-1150.YANG Xiuchun,LIU Weixue,DUBIEL M,et al.J Funct Mater(in Chinese),2005,36(8):1146-1150.
[23] 赵建富,杨修春,黄敏,等.硅酸盐玻璃中银铜双金属纳米颗粒的精细结构[J].硅酸盐学报,2012,40(2):312-316.ZHAO Jianfu,YANG Xiuchun,HUANG Ming,et al.J Chin Ceram Soc.2012,40(2):312-316.
[24] YAO T,ZHANG X D,SUN Z H,et al.Understanding the nature of the kinetic process in a VO2metal-insulator transition[J].Phys Rev Lett,2010,105(22):226405(1-4).
[25] BIERMANN S,POTERYAEV A,LICHTENSTEIN A I,et al.Dynamical singlets and correlation-assisted Peierls transition in VO2[J].Phys Rev Lett,2005,94(2):26404-26408.