体外心肌细胞缺血后适应模型的建立及评价
2014-07-13李晓梅包馨慧杨毅宁马依彤陈邦党李海霞
李晓梅, 包馨慧, 杨毅宁, 马依彤, 陈邦党, 刘 芬, 李海霞
(新疆医科大学第一附属医院心脏中心, 乌鲁木齐 830054)
2003年Zhao等[1]首次提出缺血后适应(Ischemia postconditioning,IPost)概念,它是一种在再灌注早期,通过快速、反复、短暂中断冠脉血流后,再完全恢复心肌灌注,而起到明显减少心肌梗死范围、抗再灌注心律失常及抗心肌细胞凋亡等减轻再灌注损伤、保护心肌的有效可行的方法[2-3]。目前多项研究显示IPost是减轻急性心肌梗死再灌注损伤可行和最为有效的治疗措施,有着极大的临床应用价值,已成为目前的研究热点[4]。缺血再灌注损伤目前大部分在器官及整体动物水平如离体心脏灌流、活体动物模型上等进行,尤其是国内,尚未见在细胞水平上建立缺血后适应模型进行相关的实验研究报道。本研究进行体外培养新生SD乳鼠心肌细胞,拟在细胞水平建立心肌细胞缺血后适应模型,评价心肌细胞缺血后适应模型对心肌细胞再灌注损伤的影响,为缺血性心脏病的研究及治疗提供基础。
1 材料与方法
1.1实验动物、试剂与仪器选取出生1~3 d的SD乳鼠20只,雌雄不限(由新疆医科大学实验动物中心提供)。DMEM培养基(GIBCO),小牛血清(GIBCO),胰酶(GIBCO),Ⅱ型胶原酶(GIBCO),Brdu-5(Sigma),Hochest33342试剂盒(Sigma),Bcl-2及Bax抗体(Santa,美国)。
1.2心肌细胞培养取SD大鼠心脏,Hanks液中清洗3~4次,去心包膜及心房,将心室肌切碎,加入用D-Hanks配置的0.05%胰酶和0.08%胶原酶 Ⅱ 的混合溶液水浴震荡消化,每次10 min,共8次,每次吸取上清,吹打分散细胞,经滤网过滤后1 000 r/min离心5 min后用培养液重悬,差速贴壁90 min,加入Brdu后将细胞密度调整至(5~6)×105cells/L接种于培养皿中,于5%的CO2、高湿度的培养箱孵育后,24 h后观察细胞存活率,培养48 h后,换无血清培养基培养。
1.3体外心肌细胞缺血后适应模型的建立取原代培养第4 天的细胞进行实验研究。实验分正常对照组(SH组)、缺血再灌注组(I/R组)及缺血后适应组(IPost组)3组。将培养成功的心肌细胞置于密闭的管型瓶中,用含5%CO2及95%氩气的混合气体置换瓶内气体并持续30 min,造成心肌细胞缺氧;缺血再灌注组随后持续给予富氧的气体于瓶内孵育细胞24 h,造成心肌细胞的再氧和。缺血后适应组在再氧和之前给予缺氧1 min+再氧合1 min,共3个循环的处理。正常对照组一直于37℃、5%CO2孵箱中培养。
1.4细胞凋亡率的检测(1)Hoechst33342染色检测凋亡:将各组心肌细胞用烟酸己可碱(Hoechst33342)及碘化丙啶(PI)混合溶液染色后在荧光倒置显微镜下观察并测定细胞凋亡率。 (2) 流式细胞仪检测细胞凋亡率:收集各组细胞,70%乙醇固定,4℃过夜。加PI染液,避光37℃孵育30 min。用流式细胞仪采集数据,结果用百分比表示。
1.5RT-PCR方法检测心肌细胞Bcl-2、BaxmRNA的表达提取的总RNA经核酸分析仪测定纯度和浓度后,按RT-PCR试剂盒说明书操作,以各自引物扩增。反应条件: 94℃5 min, 94℃30 s; 55.6℃30 s, 72℃30 s, 35个循环后,72℃进一步延伸7 min。引物设计依据文献[4]中的小鼠心肌组织中cDNA序列,由上海生工生物工程技术服务有限公司合成。取5 μL PCR产物,于2%琼脂糖凝胶电泳后经凝胶成像系统分析,计算各目的基因mRNA与β-actin m RNA的灰度比值。
1.6Western印迹检测心肌细胞Bcl-2、Bax蛋白的表达收集细胞,RIPA裂解液冰上裂解细胞30 min,测定蛋白浓度,按50μg/mL蛋白含量配制上样蛋白样品。室温下SDS-PAGE电泳,4℃过夜电转到聚偏二氟乙烯膜上,8%脱脂奶粉的封闭液中封闭37℃ 1 h,常规洗膜封闭,孵育相应一抗(一抗以1∶2 000稀释,GAPDH抗体以1∶3 000稀释)和二抗(1∶2 000稀释),反复洗膜后,碱性磷酸酶试剂显色。根据颜色变化及时终止显色反应。用Quality图像分析系统对免疫印迹结果进行定量分析,目的蛋白表达量以其与内参照磷酸甘油醛脱氢酶(GAPDH)条带的灰度比值表示。

2 结果
2.1心肌细胞培养结果倒置相差显微镜下,可见刚分离的心肌细胞,呈圆形,悬浮于培养液中。2 h后细胞开始贴壁生长,逐渐伸展为圆形、梭形、棒状、星状、三角形、多边形等形态, 12 h细胞基本贴壁,少数贴壁的单个细胞出现自发性搏动,搏动频率较慢,有的每分钟仅数次。24 h后95%的细胞均有搏动,培养第3 天可形成放射状排列的细胞簇,逐渐形成细胞簇或细胞单层,可见岛屿样搏动,呈同步性,形成功能性合体细胞,搏动频率80~150次/min(图1)。
2.1.1 细胞存活率 锥虫蓝染色计数200个细胞,10个染色阳性,细胞存活率为95%。
2.1.2 心肌细胞纯度 cTnT标记心肌肌钙蛋白T。心肌细胞肌钙蛋白T表达阳性,呈红色,位于胞浆; 非心肌细胞中阴性,镜下任选10个视野,计数200个细胞,阳性细胞的比率为92%(图2)。
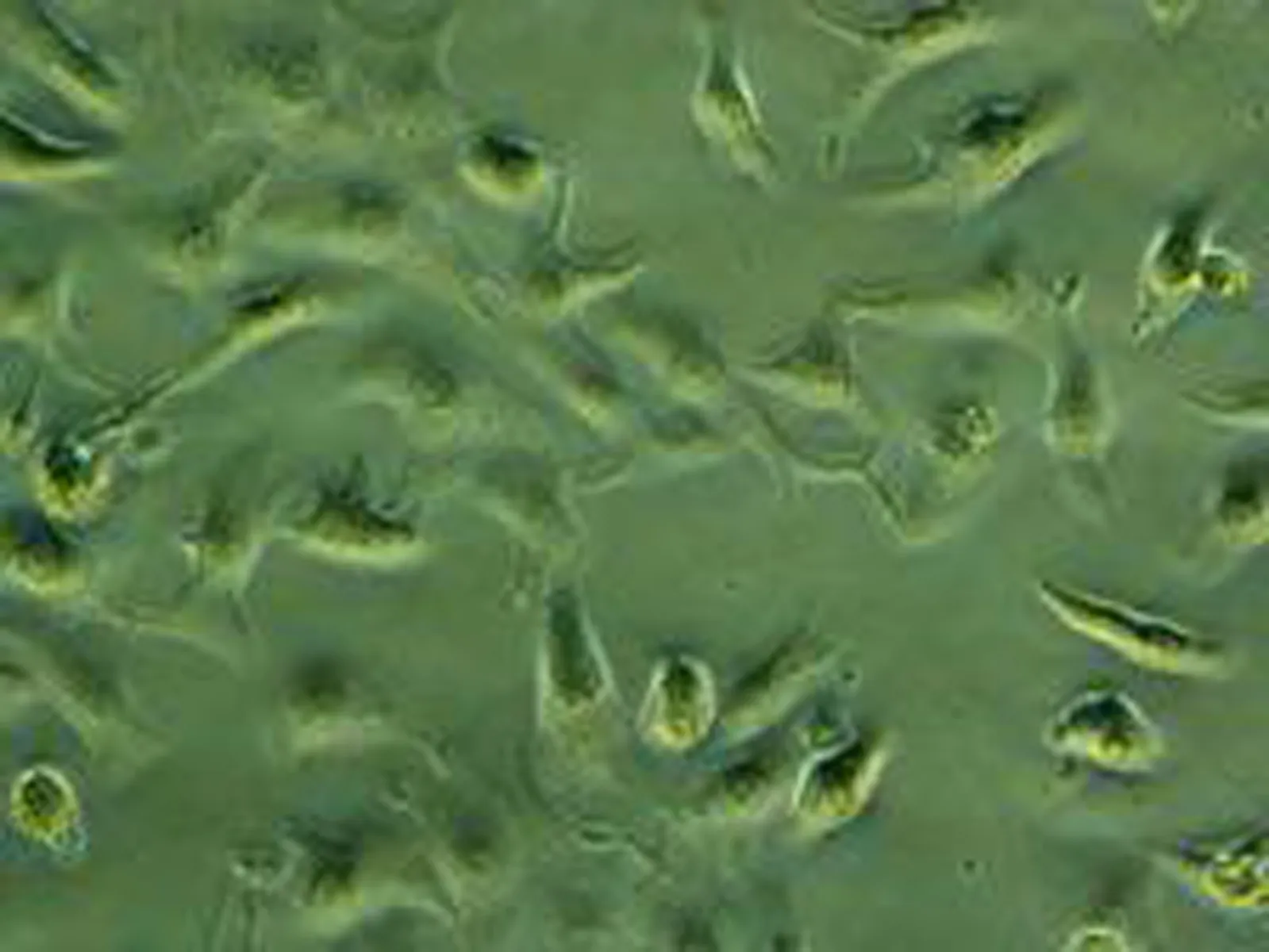
图1 倒置相差显微镜观察心肌细胞分离培养48 h照片(×200)
2.2心肌细胞凋亡率Hoechst33258荧光染色检测结果显示,SH组心肌细胞凋亡率为7%,I/R组为40%,IPost组为15%(图3)。流式细胞技术检测结果显示, I/R组心室肌细胞凋亡率为(28.3±2.1)%,较SH组的(6.2±1.0)%显著增大(P<0.05);IPost组心室肌细胞凋亡率为(17.1±2.4)%,虽较SH组增大,但明显小于I/R组(P<0.05)(图4) 。
2.3心肌细胞Bcl-2、BaxmRNA的表达RT-PCR结果分析显示,SH组与I/R组、IPost组均表达Bcl-2、Bax蛋白,与SH组(0.10±0.010)相比,I/R组(0.34±0.012)与IPost组(0.67±0.019)Bcl-2蛋白表达明显升高;I/R组Bax(0.57±0.017)较IPost 组(0.43±0.031)mRNA表达明显上调;IPost组Bcl-2/Bax(1.57±0.014)较I/R组(0.62±0.100)明显升高(图5,表1)。
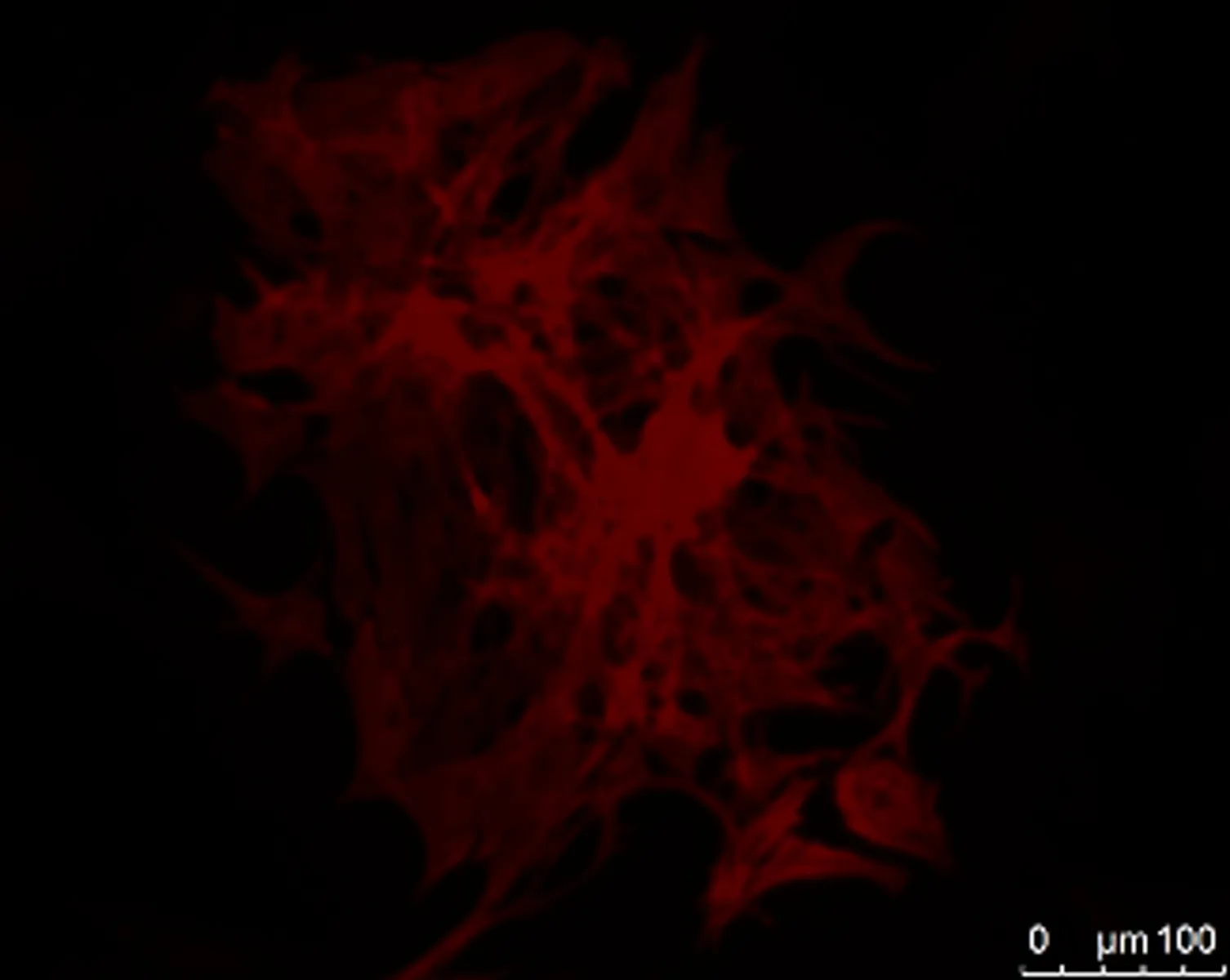
cTnT DAPI Merge

SH组 I/R组 IPost组
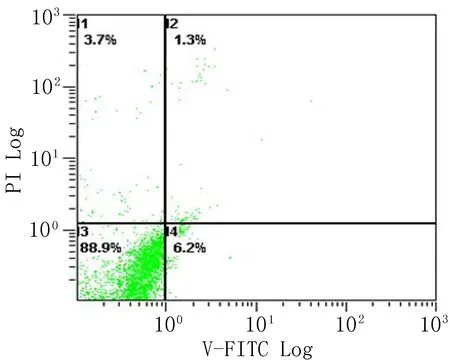
SH组 I/R组 IPost组
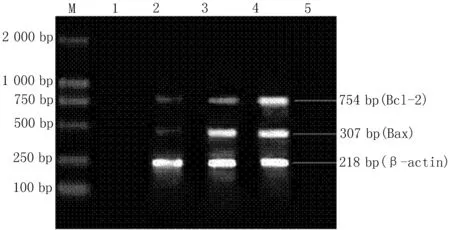
M :DNA标记物;1和5:阴性对照组: 2:SH组;3:I/R组;4:IPost组
2.4心肌细胞Bcl-2、Bax蛋白的表达Western-blot结果分析显示,SH组与I/R组、IPost组均表达Bcl-2、Bax蛋白,与SH组(1.23±1.01)相比,I/R组(3.65±1.23)与IPost组(4.01±0.73)Bcl-2蛋白表达明显升高;I/R组Bax(3.10±1.27)较IPost 组(2.14±1.01)mRNA表达明显上调;IPost组Bcl-2/Bax(2.01±1.21)较I/R组(1.21±1.01)明显升高(图6,表1)。
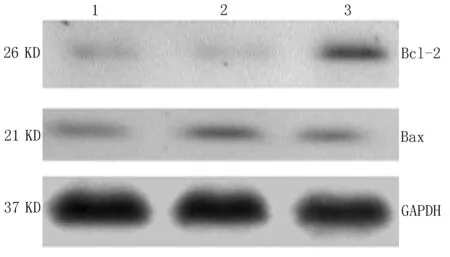
1: SH组; 2: I/R组; 3:IPost组
表1 各组心肌细胞Bcl-2和Bax的表达
注: 与SH组比较,*P<0.05; 与I/R组比较,#P<0.05。
3 讨论
再灌注治疗是急性心肌梗死最为有效的治疗手段,及时有效的再灌注治疗是减少梗死面积、改善患者预后的关键。然而,大量的基础和临床研究证实,再灌注治疗在挽救存活心肌细胞的同时,会造成致死性缺血再灌注损伤,抵消急性血运重建带来的益处,直接影响患者的预后[5]。寻求一种有效可行的方法减轻心肌缺血再灌注损伤,最大限度保护缺血心肌和限制心肌梗死范围,是国内外学者探索的目标。
离体培养的心肌细胞在结构和功能上保存了体内心肌的一些特点,同时又摆脱了体内各种限制因素对心肌细胞的影响。因此建立细胞水平的缺血后适应模型将有助于更方便地进行缺血再灌注损伤以及缺血后适应相关保护机制的研究。此外,与成年心肌细胞相比,新生大鼠心肌细胞分离操作简便,成活率高,存活时间长,应用范围广泛。建立体外心肌细胞缺血后适应模型对于从细胞水平研究心肌缺血性疾病发病机制及治疗具有重大意义。
许多实验已经证实,心肌缺血/再灌注可诱导心肌细胞凋亡,是缺血再灌注组织损伤功能丧失的重要原因。线粒体途径是细胞凋亡的重要途径,很多细胞因子能引起线粒体的损伤,其中Bcl-2/Bax能对线粒体产生重要影响[6]。Bcl-2基因家族是目前较为公认与凋亡密切相关的基因。研究表明, Bcl-2/Bax比例是决定细胞对凋亡刺激信号敏感的重要因素[7-8]。当Bcl-2过量时,细胞免遭凋亡,反之,细胞易于在诱导剂的作用下发生凋亡具有正向调节作用。Engler等[9]首先报道了细胞凋亡Bcl-2与心肌缺血再灌注损害有关, 相继的研究提示在心肌,Bcl-2作为保护因子抑制含坏死及凋亡的细胞死亡,从而发挥提高对缺血耐受性的作用。
本实验所培养的心肌细胞纯度>90%且活性较好,为研究建立心肌细胞缺血后适应模型奠定了基础。之前对于心肌缺血后适应的研究多是在器官水平(离体心脏)进行,并已证实缺血后适应能降低心脏的坏死面积,并且能抗心律失常,发挥抗缺血再灌注损伤的作用[3]。本实验用心肌细胞建立缺血后适应模型,在细胞水平进一步证实缺血后适应对心肌细胞具有保护作用,并且探讨其可能机制是通过抗心肌细胞凋亡来实现。本实验结果表明与缺血再灌注相比,缺血后适应能显著降低体外心肌细胞的凋亡率,减少心肌细胞的缺血再灌注损伤;在此过程中Bcl-2的表达增加,而Bax的表达降低,Bcl-2/Bax的比值明显增加。此结果提示缺血后适应对心肌细胞的保护机制可能是通过上调Bcl-2的表达、下调Bax的表达实现的。
综上所述,本研究通过用离体心肌细胞建立缺血后适应模型,从细胞水平证实了后适应能有效降低心肌细胞在缺血再灌注中的凋亡,提高心肌细胞的存活率,并阐明了其机制可能是通过上调Bcl-2和抑制Bax的表达来实现的。至于缺血后适应是通过何种途径引起Bcl-2表达的上调及Bax表达下降有待进一步研究。
参考文献:
[1] Zhao ZQ, Cervera JS, H alkosME, et al. Inhibition of myocardial injury by ischemic postconditioning during reperfusion:companson with ischemic preconditioning[J]. Am J Physiol Heart Circ Physiol ,2003, 285(2):H579-H588.
[2] Galagudza M, Kurapeev D, Minasiana S, et al. Ischemic postconditioning:brief ischemia during reperfusion converts persistent ventricular fibrillation in to regular rhythm[J]. Eur J Cardiothorac Surg, 2004,25(6):1006-1010.
[3] Patrick S, Gilles R, Christophe P, et al. Postconditioning the human heart[J]. Circulation, 2005, 112:2077-2078.
[4] Park ES, Kang DH, Yang MK, et al.Cordycepin,3′Deoxyadenosine, prevents rat hearts from ischemia/reperfusion injury via activation of Akt/GSK-3β/p70S6K signaling pathway and HO-1 expression[J].Cardiovasc Toxicol,2013,1[Epub ahead of print].
[5] 李晓梅,杨毅宁,马一彤,等. 再灌注抢救激酶在肥厚心肌缺血后适应中的作用[J].中国高血压杂志, 2011,19(3):263-268.
[6] Renault TT, Teijido O, Antonsson B, et al. Regulation of Bax mitochondrial localization by Bcl-2 and Bcl-x(L):keep your friends close but your enemies closer[J]. Int J Biochem Cell Biol, 2013,45(1):64-67.
[7] Wang C, Neff DA, Krolikowski JG, et al. The influence of B-cell lymphoma 2 protein, an antiapopto tic regulator of m -itochondrial permeability transition, on isoflurane- induced and ischemic postconditioning in rabbits[J]. Anesth Analg, 2006,102(5):1355-13601.
[8] Thomas RL, Gustafsson AB. Mitochondrial autophagy-an essential quality control mechanism for myocardial homeostasis[J]. Circ J,2013,77(10):2449-2454.
[9] Engler RL.Free radical and granulocyte-mediated injury during myocardial ischemia and reperfusion[J].Am J Cardiol,1989,63(10):19E-23E.
