褪黑素的生物学作用研究进展
2014-07-12董孝国董孝芝
董孝国,董孝芝
(商丘师范学院生命科学学院,河南商丘476000)
褪黑素(melatonin)又名美拉酮宁、抑黑素、松果腺素,化学名称为N-乙酰基-5-甲氧基色胺,分子式为C13H16N2O2,相对分子量为232.27,熔点116~118℃,纯品为淡黄色叶片状结构,化学结构式如图1所示[1].1958年美国耶鲁大学的皮肤病专家Aaron Lerner等首次从牛松果体中分离得到该物质,并证明了其生物活性[2].这种激素能够使一种产生黑色素(melanin)的细胞颜色变浅,故取其前缀mela;同时它是由5-羟基色胺(serotonin)生成,故取其后缀tonin,因此这种松果体激素被命名为褪黑素(melatonin).褪黑素在生物体中的含量水平随每天的时间变化而变化.
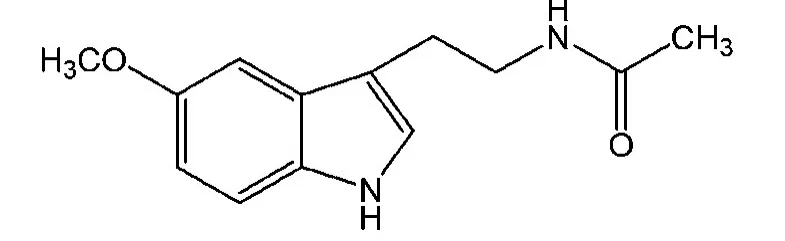
图1 褪黑素的化学结构式Figure 1 Chemical structure of melatonin
1 褪黑素的生物合成和代谢途径
褪黑素主要由哺乳动物的松果体分泌,人的松果体是附着于中脑背侧四叠体上方的、豆粒大小的组织[3].除松果体以外,哺乳动物的视网膜、泪腺、皮肤也能产生少量的褪黑素[4-6].此外,某些变温动物(青蛙)的眼睛、脑部和皮肤,以及某些藻类也能合成褪黑素[7,8].
褪黑素的生物合成路径如图2所示.褪黑素能够以色氨酸为原料,经过羟基化、脱羧、N-乙酰化和氧甲基化途径最终合成,也可由5-甲氧基色胺经N-乙酰化途径而合成[9].褪黑素的生物合成受光周期的制约,呈昼夜和季节性的节律变化[10-12].夜间褪黑素的分泌量是白天的5~10倍,通常凌晨2∶00时左右,褪黑素的生物分泌量达到高峰,此时松果体中褪黑素的含量最高,而后分泌量减少,至中午最低;人体在3岁时褪黑素的分泌量达到高峰,青春期时分泌量略有下降,以后随年龄增长而逐渐下降[1,13,14].此外,褪黑素可由胎盘进入胎儿体内,也可经母乳进入新生儿体内[15].
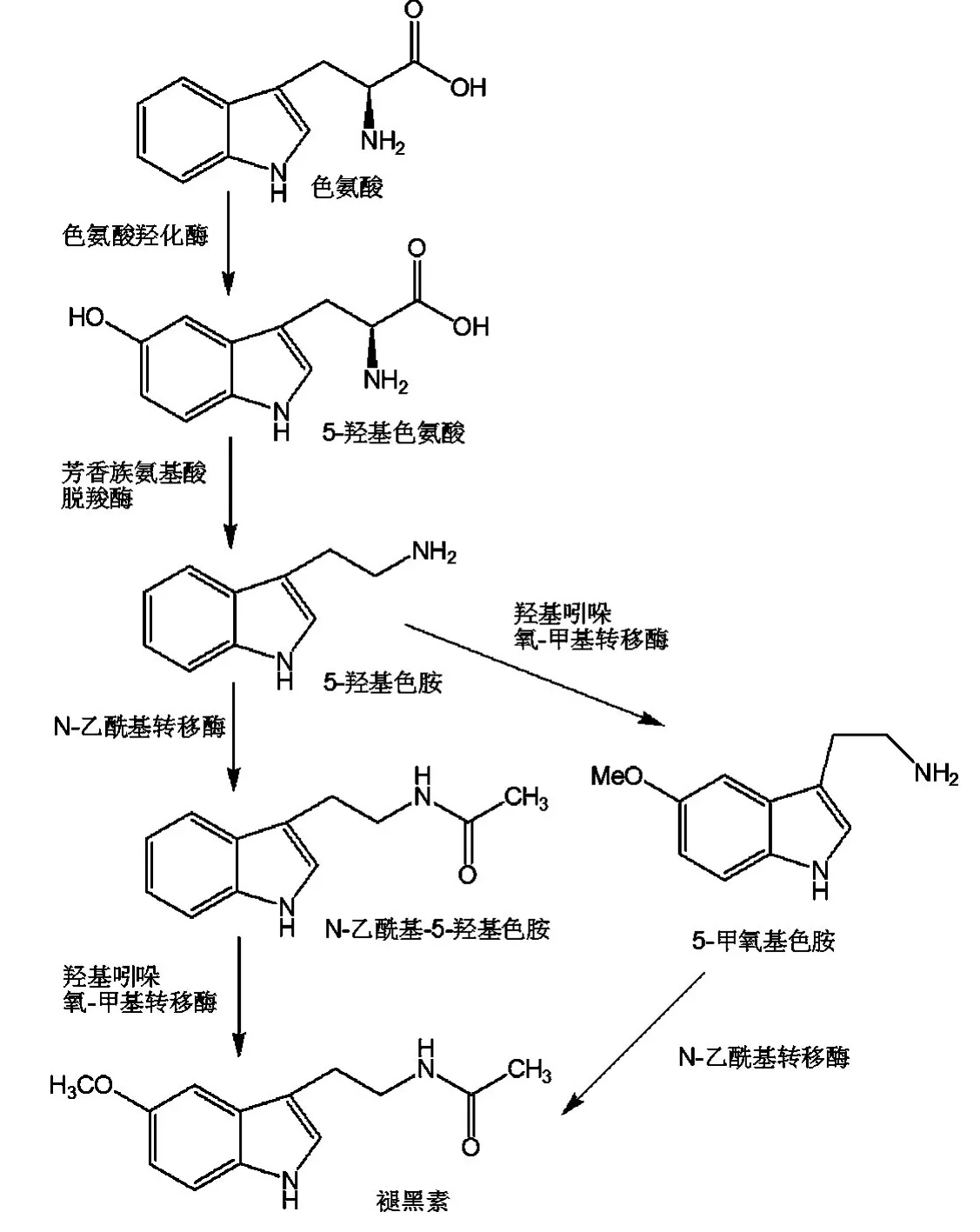
图2 褪黑素的生物合成路径[9,16]Figure 2 Biological synthesis pathways of melatonin
褪黑素的降解主要发生在肝脏中,其途径如图3所示.经典的褪黑素降解途径为褪黑素(I)在肝脏中经CYP1A1、CYP1A2或CYP1B1(a)的6-羟基化产生6-羟基褪黑素(II),最终通过尿液排出.褪黑素在脱乙酰基酶(b)的作用下生成5-甲氧基色胺(III),经单胺氧化酶(c)氧化生成5-甲氧基吲哚乙醛(IV),再通过醛脱氢酶(d)被转化为5-甲氧基吲哚乙酸(V)或经醇脱氢酶(e)生成5-甲氧基色醇(VI).在kynuric途径中,褪黑素可被活性氧(reactive oxygen species,ROS)或UV-B转化为N1-乙酰基-N2-甲酰基-5-methoxykynuramine(AFMK)(VII),该途径中间产物包括3-羟基褪黑素(VIII)、2-羟基褪黑素(IX)、褪黑素的2-吲哚满酮(X)、3-羟基褪黑素的2-吲哚满酮(XI)和褪黑素的二氧环乙烷(XII).参与褪黑素转化为AFMK的酶或者假酶(pseudoenzymes)包括细胞色素C、辣根过氧化物酶、吲哚胺双加氧酶、过氧化物酶、oxoferryl血红蛋白或血红素.此外,通过不同的路径,过氧化氢酶、芳胺甲酰胺酶、血过氧化物酶或ROS均可以促进AFMK(VII)转化为AMK(XIII)(f).最终,褪黑素可通过CYP2C19或CYP1A2脱甲基生成N-乙酰基色胺.
2 褪黑素的生物学作用
2.1 调节睡眠作用
昼夜节律睡眠障碍(circadian rhythm sleep disorders,CRSDs)主要发生在老人、严重视力障碍、轮班工人,以及经常需要倒时差的人群中.此外,各种形式的失眠也影响着人们生活质量.CRSDs和某些形式的失眠具有一个共同特点,即具有对松果体分泌的褪黑素的敏感性.褪黑素能够调节位于下丘脑视交叉上核(suprachiasmatic nucleus,SCN)的生物钟,具有调节睡眠的作用[17].一些以人为受试体的研究发现,褪黑素能够诱导镇静、降低体温、使胃肠道平滑肌放松,以及诱导其与睡眠有关的变化[18,19].母乳中的褪黑素能够起到改善婴儿睡眠和减少婴儿绞痛的作用[15].Wright等[20]将10 mg的褪黑素和安慰剂分别每天给患自闭症谱系障碍(autism spectrum disorders,ASD)症的受试儿童连续服用3个月,结果发现褪黑素比安慰剂更能改善儿童的睡眠潜伏期(平均47 min)和总睡眠时间(平均52 min).然而,Gehrman等[21]以老年痴呆症患者为受试者的实验中发现,与安慰剂相比褪黑素并未起到促进睡眠和诱导镇静的作用.
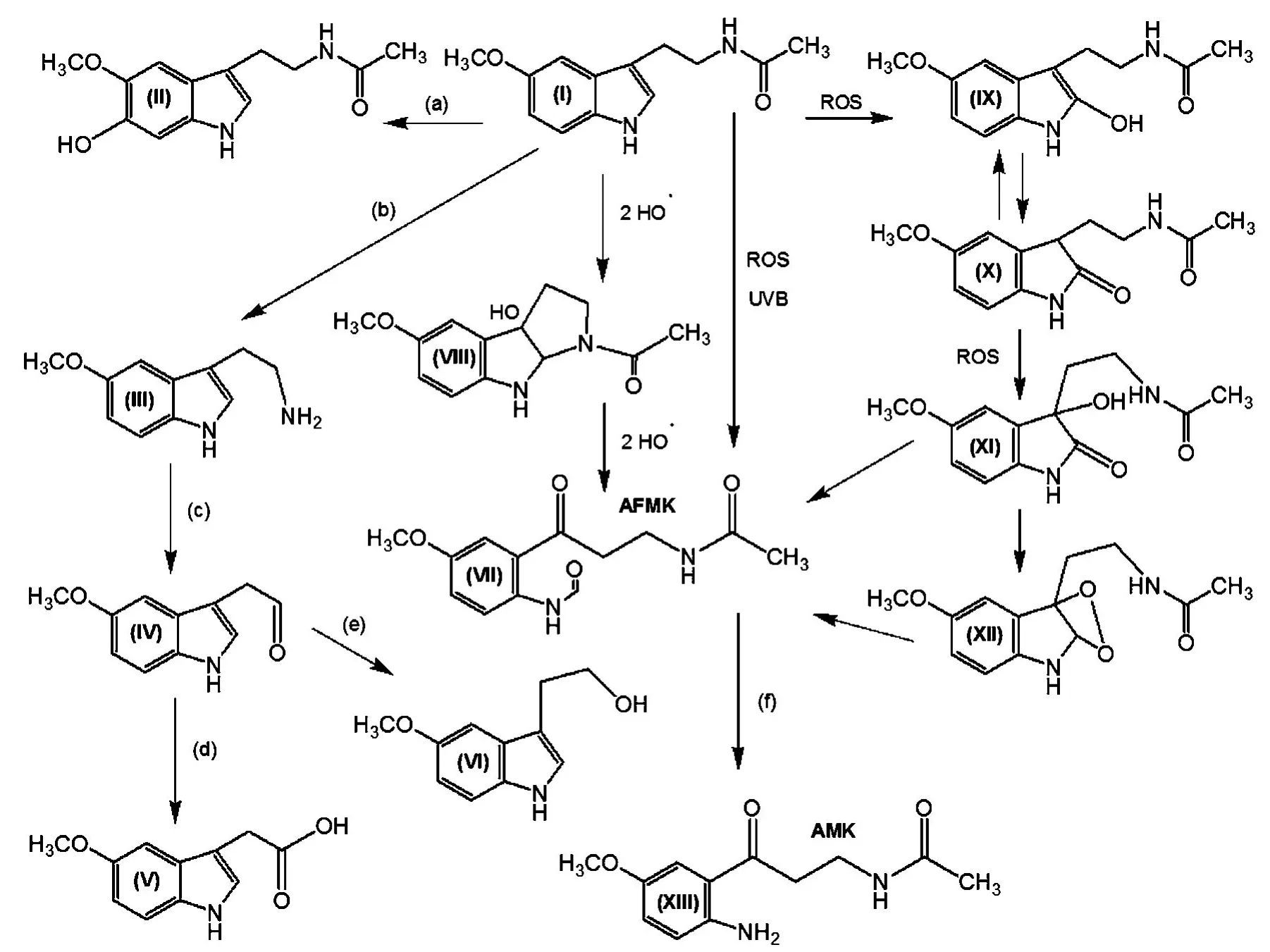
图3 褪黑素的降解路径[6]Figure 3 Degradation pathways of melatonin
2.2 抗衰老作用
老龄化的主要特点是生理功能和代谢过程逐渐恶化.褪黑素(通常被称为自由基清除剂)是一种强氧化剂,能够保护身体免受有害物的影响,而褪黑素会随着人年龄增加而减少,因此推测褪黑素与人体的老龄化具有相关性[22].褪黑素能够清除羟基、碳酸脂、多种有机基团,以及ROS,同时也能够通过促进抗氧化酶,如超氧化物歧化酶、谷胱甘肽转移酶、谷胱甘肽还原酶等的合成来增强细胞抗氧化性;褪黑素还能够保持线粒体的动态平衡,减少自由基的合成,以及保护线粒体ATP的合成[23].褪黑素的抗氧化性能在治疗风湿性关节炎、女性不孕及老年原发性高血压患者方面已得到证明[16].
Forman等[24]每天将不同剂量的褪黑素(1 mg/kg和10 mg/kg)加入小鼠饮用水中,30 d后通过实时逆转录酶联免疫反应检测心脏中的炎症介质(肿瘤坏死因子α、白细胞介素1和10、NFkBp50和NFkBp52),细胞凋亡标记物(BAD、BAX和Bcl2),以及相关的氧化应激(血红素加氧酶1和2、内皮细胞和诱导性一氧化氮合成酶)的水平.结果显示,与青年对照组相比,在老年加速衰老易发生的小鼠(senescence-accelerated mice prone,SAMP8)体内炎症、氧化应激和凋亡标记物水平均增加,而在加速衰老抵抗小鼠(senescence-accelerated-resistant mice,SAMR1)体中这些参数变化较小,且并不随年龄增加而增加.停止喂食褪黑素后,这些参数在老年加速衰老易发生的小鼠体中明显降低.Gutierrez-Cuesta等[25]研究发现褪黑素的慢性治疗能够降低SAMP8的氧化应激和神经退行性蛋白酶/Cdk5途径,以及SAMP8大脑中的脑衰老和神经退行性疾病GSK3β和tau蛋白磷酸化标记物的磷酸化,说明褪黑素能够起到保护神经和抗衰老的效果.
2.3 调节免疫作用
褪黑素对先天性免疫和获得性免疫都具有促进作用.褪黑素可以通过多方面发挥免疫调节功能,如增加免疫器官的重量,提高外周血中淋巴细胞百分数,促进抗体形成及T、B淋巴细胞增殖反应,刺激细胞因子产生,参与复杂的神经—内分泌—免疫网络的调控[26].
周爱民等[27]通过测定小鼠腹腔吞噬细胞吞噬率考察了褪黑素对机体非特异性免疫功能的影响,发现100~200 μg/kg的褪黑素对免疫功能低下或缺陷小鼠,在特异性和非特异性功能发挥免疫增强作用,但对正常小鼠,褪黑素只能提高小鼠的特异性细胞免疫功能.朱海娟等[28]研究了新生大鼠缺氧缺血性脑损伤(hypoxic-ischemic brain damage,HIBD)时对脾脏中肿瘤坏死因子α(TNF-α)、白细胞介素6(IL-6)表达的变化及外源性褪黑素对其产生的影响,结果表明新生大鼠HIBD时,脾脏TNF-α和IL-6的表达上调,而褪黑素可以抑制TNF-α的表达而增加IL-6的表达,HIBD对脾脏褪黑素受体的表达没有影响,而外源性褪黑素对褪黑素受体mRNA的表达有下调作用.Da Cunha Pedrosa等[29]研究发现褪黑素能够通过相应TCR/CD3的复合刺激来抑制CD95配体的mRNA和蛋白的表达上调,从而保护人体和小鼠CD4+T细胞的凋亡,这种抑制作用是通过干扰活化T细胞核因子(nuclear factor of activated T cells,NFAT)的钙调素/钙调神经磷酸酶的活化来阻止NFAT转移到细胞核中.
2.4 抗肿瘤作用
褪黑素能够促进肿瘤细胞凋亡,同时保持正常细胞的生存活力,被认为是一种很有前景的抗肿瘤剂.褪黑素作为重要的生理性抗肿瘤抑制剂,其抗肿瘤作用机制主要为阻断雌激素作用通道、影响细胞分裂周期、调节生长因子的分泌和释放、干扰钙调素和微观蛋白功能、增加细胞间缝隙连接等[30].
血管是肿瘤扩散的重要媒介,当肿瘤扩散时,现有的血管供应量增加,导致缺氧癌细胞的扩散,而因子-1(hypoxia inducible factor-1,HIF-1)是重要的缺氧诱导血管调节器.Park等[31]研究发现褪黑素在人结肠癌细胞株HCT116中能够破坏HIF-1α蛋白水平,并在缺氧条件下抑制HIF-1的转录活性,导致血管内皮生长因子表达减少.因此,褪黑素可通过抑制HIF-1介导的血管形成来阻止肿瘤的产生.Kim等[32]研究发现褪黑素能够抑制小鼠体内肿瘤的生长,阻断肿瘤新生血管,并能在肿瘤发生过程中减少HIF-1α蛋白的表达.考虑到HIF-1α在大多数人类癌症中的过度表达,作者认为褪黑素可以作为一种强效的癌症治疗剂.
Gonzalez等[33]研究褪黑素对胰腺AR42J肿瘤细胞株的影响时,发现褪黑素能够引起[Ca2+]c和[Ca2+]m的瞬间变化,诱发膜电位去极化和黄素腺嘌呤二核苷酸(flavin adenine dinucleotide,FAD)氧化水平的降低.此外,该研究还发现对褪黑素响应的Ca2+依赖的caspase-3活性,说明褪黑素能够通过对线粒体及caspase-3的活性作用来降低肿瘤细胞AR42J活性.Uguz等[34]考察了在大鼠胰腺肿瘤细胞株AR42J中褪黑素对三种化疗药物:5-氟尿嘧啶、顺铂和阿霉素导致的细胞毒性和细胞凋亡的影响.结果表明,褪黑素和三种化疗药物均能够导致AR42J时间依赖的活性的降低,在48 h时细胞毒性达到最高.此外,褪黑素能够明显增强化疗药物的细胞毒性.说明褪黑素能够促进化疗诱导的AR42J鼠胰腺肿瘤细胞的毒性和凋亡.
3 结语
褪黑素具有改善睡眠、抗衰老、调节免疫、抗肿瘤等多种生物学作用,被认为是一种具有广泛应用前景的化合物.褪黑素已被美国食品和药物管理局(U.S.Food and Drug Administration,FDA)批准作为膳食补充剂使用,我国卫生部也批准褪黑素应用于保健品中.但关于褪黑素的生物学作用研究多建立在动物实验的基础上,而缺乏针对褪黑素毒副作用的临床实验.此外,褪黑素的生物学作用机理方面也亟待更为深入的研究.
[1] 何炜,李晓晔,石鑫,侯建伟,等.褪黑素的生理活性研究进展[J].医药导报,2006,25(6):556-558.
[2] 王萍,周伟.褪黑素的生物学作用及研究进展[J].国际儿科杂志,2007,34(1):69-72.
[3] Tan D -X.Melatonin and brain[J].Current neuropharmacology,2010,8(3):161.
[4] do Carmo Buonfiglio D,Peliciari-Garcia RA,do Amaral FG,Peres R,et al.Early-stage retinal melatonin synthesis impairment in streptozotocin-induced diabetic wistar rats[J].Investigative ophthalmology& visual science,2011,52(10):7416-7422.
[5] Hemadi M,Saki G,Shokri S,Ghasemi F.Follicular dynamics in neonate vitrified ovarian grafts after host treatment with melatonin[J].Folia Morphol,2011,70(1):18 -23.
[6] Slominski A,Tobin DJ,Zmijewski MA,Wortsman J,et al.Melatonin in the skin:synthesis,metabolism and functions[J].Trends in Endocrinology& Metabolism,2008,19(1):17-24.
[7] Falcon J,Migaud H,Munoz-Cueto JA,Carrillo M.Current knowledge on the melatonin system in teleost fish[J].General and comparative endocrinology,2010,165(3):469-482.
[8] Posmyk MM,Janas KM.Melatonin in plants[J].Acta Physiologiae Plantarum,2009,31(1):1-11.
[9] Fernández-Mar M,Mateos R,García-Parrilla M,Puertas B,Cantos-Villar E.Bioactive compounds in wine:Resveratrol,hydroxytyrosol and melatonin:A review[J].Food Chemistry,2012,130(4):797 -813.
[10] Moore AF,Menaker M.The effect of light on melatonin secretion in the cultured pineal glands of Anolis lizards[J].Comparative Biochemistry and Physiology-Part A:Molecular& Integrative Physiology,2011,160(2):301-308.
[11] Gooley JJ,Chamberlain K,Smith KA,Khalsa SBS,et al.Exposure to room light before bedtime suppresses melatonin onset and shortens melatonin duration in humans[J].Journal of Clinical Endocrinology& Metabolism,2011,96(3):463-472.
[12] Skulstad OF,Taylor J,Davie A,Migaud H,et al.Effects of light regime on diurnal plasma melatonin levels and vertical distribution in farmed Atlantic cod(Gadus morhua L.)[J].Aquaculture,2013,414 -415:280 -287.
[13] Reiter RJ,Tan D -X,Fuentes-Broto L.Melatonin:a multitasking molecule[J].Progress in brain research,2010,181:127-151.
[14] 杨振军,杨松鹤,陈志宏.有关褪黑素的研究进展[J].承德医学院学报,2004,21(1):74-77.
[15] Engler AC,Hadash A,Shehadeh N,Pillar G.Breastfeeding may improve nocturnal sleep and reduce infantile colic:potential role of breast milk melatonin[J].European journal of pediatrics,2012,171(4):729-732.
[16] Carpentieri A,Díaz de Barboza G,Areco V,Peralta López M,et al.New perspectives in melatonin uses [J].Pharmacological Research,2012,65(4):437-444.
[17] Turek FW,Gillette MU.Melatonin,sleep,and circadian rhythms:rationale for development of specific melatonin agonists[J].Sleep Medicine,2004,5(6):523-532.
[18] Blask DE.Melatonin,sleep disturbance and cancer risk[J].Sleep medicine reviews,2009,13(4):257-264.
[19] Elkhayat HA,Hassanein SM,Tomoum HY,Abd-Elhamid IA,et al.Melatonin and sleep-related problems in children with intractable epilepsy[J].Pediatric neurology,2010,42(4):249 -254.
[20] Wright B,Sims D,Smart S,Alwazeer A,et al.Melatonin versus placebo in children with autism spectrum conditions and severe sleep problems not amenable to behaviour management strategies:a randomised controlled crossover trial[J].Journal of autism and developmental disorders,2011,41(2):175-184.
[21] Gehrman PR,Connor DJ,Martin JL,Shochat T,et al.Melatonin fails to improve sleep or agitation in a double-blind randomized placebo- controlled trial of institutionalized patients with Alzheimer’s disease[J].The American journal of geriatric psychiatry:official journal of the American Association for Geriatric Psychiatry,2009,17(2):166-169.
[22] Bubenik G,Konturek S.Melatonin and aging:prospects for human treatment[J].Journal of Physiology and Pharmacology,2011,62(1):13-19.
[23] Pandi-Perumal SR,BaHammam AS,Brown GM,Spence DW,et al.Melatonin antioxidative defense:therapeutical implications for aging and neurodegenerative processes[J].Neurotoxicity research,2012,23(3):1 -34.
[24] Forman K,Vara E,García C,Kireev R,et al.Beneficial effects of melatonin on cardiological alterations in a murine model of accelerated aging[J].Journal of pineal research,2010,49(3):312-320.
[25] Gutierrez-Cuesta J,Tajes M,Jimenez A,Camins A,et al.Effects of melatonin in the brain of the senescence-accelerated mice-prone 8(SAMP8)model[J].Revista de neurologia,2011,52(10):618-622.
[26] 刘胜兵,王鑫泉,曹利仙,徐营.褪黑素免疫功能的研究进展[J].四川生理科学杂志,2012,34(1):30-32.
[27] 周爱民,袁育康,范桂香,王军阳,等.褪黑素的免疫调节作用[J].西安医科大学学报,2001,22(5):422-424.
[28] 朱海娟,冯星,杨祖铭.褪黑素对新生大鼠缺氧缺血性脑损伤时免疫功能的影响[J].中国妇幼保健,2011,26(5):750-753.
[29] da Cunha Pedrosa AM,Weinlich R,Mognol GP,Robbs BK,et al.Melatonin protects CD4+T cells from activation-induced cell death by blocking NFAT-mediated CD95 ligand upregulation[J].The Journal of Immunology,2010,184(7):3487-3494.
[30] 张燕,马天,苏喜改,马志乾,等.褪黑素的抗肿瘤作用机制和化疗增敏作用研究现状[J].临床合理用药杂志,2011,4(4):156-158.
[31] Park SY,Jang WJ,Yi EY,Jang JY,et al.Melatonin suppresses tumor angiogenesis by inhibiting HIF-1α stabilization under hypoxia[J].Journal of pineal research,2010,48(2):178-184.
[32] Kim KJ,Choi JS,Kang I,Kim KW,et al.Melatonin suppresses tumor progression by reducing angiogenesis stimulated by HIF-1 in a mouse tumor model[J].Journal of pineal research,2012,54(3):264-270.
[33] Gonzalez A,del Castillo-Vaquero A,Miro-Moran A,Tapia JA,et al.Melatonin reduces pancreatic tumor cell viability by altering mitochondrial physiology[J].Journal of pineal research,2011,50(3):250-260.
[34] Uguz AC,Cig B,Espino J,Bejarano I,et al.Melatonin potentiates chemotherapy - induced cytotoxicity and apoptosis in rat pancreatic tumor cells[J].Journal of pineal research,2012,53(1):91-98.
