前列地尔注射液对糖尿病大鼠心肌纤维化的防治及机制
2014-07-07林朵朵
林朵朵,张 志
辽宁医学院附属第三医院 心内科,辽宁锦州 121001
前列地尔注射液对糖尿病大鼠心肌纤维化的防治及机制
林朵朵,张 志
辽宁医学院附属第三医院 心内科,辽宁锦州 121001
目的 观察前列地尔注射液对糖尿病大鼠心肌纤维化的防治作用,探讨其可能的作用机制。方法 SD大鼠40只,随机分为4组:正常对照组(NC组)、糖尿病模型组(DM组)、前列地尔治疗组(DM + Alp组)、缬沙坦治疗组(DM + Val组)。对照组给予普通饲料喂养;其余3组高脂高糖饲料喂养,连续喂养8周后一次性尾静脉注射链脲佐菌素(streptozotocin,STZ)30 mg/kg构建糖尿病大鼠模型,各组大鼠给予相应的药物干预措施。12周后检测心功能;计算心脏指数(H/B)及左心室质量指数(left ventricular mass index,LVMI);Masson染色光镜下观察心肌间质胶原纤维沉积情况,Proplus 6.0图像分析系统测算心肌胶原容积分数(collagen volume fraction,CVF);氯胺T法测定心肌组织羟脯氨酸含量,代表心肌胶原总含量;Elisa试剂盒测定血液中血管紧张素Ⅱ(angiotensinⅡ,AngⅡ)、转化生长因子-β1(transforming growth factor-β1,TGF-β1)的浓度;Western-blotting检测心肌组织信号通路相关蛋白TGF-β1、Smad2、p-Smad2、Smad7的表达。结果 与对照组相比,模型组大鼠心功能状态差,H/B、LVMI、CVF及心肌组织羟脯氨酸含量均明显升高(P<0.01),血液中AngⅡ、TGF-β1的浓度亦显著升高(P<0.01),心肌组织内TGF-β1、Smad2、p-Smad2的表达水平显著上调,Smad7的表达量则明显下降(P<0.01);前列地尔和缬沙坦治疗组上述指标均明显改善,两组间差异无统计学意义(P>0.05)。结论 前列地尔注射液在一定程度上能够抑制糖尿病大鼠心肌纤维化的发生,机制可能与减弱心肌组织内TGF-β1/Smads信号转导通路的过度激活有关。
前列地尔注射液;糖尿病;心肌纤维化;TGF-β1/smads信号转导通路
糖尿病心肌病(diabetic cardiomyopathy,DCM)是糖尿病慢性并发症之一,是导致糖尿病患者晚期死亡的主要原因。病理学检查及实验研究表明:心肌纤维化为DCM的特征性病理改变[1]。现已证实,转化生长因子-β1(transforming growth factorβ1,TGF-β1)/Smads信号转导通路异常激活及细胞外基质(extracellular matrix,ECM)的过度沉积与糖尿病心肌纤维化关系密切[2]。如何适时有效地阻断TGF-β1/Smads通路、减轻心肌纤维化,已成为糖尿病心肌病防治研究的新热点。前列地尔注射液为前列腺素E1(prostaglandin E1,PGE1)的外源性存在形式,具备多种生物学功能,对肝、肺及肾纤维化有很好的防治作用[3]。本研究旨在建立糖尿病大鼠模型,利用大鼠体内高糖环境诱导其心肌纤维化,观察给予前列地尔注射液干预对大鼠心肌纤维化的影响,并探讨其可能的机制。
材料和方法
1 主要试剂与仪器 链脲佐菌素(streptozotocin,STZ)(美国Sigma公司);前列地尔注射液(西安力邦制药有限公司,规格:1 ml;5 μg,批号:1310283);缬沙坦片(哈尔滨三联药业有限公司,规格:80 mg,批号:131002);兔抗大鼠TGF-β1、Smad2、p-Smad2、Smad7一抗,羊抗兔IgG二抗(北京博奥森生物技术有限公司);Elisa试剂盒(北京北方生物技术研究所);Masson三色染色试剂盒(北京斯百汇生物技术有限公司);血糖测定仪(台湾翔国科技有限公司LASON DS-2,许可证号2011第00109号);大鼠呼吸机、压力换能器、Medlab八导生物信号采集处理系统、离心机、BCA蛋白浓度测定仪、电泳仪、BIO-RAL半干转模仪、显色分析仪(均由辽宁医学院药理实验室提供)。
2 实验分组与模型建立 体质量240 ~ 260 g、健康、雄性SD大鼠40只(购于辽宁长生生物技术有限公司,许可证号SCXK-辽-2010-0001),随机选取10只作为正常对照(normal control,NC)组,予以普通饲料喂养;其余30只给予高脂高糖饲料(59%普通饲料+20%蔗糖+18%炼猪油+3%蛋黄粉)连续喂养8周,禁食12 h,链脲佐菌素(用0.1%枸橼酸-枸橼酸钠缓冲液配制,pH=4.5)30 mg/kg一次性尾静脉注射,继续高脂高糖饲料喂养,分别于注射链脲佐菌素后72 h、96 h、120 h尾静脉取血测血糖(无需禁食),3次血糖均≥16.7 mmol/L即为糖尿病造模成功。NC组大鼠普通饲料喂养8周后同样禁食12 h,尾静脉注射相应体积的0.1%枸橼酸-枸橼酸钠缓冲液,72 h、96 h、120 h时同样方法测血糖。将造模成功的29只糖尿病大鼠随机分为3组:糖尿病模型(diabetic model,DM)组10只、前列地尔治疗(diabetic model + alprostadil,DM + Alp)组10只、缬沙坦治疗(diabetic model + valsartan,DM + Val)组9只。DM + Alp组给予前列地尔注射液0.4 μg/(kg·d)腹腔注射(依据前列地尔注射液临床常用剂量折算得出),NC组和DM组腹腔注射液相应体积的0.9%氯化钠注射液,1次/ d,DM + Val组给予缬沙坦(溶解于0.9%氯化钠注射液中)30 mg/(kg·d)灌胃,连续用药12周后检测各项指标。各组大鼠均继续原饲料喂养,1次/周测体质量,根据体质量调整给药剂量。1次/周测随机血糖,随机血糖<16.7 mmol/L者及时予以剔除。
3 血流动力学检测 称重,麻醉(20%乌拉坦0.5 ml/ 100 g腹腔注射),固定,行气管插管并连接大鼠呼吸机,打开胸腔,暴露心脏,将预先充有肝素的聚苯乙烯左心导管末端插至左心室,另一端通过压力换能器连接Medlab八导生物信号采集处理系统,观察左心室压力波形,待波形稳定将左心室收缩压(left ventricular systolic pressure,LVSP)、左心室舒张末期压(left ventricular end diastolic pressure,LVEDP)、等容收缩期左心室内压最大上升速率(+dp/dtmax)、等容舒张期左心室内压最大下降速率(-dp/dtmax)等数据进行保存,检测完毕后将左心导管拔出,撤去呼吸机。
4 ELISA试剂盒测定血清血管紧张素Ⅱ(angiotensinⅡ,AngⅡ)、TGF-β1的浓度 每只大鼠在行血流动力学检测后经心脏取血5 ml,离心(2 000 r/min,20 min),上清液采用ELISA试剂盒测定AngⅡ、TGF-β1的浓度。
5 计算心脏指数(H/B)、左心室质量指数(left ventricular mass index,LVMI) 经心脏取血后迅速从胸腔取出心脏,修剪,盐水冲洗,滤纸吸干,电子天平称量全心质量,沿房室交界处剪去心房部分,将余下的室间隔、左心室游离壁进行称量作为左心室质量。全心质量与体质量的比值为心脏指数(mg/g),左心室质量与体质量的比值为左心室质量指数(mg/g)。
6 Masson染色观察心肌组织形态学变化、计算心肌胶原容积分数(collagen volume fraction,CVF)心尖组织经4%甲醛溶液固定24 h,脱水,石蜡包埋,切片后行Masson染色。光镜下观察心肌组织形态学变化,Image Proplus 6.0分析图像,通过灰度调节区别胶原和非胶原成分,测算心肌组织胶原容积分数,CVF=胶原面积/总面积,每张切片均随机取4个视野测量,计算其平均值。
7 氯胺T法测定心肌羟脯氨酸及胶原总含量 取冷冻心肌组织,脱水,烘干,称重、置于6 mol/ L的盐酸溶液中酸解,NaOH溶液滴定pH至7.0,离心后取上清,依次加入氯胺T、过氯酸、二氨苯甲醛,80℃水浴箱中静置6 min,取出后冰水浴中静置30 min,UV-1206型分光光度计560 nm处比色测定。同时用1 ~ 10 μg的羟脯氨酸标准品按上述相同步骤制作标准曲线。对照标准曲线,求得羟脯氨酸含量,换算成每克心肌组织中羟脯氨酸含量,再乘以7.46即得出心肌胶原总含量。
8 Western-blotting检测心肌组织中TGF-β1、Smad2、p-Smad2、Smad7的蛋白表达 称取-80℃冷冻心肌组织50 mg,于RIPA + 1% PMSF中裂解,超声匀浆30 s,离心(12 000 r/min,20 min),取上清液,BCA法测定蛋白浓度后制成蛋白浓度相等的样品;每孔20 μl上样,90伏恒压下行SDS-聚丙烯酰胺凝胶电泳;BIO-RAL半干转膜仪转膜;1% BSA-TBST封闭1 h,一抗4℃孵育过夜,二抗室温孵育1 h;暗室内ECL显色液进行显色,于扫描仪上成像,用Scion Corporation分析软件对电泳条带进行灰度值测定,以目的条带与β-actin的灰度比值代表蛋白表达水平。
9 统计学分析 采用SPSS17.0统计软件进行数据处理,计量资料以±s表示,多组间比较采用单因素方差分析,组间比较采用LSD检验,P<0.05为差异有统计学意义。
结 果
1 大鼠一般状况 与健康对照组大鼠相比,糖尿病大鼠进食、进水、尿量均增加,体质量下降,毛色无光泽,活动量减少,部分大鼠出现烂尾及视网膜病变。糖尿病造模阶段1只大鼠因血糖未达标被剔除出实验,药物干预期间DM组中1只大鼠因多次随机血糖<16.7 mmol/L(持续高脂高糖饲料喂养下)被剔除出实验,DM + Alp组大鼠死亡1只,实验结束时共剩余37只大鼠。
2 血清AngⅡ、TGF-β1浓度 与对照组相比,模型组大鼠血清中AngⅡ、TGF-β1的浓度明显升高(P<0.01);而与模型组相比,DM + Alp及DM + Val两组中TGF-β1的浓度均明显下调(P<0.05),AngⅡ的浓度亦有下降,但差异无统计学意义(P>0.05);AngⅡ、TGF-β1在DM + Alp及DM+Val两组间的差异亦无统计学意义(P>0.05)。见图1。
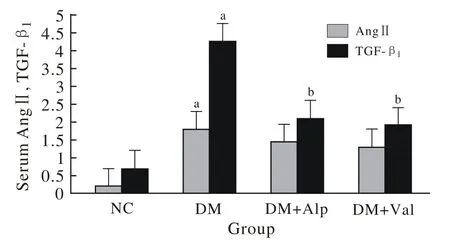
图 1 ELISA法所示大鼠血清AngⅡ、TGF-β1浓度Fig. 1 ELISA showing concentration of AngⅡ、TGF-β1in serum of rats from different groups (aP<0.01, vs NC group;bP<0.05, vs DM group)
3 各组大鼠心功能指标、H/B、LVMI比较 与NC组相比,DM组大鼠体质量、LVSP、+dp/dtmax、-dp/dtmax值明显下降,LVEDP、H/B、LVMI显著升高(P<0.01);前列地尔或缬沙坦治疗组大鼠上述指标与模型组相比均明显改善(P<0.01);DM + Alp、 DM + Val两组间差异无统计学意义(P>0.05)。见表1。
4 各组心肌组织形态学、CVF大小比较 Masson三色染色光镜下观察细胞核呈蓝褐色,心肌纤维呈红色,胶原纤维呈蓝色[4]。NC组大鼠心肌纤维完整,形态规则,间质内胶原纤维分布稀疏,着色淡;DM组大鼠心肌纤维排列紊乱,心肌间隙增宽,胶原纤维明显增多;给予前列地尔或缬沙坦治疗的大鼠心肌纤维结构破坏明显减轻,肌纤维排列基本规则,胶原纤维分布较稀疏(图2)。胶原半定量分析示:DM组大鼠CVF值较NC组明显升高(P<0.01);前列地尔或缬沙坦治疗组较DM组显著下调(P<0.01);DM+Alp、DM+Val两组间差异无统计学意义。见表2。
表 1 各组大鼠心功能指标、H/B及LVMITab. 1 Cardiac function indicator, H/B and LVMI of rats from different groups (±s)

表 1 各组大鼠心功能指标、H/B及LVMITab. 1 Cardiac function indicator, H/B and LVMI of rats from different groups (±s)
aP<0.01, vs NC group;bP<0.01, vs DM group
GroupBody weight (g)H/B (mg/g)LVMI (mg/g)LVSP (mmHg)LVEDP (mmHg)+dp/dtmax(mmHg/s)-dp/dtmax(mmHg/s) NC (n=10)350.90±5.802.85±0.182.05±0.12114.40±5.344.42±0.086 391.40±103.874 465.50±62.92 DM (n=9)244.00±5.57a4.12±0.11a3.44±0.07a86.44±4.59a7.37±0.09a4 463.11±56.42a3 412.22±78.47aDM + Alp (n=9)272.44±5.15b3.36±0.12b2.47±0.08b100.00±2.83b5.30±0.09b5 362.11±87.69b4 167.00±111.20bDM + Val (n=9)278.67±3.54b3.36±0.12b2.46±0.06b102.89±6.53b5.38±0.06b5 444.00±66.11b4 206.67±108.25b
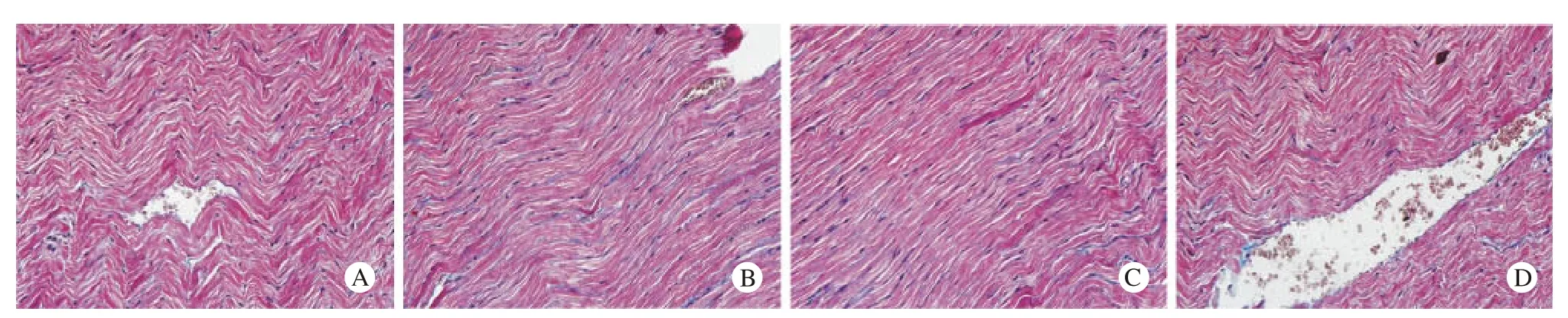
图 2 心肌组织Masson染色 (×400)Fig. 2 Masson staining of myocardial tissue in NC group (A), DM group (B), DM + Alp group (C) and DM + Val group (D) (×400)
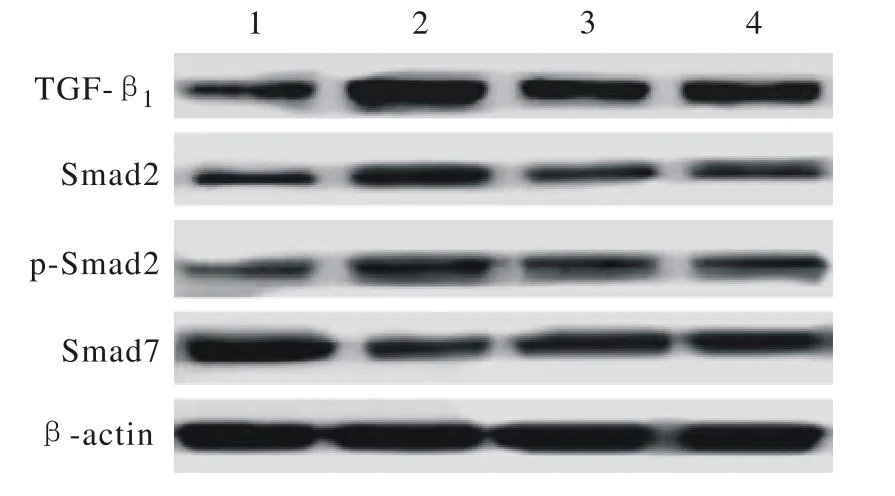
图 3 Western-blotting所示TGF-β1、Smad2、p-Smad2、Smad7及β-actin的电泳条带 (1: NC group; 2: DM group; 3: DM + Alp group; 4: DM + Val group)Fig. 3 Western-blotting showing electrophoretic bands of TGF-β1, Smad2, p-Smad2, Smad7 and β-actin (1: NC group; 2: DM group; 3: DM + Alp group; 4: DM + Val group)
表2 心肌胶原容积分数、羟脯氨酸及胶原总含量Tab. 2 Myocardial collagen volume fraction and content of hydroxyproline and total collagen (±s)
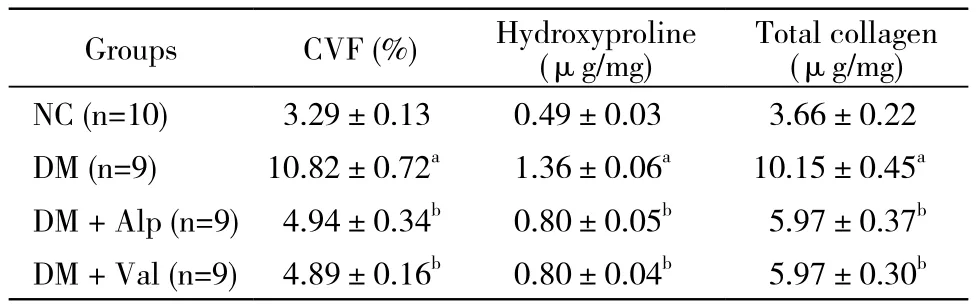
表2 心肌胶原容积分数、羟脯氨酸及胶原总含量Tab. 2 Myocardial collagen volume fraction and content of hydroxyproline and total collagen (±s)
aP<0.01, vs NC group;bP<0.01, vs DM group
GroupsCVF (%)Hydroxyproline (μg/mg) Total collagen (μg/mg) NC (n=10)3.29±0.130.49±0.033.66±0.22 DM (n=9)10.82±0.72a1.36±0.06a10.15±0.45aDM + Alp (n=9)4.94±0.34b0.80±0.05b5.97±0.37bDM + Val (n=9)4.89±0.16b0.80±0.04b5.97±0.30b
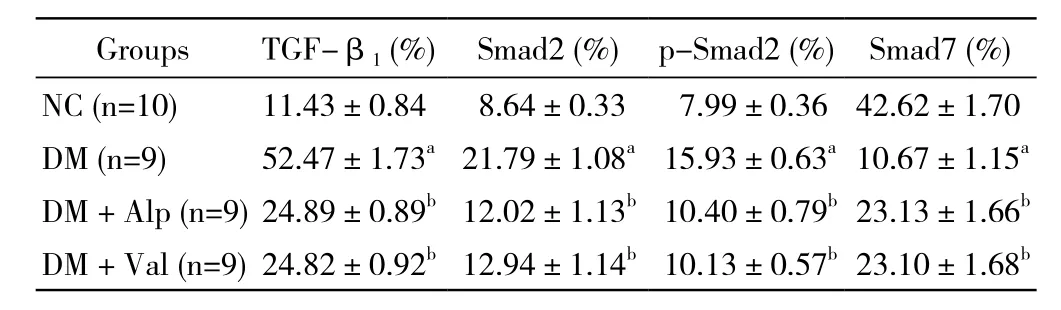
表3 蛋白TGF-β1、Smad2、p-Smad2、Smad7与β-actin的比值Tab. 3 Ratio of protein TGF-β1, Smad2, p-Smad2, and Smad7 to β-actin
5 心肌组织羟脯氨酸含量及胶原总含量 模型组大鼠心肌组织羟脯氨酸含量及胶原总含量较正常大鼠明显升高(P<0.01);前列地尔或缬沙坦治疗组与模型组相比则明显下调(P<0.01)。见表2。
6 信号通路相关蛋白TGF-β1、Smad2、p-Smad2、Smad7表达 与正常对照组比较,DM组大鼠心肌组织TGF-β1、Smad2、p-Smad2的含量显著升高(P<0.01);经前列地尔或缬沙坦治疗的大鼠以上3种蛋白的表达量与DM组相比均明显下调(P<0.01);而Smad7在各组之间的表达呈相反趋势;各蛋白在前列地尔、缬沙坦两组间无统计学差异(P>0.05)。见图3、表3。
讨 论
糖尿病心肌病是指发生于糖尿病状态下,不能用高血压性心脏病、冠状动脉粥样硬化性心脏病、心脏瓣膜病及其他心脏病变来解释的心肌疾病[5]。DCM发生机制复杂,主要涉及糖脂代谢紊乱、细胞凋亡、细胞因子异常及心肌间质纤维化等方面[6]。研究表明,心肌纤维化在DCM的发生发展中起着主导作用,表现为心肌成纤维细胞过度增殖,细胞外基质合成与降解失衡,间质胶原纤维过度沉积,Ⅰ、Ⅲ型胶原比例失调(Ⅰ/Ⅲ型比值增加)及排列紊乱[7]。
糖尿病患者心肌纤维化的发生涉及多种细胞因子的异常表达,主要包括肾素-血管紧张素-醛固酮系统(renin-angiotensin-aldosterone system,RAAS)、内皮素、结缔组织生长因子、TGF-β、基质金属蛋白酶、基质金属蛋白酶组织抑制因子-1等[8-10]。大量研究证实,由TGF-β、TGF-β受体(transforming growth factor-βreceptor,TβR)及其下游Smads蛋白家族构成的TGF-β/ Smads信号通路是介导多脏器纤维化的共同途径[11]。糖尿病高糖环境下外周循环及心脏局部的RAAS被激活,AngⅡ为RAAS的主要活性介质,活化的AngⅡ可刺激心肌成纤维细胞增殖并上调其对TGF-β1的合成与分泌,使心肌组织内TGF-β1的含量和活性增高[12]。活性型TGF-β1首先与其Ⅱ型受体(TβRⅡ)结合形成异源二聚体复合物,后者再与Ⅰ型受体(TβRⅠ)结合并使其活化(TβRⅠ、TβRⅡ均为丝/苏氨酸激酶型受体)[13]。活化的TβRⅠ胞内段直接磷酸化受体调节性Smads蛋白(R-Smads)Smad2、Smad3分别形成p-Smad2、p-Smad3,后两者与通用Smads蛋白(Co-Smads) Smad4结合形成异源寡聚体复合物并转移至核内,与特定转录因子结合进而调节相关基因的转录,抑制性Smads蛋白(I-Smads)Smad7可与R-Smads竞争TβRⅠ的胞内结合位点,阻止Smad2、Smad3的磷酸化,从而阻断信号向胞核内传导,负性调控TGF-β1的致纤维化作用[14]。另外,TGF-β通过调节解偶连蛋白影响线粒体能量代谢,也可导致心肌纤维化的发生[15]。诸多研究表明,TGF-β/Smads信号转导通路的过度激活及R-Smads与I-Smads表达失衡是心肌纤维化发生的始动因素。
前列地尔注射液为前列腺素E1的体外存在形式,其因广泛的生物学活性而被用于心脑血管疾病、肾病、肝炎、胰腺炎和消化性溃疡等疾病的治疗,疗效显著[3]。近几年研究发现,前列地尔注射液通过调节TGF-β1/Smads信号通路相关蛋白的表达而对肝、肺及肾纤维化起到很好的抑制作用[16-17]。其能否通过类似的途径抑制心肌纤维化的发生呢?本实验我们通过构建糖尿病大鼠模型诱导心肌纤维化的发生,部分大鼠在糖尿病造模成功后给予前列地尔注射液治疗,部分大鼠给予缬沙坦这一对心肌纤维化有确切疗效的药物治疗(阳性对照),其余糖尿病大鼠不施加药物干预措施作为空白对照。结果显示:接受前列地尔治疗的糖尿病大鼠与模型组相比,心肌纤维化程度明显减轻,心功能指标亦明显改善,说明前列地尔注射液的确能够抑制糖尿病大鼠心肌纤维化的发生。Western-blotting显示,模型组大鼠心肌组织内TGF-β1、Smad2、p-Smad2含量较正常大鼠明显升高(P<0.01),Smad7明显下降(P<0.01),证实了糖尿病大鼠心肌组织内存在TGF-β1/Smads信号通转导路的过度激活及R-Smads与I-Smads的表达失衡,与前人研究成果相符[18]。结果还显示,前列地尔治疗组大鼠TGF-β1、Smad2、p-Smad2的表达较模型组显著下调(P<0.05),Smad7则明显回升,充分说明了前列地尔注射液能够减弱TGF-β1/Smads信号通路的过度激活及R-Smads与I-Smads的失平衡。
综上所述,前列地尔注射液能够有效防治DCM心肌纤维化的发生,其机制可能与抑制TGF-β1/Smads信号转导通路的过度激活、逆转R-Smads与I-Smads的表达失衡有关。本研究为糖尿病心肌病患者临床应用前列地尔注射液提供了可靠依据。除了经典的Smad信号通路外,TGF-β介导的致纤维化作用还可通过ERK、JNK、p38以及PI3K等信号通路完成,但确切机制尚待研究,这将是我们今后探究的方向[19]。
1 刘冬戈,乔旭柏,杜俊,等.糖尿病心肌病的组织病理学观察[J].中华病理学杂志,2007,36(12):801-804.
2 Belmadani S, Bernal J, Wei CC, et al. A thrombospondin-1 antagonist of transforming growth factor-beta activation blocks cardiomyopathy in rats with diabetes and elevated angiotensin II[J]. Am J Pathol, 2007, 171(3): 777-789.
3 张风林,安玉瑛,角灿武.前列腺素E1的药理作用和临床应用研究概述[J].中国药师,2011,14(4):559-561.
4 沈蔷,陈莉,李昊,等.苦味酸-天狼猩红染色和MASSON染色评价心脏纤维化的比较[J].中国分子心脏病学杂志,2012,12(2):118-120.
5 姚安宁.糖尿病心肌病的研究进展[J].内科,2011,6(5):482-485.
6 耿静, 宋敏, 葛志明. 糖尿病心肌病的研究进展[J]. 中国心血管病研究杂志, 2007, 5(6): 468-471.
7 Maya L, Villarreal FJ. Diagnostic approaches for diabetic cardiomyopathy and myocardial fibrosis[J]. J Mol Cell Cardiol,2010, 48(3): 524-529.
8 王禹川.不同因子致心肌纤维化分子学机制[J].医学综述,2012,18(17):2736-2740.
9 Leask A. Potential therapeutic targets for cardiac fibrosis: TGFbeta,angiotensin, endothelin, CCN2, and PDGF, partners in fibroblast activation[J]. Circ Res, 2010, 106(11): 1675-1680.
10 张海啸,史载祥.转化生长因子-β信号传导通路与心肌纤维化[J].中日友好医院学报,2007,21(2):110-112.
11 Moreno-Bueno G, Cubillo E, Sarrió D, et al. Genetic profiling of epithelial cells expressing E-cadherin repressors reveals a distinct role for Snail, Slug, and E47 factors in epithelial-mesenchymal transition[J]. Cancer Res, 2006, 66(19): 9543-9556.
12 Gray MO, Long CS, Kalinyak JE, et al. Angiotensin II stimulates cardiac myocyte hypertrophy via paracrine release of TGF-beta 1 and endothelin-1 from fibroblasts[J]. Cardiovasc Res, 1998, 40(2):352-363.
13 Miyazawa K, Shinozaki M, Hara T, et al. Two major Smad pathways in TGF-beta superfamily signalling[J]. Genes to cells : devoted to molecular & cellular mechanisms, 2002, 7(12): 1191-1204.
14 Massagué J, Wotton D. Transcriptional control by the TGF-beta/ Smad signaling system[J]. EMBO J, 2000, 19(8):1745-1754.
15 Huntgeburth M, Tiemann K, Shahverdyan R, et al. Transforming growth factor β- oppositely regulates the hypertrophic and contractile response to β-adrenergic stimulation in the heart[J]. PLoS One,2011, 6(11): e26628.
16 褚燕,谭明旗.转化生长因子-β及其Smad信号转导通路在肺纤维化中的作用[J].中国医药指南,2013,11(3):52-53.
17 宋小乐.TGF-β1/Smad信号转导通路对肾间质纤维化的影响[J].南昌大学学报:医学版,2011,51(6):92-95.
18 Zhou Y, Poczatek MH, Berecek KH, et al. Thrombospondin 1 mediates angiotensin II induction of TGF-beta activation by cardiac and renal cells under both high and low glucose conditions[J]. Biochem Biophys Res Commun, 2006, 339(2): 633-641.
19 Hoover LL, Kubalak SW. Holding their own: the noncanonical roles of Smad proteins[J]. Sci Signal, 2008, 1(46): pe48.
Preventive and therapeutic effects of alprostadil injection on myocardial fibrosis in diabetic rats and its mechanism
LIN Duo-duo, ZHANG Zhi
Department of Cardiology, Third Affiliated Hospital of Liaoning Medical College, Jinzhou 121001, Liaoning Province, China
ZHANG Zhi. Email: ningcheng631@163.com
Objective To observe the preventive and therapeutic effects of alprostadil injection on myocardial fibrosis in diabetic rats and its underlying mechanism. Methods Forty SD rats were randomly divided into four groups: normal control group (NC group), diabetic model group (DM group), diabetes model + alprostadil group (DM + Alp group), diabetic model + valsartan group (DM + Val group). Rats in NC group were fed with normal diet, and rats in other three groups were fed with high fat and sugar diet for 8 weeks, and then they were
disposable intravenously injection of streptozotocin (STZ) accounting for 30 mg/kg to build diabetic model. Rats in different groups were given corresponding medication interventions. After 12 weeks, the cardiac functional status were tested, and cardiac index (H/B) and left ventricular mass index (LVMI) were calculated. Deposition situation of myocardial interstitial collagen fiber were observed with Masson staining, and myocardial collagen volume fraction (CVF) were estimated via Proplus 6.0 image analysis system. Content of hydroxyproline in myocardial tissue was tested by chloramine-T method, which represented the total collagen content, and Elisa kit was used to measure the concentration of AngⅡ and TGF-β1 of blood. Expression level of signaling pathways related protein TGF-β1, Smad2, p-Smad2 and Smad7 were detected by Westernblotting. Results Compared with normal rats, cardiac functional status of diabetic rats were poor, H/B, LVMI, CVF and content of hydroxyproline in myocardial tissue increased significantly (P<0.01), concentration of AngⅡ and TGF-β1in blood also increased significantly (P<0.01). All the indicators of rats who were given alprostadil or valsartan improved significantly, however, there was no statistically significant difference of various indicators between them (P>0.05). Conclusion Alprostadil injection can suppress myocardial fibrosis of diabetic rats to some extent by weakening excessive activation of TGF-β1/Smads signal transduction pathway in myocardial tissue.
alprostadil injection; diabetes mellitus; myocardial fibrosis; TGF-β1/Smads signal transduction pathway
R 541
A
2095-5227(2014)10-1054-05
10.3969/j.issn.2095-5227.2014.10.022
时间:2014-07-16 11:34
http://www.cnki.net/kcms/detail/11.3275.R.20140716.1134.003.html
2014-05-13
辽宁省科学技术计划项目(2013225305)
Supported by the Science and Technology Plan Project of Liaoning Science and Technology Committee(2013225305)
林朵朵,女,在读硕士。研究方向:心肌损伤与修复。Email: 969116088@qq.com
张志,男,博士,主任医师,科主任。Email: ningcheng631@163.com
