Keggin型铜取代杂多酸盐的合成、表征及电化学性能
2014-07-07邹晓梅陈艳赵梓铭徐孝南华英杰
邹晓梅,陈艳,赵梓铭,徐孝南,华英杰
(海南师范大学化学与化工学院,海南海口571158
Keggin型铜取代杂多酸盐的合成、表征及电化学性能
邹晓梅,陈艳,赵梓铭,徐孝南,华英杰*
(海南师范大学化学与化工学院,海南海口571158
在中性水溶液中合成了Keggin型铜取代磷钨杂多阴离子PW11O39Cu(II)(H2O)5-(PW11Cu),并对其进行IR、UV-Vis和循环伏安表征.实验结果表明,PW11Cu在700~1100 cm-1的指纹区内有四个特征振动吸收峰,分别对应于P-Oa、W=Od、W-Ob-W和W-Oc-W的反对称伸缩振动吸收.在200 nm和249 nm处有两个很强的紫外吸收,在650~800 nm的可见光区有一个较强的连续吸收带.循环伏安显示W-O骨架波和一对Cu的氧化-还原波.
铜取代杂多阴离子;红外光谱;紫外可见光谱;循环伏安
金属催化剂作为催化剂的一类,在工业催化中占有重要地位.其中过渡金属离子因为含有空的d电子轨道,有可能形成化学吸附键,降低复杂反应的活化能,因此在各种无机和有机反应中得到广泛应用.但过渡金属离子在作为电催化剂使用时必须要保证溶液的pH不能过高,否则金属离子就会沉淀,不利于催化反应的进行[1].将过渡金属离子取代一个或多个杂多离子中的多离子(如W或Mo),形成取代型杂多阴离子,就可以克服简单过渡金属离子的这一缺陷,并保持简单过渡金属离子可逆的氧化-还原特性,还具有抵抗强氧化环境的作用[2-14].
已有文献对一系列的Keggin型过渡金属(Fe、Cr、Mn、Co)取代的杂多阴离子的合成、表征以及电化学性能进行了研究[15-18],但是没有报道过Cu取代的杂多阴离子的电化学性质,本文将Cu2+连接到Keggin型缺位杂多阴离子PW11O397-(PW11)的骨架合成Cu取代的杂多阴离子PW11Cu(II)O395-(PW11Cu),采用IR、UV-vis等手段对其进行表征,并详细研究了其电化学性质,为其进一步作为电催化剂的应用提供实验依据.
1 实验部分
1.1 仪器和试剂
AVATAR360 FTIR红外光谱仪(天津市港东科技发展有限公司);TU-1901紫外-可见分光光度计(北京普析通用仪器有限责任公司);pHs-3C酸度计(上海康仪仪器有限公司);CHI电化学工作站(上海辰华),使用单室电解池,玻碳电极为工作电极(~0.07 cm2),Pt丝为辅助电极,Ag/AgCl(3 mol·L-1KCl)为参比电极.进行电化学扫描前,待测溶液用N2气除氧10 min.
钨酸钠、磷酸氢二钠、丙酮、硫酸氢钠和硝酸铜等,均为国产分析纯.实验用水为二次蒸馏水.
1.2 Na5PW11O39Cu(II)(H2O)制备
Keggin型缺位杂多酸盐Na7PW11O39按参考文献合成[19],Keggin型铜取代杂多酸盐Na5PW11O39Cu(II)(H2O)根据反应式(1)按下述方法合成:取洗净烘干后的圆底烧瓶,先后加入30 mL水和6.07 g的Na7PW11O39,待Na7PW11O39完全溶解以后使用油浴锅加热到95℃,然后在搅拌条件下逐滴加入0.53 gCu(NO3)2·3H2O的溶液,有淡蓝色沉淀出现时停止滴加,冷却后过滤,除去沉淀,继续使用油浴锅将剩余溶液蒸发至10 mL左右.将溶液冷却至室温后,重复用30 mL丙酮洗涤,至无沉淀产生时蒸掉丙酮.将过滤后的溶液置于50℃的烘箱中烘干,把烘干后得到的到淡蓝色固体研磨成粉末,所得样品进行IR、UV-vis和循环伏安表征.制备反应式见式(1)):

2 结果与讨论
2.1 PW11Cu的IR光谱
红外(IR)光谱是Keggin型杂多化合物常见的表征方法.研究表明[20-21],Keggin型结构PW12O403-的IR光谱在700~1100 cm-1的范围内有四个指纹特征峰分别为:P-Oa(1079 cm-1),W=Od(983cm-1),W-Ob-W(890~850 cm-1),W-Oc-W(800~760 cm-1).图1(a)为合成的Keggin型缺位杂多酸盐PW11O397-的红外谱图,其结果与PW12O403-相比,P-Oa的反对称伸缩振动吸收由1079 cm-1分裂为1089 cm-1和1043 cm-1两个峰;W-Ob-W分裂为897 cm-1和859 cm-1;而W-Oc-W则分裂为806 cm-1和734 cm-1;W=Od的振动吸收峰虽未分裂,但振动减弱,频率由983 cm-1降为952 cm-1.产生这种现象的原因是,缺失了一个WO单元的PW11O397-虽然其keggin结构的骨架未被破坏,但是其对称性被破坏由Td降为Cs,使得四面体中心的POa键和八面体桥氧键W-Ob-W、W-Oc-W的振动吸收受到影响,均分裂为两个吸收峰[1,16-18].
图1(b)是按照反应式(1)合成的药品的IR光谱,从图1中可以看到,Keggin型结构指纹区的四个特征振动吸收峰,这四个吸收峰的位置分别是1059 cm-1、965 cm-1、893 cm-1和819 cm-1,分别对应于P-Oa、W= Od、W-Ob-W和W-Oc-W的反对称伸缩振动吸收.由于Cu2+接到PW11O397-的准八面体空位之后,形成Cu(II)(H2O)单元,代替了缺失的WO单元,分子的对称性基本恢复,因此吸收峰的分裂也基本消失.此外,在图中的1626 cm-1和1380 cm-1处,还可以观察到结构水和配位水的振动吸收峰[1].IR的这些测定结果表明,合成的样品Na5PW11O39Cu(II)(H2O)具有Keggin型结构.
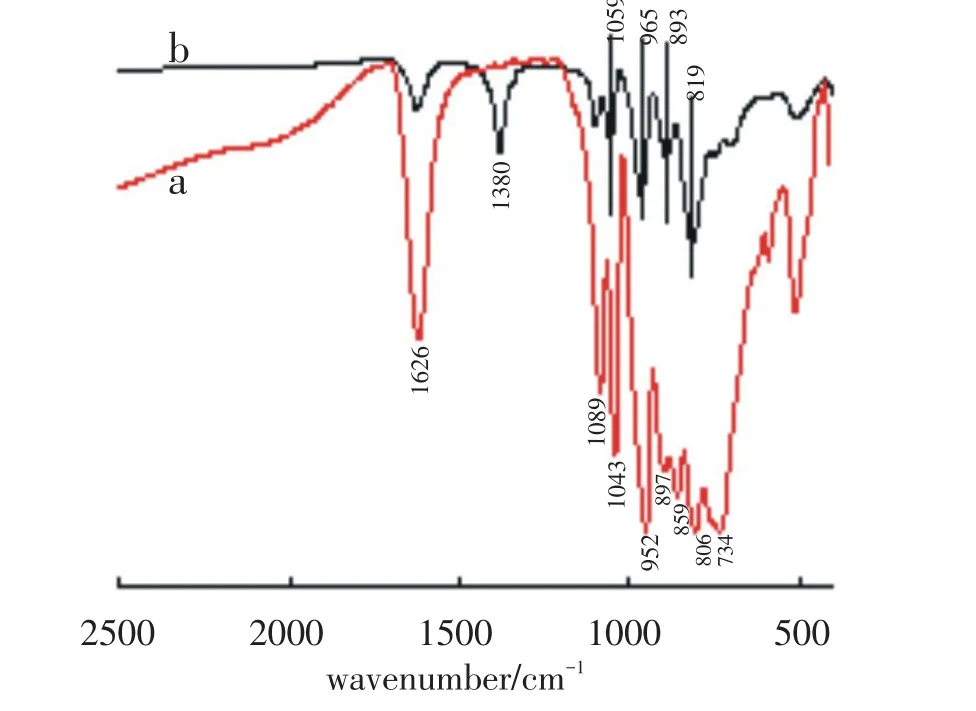
图1 Na7PW11O39和Na5PW11O39Cu(II)(H2O)的红外光谱:(a) Na7PW11O39;(b)Na5PW11O39Cu(II)(H2O)Fig.1IR of Na7PW11O39and Na5PW11O39Cu(II)(H2O):(a) Na7PW11O39;(b)Na5PW11O39Cu(II)(H2O)
2.2 PW11Cu的UV-Vis光谱
Keggin型杂多阴离子的紫外吸收特征峰位于200 nm(Od→W荷移跃迁)和249 nm(Ob,Oc→W荷移跃迁)两处[1,17-18].对不同浓度的样品进行紫外吸收光谱扫描,扫描结果发现在200 nm和249 nm处有明显的吸收.因此,紫外吸收光谱进一步证明合成的样品为PW11O39Cu(II)(H2O)5-.取249 nm处的吸光度值对PW11Cu的浓度作图,得到一条过原点的直线符合朗伯-比尔定律,如图2B所示,求得其摩尔吸光系数ε为2.9×104cm-1·M-1.
样品的固体紫外可见漫反射(图3A)可以发现,PW11Cu不仅在紫外光区有很强的吸收,在650~800 nm的可见光区也有一个连续的吸收带,并且吸收逐渐增强,这也解释了为什么PW11Cu样品呈淡蓝色. PW11Cu溶液的可见吸收光谱(图3B)也给出了同样的结论.
2.3 PW11Cu的电化学性质
在PW11Cu的循环伏安扫描结果中可以看到-0.494/-0.439V和-0.266/0.034V两组峰(见图4),其中-0.494/-0.439V为杂多阴离子的W-O骨架波,-0.266/0.034V是Cu(II)的氧化-还原波,其峰电位差ΔEP为300 mV,远大于作为可逆判据的(57—60/n)mV[22],因此,Cu波的电子传递过程表现为不可逆性质.交流伏安扫描也显示了类似的结果(见图5),在-0.278V处出现Cu(II)/Cu(I)较宽的响应波,且峰电流较小;而W-O骨架波(-0.472V)的波峰较窄,且峰电流较大.
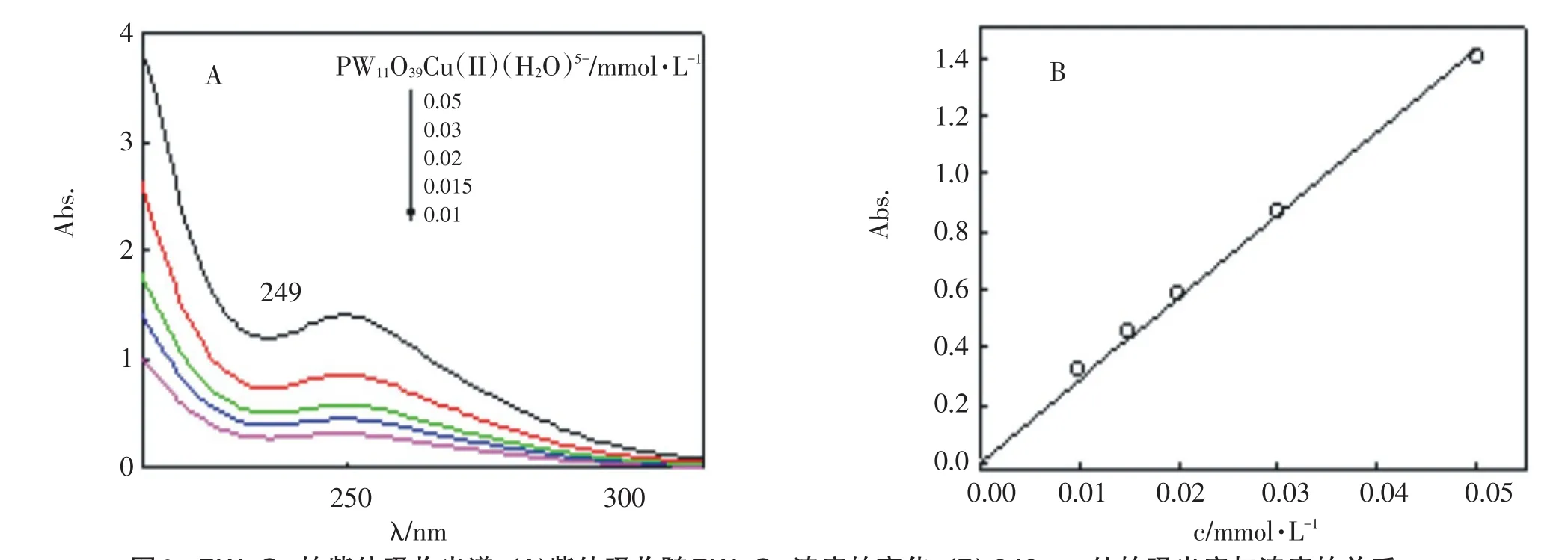
图2 PW11Cu的紫外吸收光谱:(A)紫外吸收随PW11Cu浓度的变化;(B)249 nm处的吸光度与浓度的关系Fig.2UV spectra of PW11Cu:(A)Changes in UV absorption with concentration;(B)Dependence of the absorbance at 249 nm on concentration
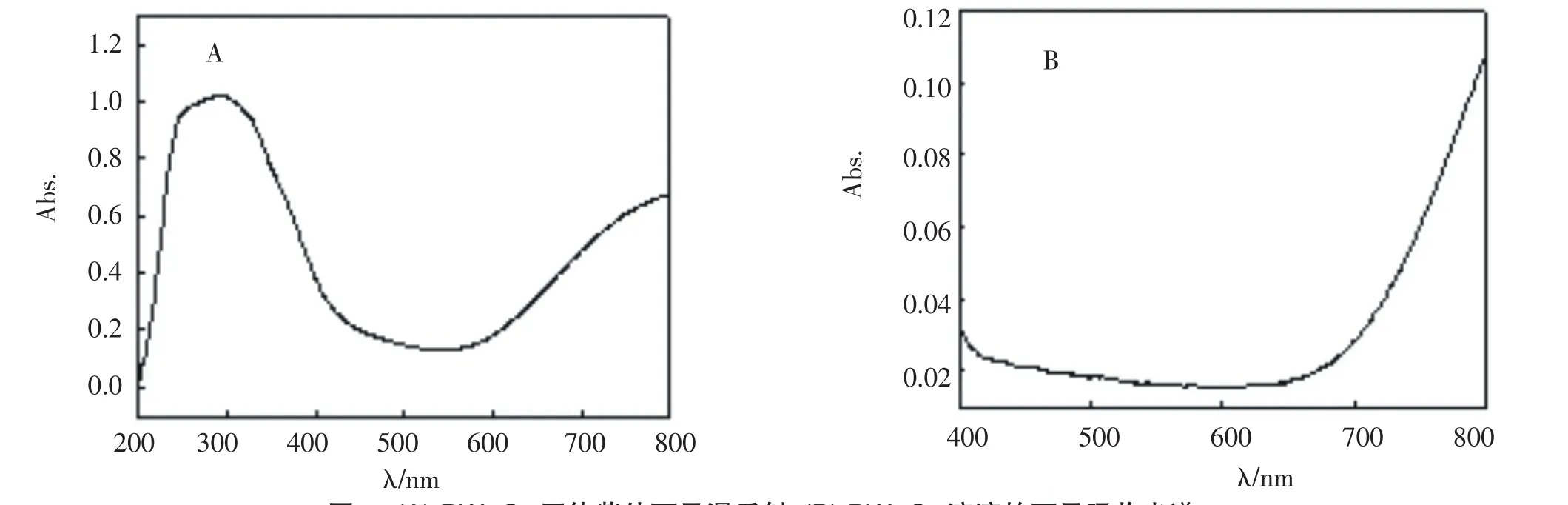
图3 (A)PW11Cu固体紫外可见漫反射;(B)PW11Cu溶液的可见吸收光谱Fig.3(A)UV-Vis diffuse reflectance spectra of PW11Cu;(B)Visible spec trum of PW11Cu aqueous solution
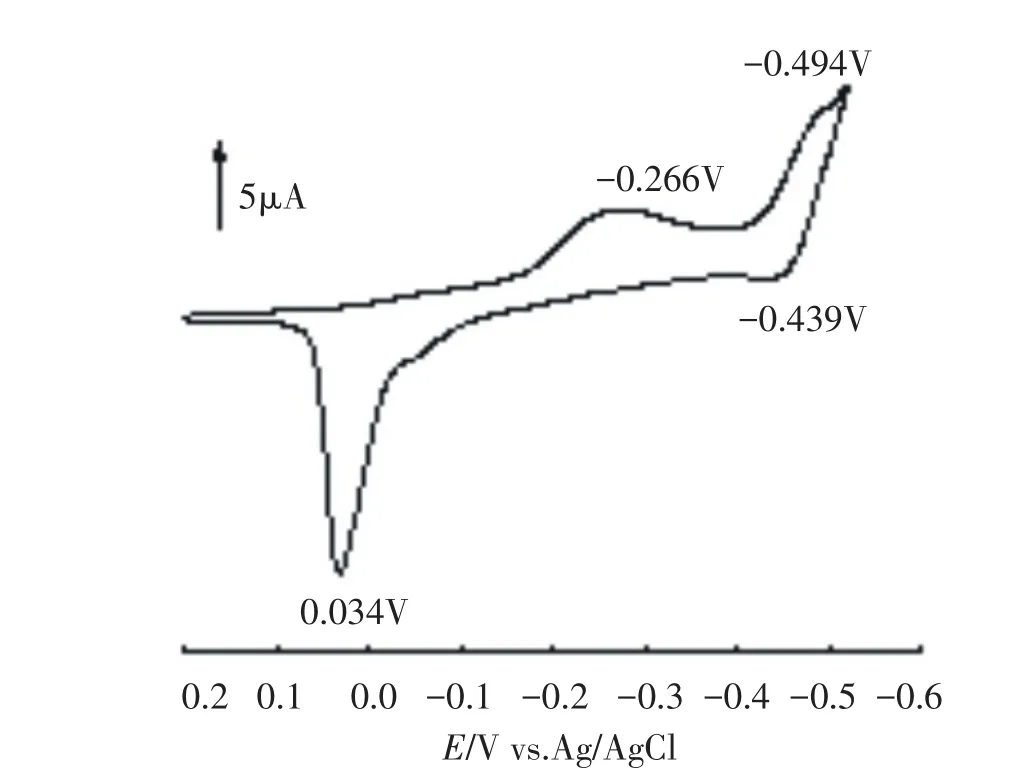
图4 1.0 mmol·L-1PW11Cu溶液的循环伏安曲线,支持电解质为0.1mol·L-1NaHSO4+Na2SO4(pH2.2),扫描速率为10 mV·s-1Fig.4Cyclic voltammogram of the 1.0 mmol·L-1PW11Cu solution,Supporting electrolyte:0.1mol·L-1NaHSO4+ Na2SO4(pH2.2).Scan rate:10 mV·s-1

图5 1.0 mmol·L-1PW11Cu在0.1mol·L-1NaHSO4+ Na2SO4(pH2.2)溶液中的交流伏安曲线Fig.5AC voltammogram of 0.1 mol·L-1NaHSO4+ Na2SO4solution(pH 2.2)containing 1.0 mmol·L-1PW11Cu
实验中观察到溶液的pH对Cu波的峰电位和峰电流有很大影响,当溶液的pH为2.2时,循环伏安扫描只出现一个Cu(II)的还原峰和一个相应于Cu(I)的氧化峰(见图4).当溶液的pH升高至2.5时,循环伏安扫描出现了两个还原峰(峰I和II)及一个氧化峰(峰III),见图6.且随着溶液pH的进一步升高(pH3.5),还原峰I的电流降低,还原峰II的峰电位负移;而氧化峰III的峰电位则正移,表明电极过程与H+有关[23-24].这主要与Cu(II)在溶液中第六配位的配体有关.当溶液的pH<2.2时,Cu(II)的第六配位位置是H2O分子,杂多阴离子在水溶液中的存在形式是PW11Cu(II)(H2O);当溶液的3.5>pH>2.2时,Cu(II)的第六配位位置一部分被H2O占据,另一部分则被氢氧根离子OH-占据,即杂多阴离子在水溶液中的存在形式是PW11Cu(II)(H2O)和PW11Cu(II)(OH)两种;当溶液的pH>3.5时,Cu(II)的第六配位位置主要是OH-离子,杂多阴离子在水溶液中主要以PW11Cu(II)(OH)的形式存在,这与SiW11Mn(II)的情形十分类似[25].因此,循环伏安扫描出现的峰I是Cu(II)(H2O)单电子还原的伏安响应,峰II对应的是Cu(II)(OH)的单电子还原,而峰III则是Cu(I)(H2O)单电子氧化的伏安响应,其相应的电化学反应如下:峰I:PW11Cu(II)(H2O)+e-⇌PW11Cu(I)(H2O)(1)峰II:PW11Cu(II)(OH)+H++e-⇌PW11Cu(I)(H2O)(2)峰III:PW11Cu(II)(H2O)-e-⇌PW11Cu(II)(OH)+H+(3)从上述电化学反应方程式可知,峰II和峰III的峰电位显然与溶液的pH有关.当溶液的酸性降低时,PW11Cu(II)(H2O)有一部分转化为PW11Cu(II)(OH)的形式,因而其浓度降低,使峰I的峰电流减小,相反,峰II的峰电流则增大.
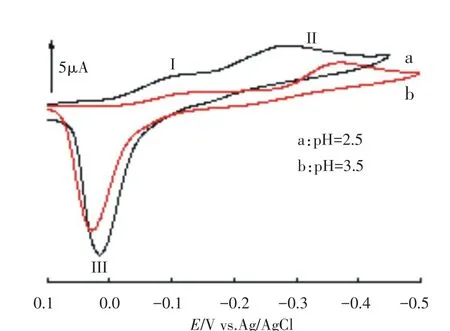
图6 1.0 mmol·L-1PW11Cu在不同pH缓冲溶液中的循环伏安曲线,扫描速度为10 mV·s-1Fig.6Cyclic voltammograms of 1.0 mmol·L-1PW11Cu at different pH at a scan rate of 10 mV·s-1
在循环伏安扫描过程中,我们发现,当对PW11Cu溶液的扫描电位扩展至-1.0V时,电极表面有许多气泡出现,且循环伏安图(见图7)显示,在约-0.86V处有一个很大的峰电流,该电流随溶液酸度的增加而增大,我们推断这是PW11Cu对H2的析出产生显著电催化作用的结果.
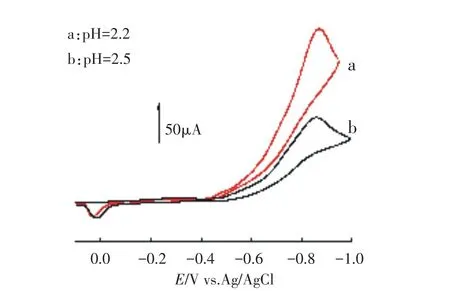
图7 1.0 mmol·L-1PW11Cu在不同pH下的循环伏安曲线(电位扫描范围为-0.1~1.0V),扫描速率为0.01V·s-1Fig.7Cyclic voltammograms of 1.0 mmol·L-1PW11Cu in the potential range from-0.1 to-1.0V at different pH at a scan rate of 0.01V·s-1
3 结论
在中性水溶液中合成的Keggin型铜取代的磷钨杂多阴离子其合成方法及表征手段都十分简便. Keggin型铜取代杂多酸盐的一对氧化-还原波具有准可逆的性质,有可能作为电催化剂,在电解水制备氢气中得到进一步应用.
[1]王崇太.过渡金属Cr(III)和Fe(III)取代磷钨杂多配合物的制备及电催化氧化性能研究[D].广州:中山大学,2008.
[2]Rong C Y,Pope M T.Lacunary polyoxometalate anions are-acceptor Ligands.Characterization of some tungstoru⁃thenate(II,III,IV,V)heteropolyanions and their atom-trans⁃fer reactivity[J].J Am Chem Soc,1992,114:2932-2938.
[3]Khenkint A M,Hill C L.Oxo Transfer from high-valent to⁃tally inorganic oxometalloporphyrin analogs,[Xn+W11O39CrV O](9-n)-(Xn+=P5+,Si4+),to hydrocarbons[J].J Am Chem Soc, 1993,115:8178-8186.
[4]Pope M T,Miller A.Polyoxometalate chemistry:An old field with new dimensions in several disciplines[J].Angew Chem, 1991,30:34-48.
[5]Hua Y J,Wang C T,Liu J Y,et al.Visible Photocatalytic Degradation of Rhodamine B using Fe(III)-SubstitutedPhosphotungstic Heteropolyanion[J].Journal of Molecular Catalysis A:Chemical,2012,365:8-14.
[6]华英杰,王崇太,孙振范,等.新颖的PW11O39Fe(III)(H2O)4-/ H2O2类光-芬顿体系光催化降解苯胺[J].应用化学,2012, 29(1):63-68.
[7]王崇太,华英杰,刘希龙,等.铬取代杂多阴离子PW11O39Cr (III)(H2O)4-可见光催化降解罗丹明B[J].化学学报,2012, 70(4):399-404.
[8]Hua Y J,Wang C T,Duan H,et al.Fabrication,character⁃ization and electrocatalytic properties of a solid modified elec⁃trode based on PW11O39Fe(III)(H2O)4-and chitosan[J].Elec⁃trochimica Acta,2011,58:99-104.
[9]Wang C T,Hua Y J,Tong Y X.A novel Electro-Fenton-Like system using PW11O39Fe(III)(H2O)4-as an electrocatalyst for wastewater treatment[J].Electrochimica Acta,2010,55 (22):6755-6760.
[10]王崇太,孙振范,华英杰,等.Keggin型铁取代杂多阴离子PW11O39Fe(III)(H2O)4-光催化降解硝基苯[J].化学学报, 2010,68(11):1037-1042.
[11]华英杰,王崇太,童叶翔,等.Keggin型杂多阴离子PW11O39Fe(III)(H2O)4-电催化降解硝基苯[J].化学学报, 2009,67(23):2650-2654.
[12]Wang C T,Hua Y J,LI G R,et al.Indirect cathodic elec⁃trocatalytic degradation of dimethylphthalate with PW11O39Fe(III)(H2O)4-and H2O2in neutral aqueous medium[J]. Electrochimica Acta,2008,53(16):5100-5105.
[13]王崇太,华英杰,李高仁,等.Cr(III)-取代磷钨杂多配合物对4-甲基吡啶的电催化氧化作用[J].化学学报,2008,66 (8):835-840.
[14]王彬,王崇太,华英杰,等.Keggin型钴取代杂多阴离子PW11O39Co(II)(H2O)5-的电催化性能[J].电化学,2013,19 (5):488-492.
[15]华英杰,王崇太,刘希龙,等.SiW11O39Fe(III)(H2O)5-的电化学性质及电催化还原过氧化氢[J].中山大学学报,2012, 51(3):73-78.
[16]华英杰,王崇太,李天略,等.Keggin型铬取代杂多阴离子PW11O39Cr(III)(H2O)4-的电化学性质[J].中山大学学报, 2011,50(3):68-73.
[17]张红丹,李娜,焦贵省,等.Keggin型PW11O39Mn(II)(H2O)5-的合成、表征及电化学性质[J].海南师范大学学报:自然科学版,2010,23(2):176-180.
[18]王成龙,彭全明,焦贵省,等.Keggin型钴取代杂多酸盐PW11O39Co(II)(H2O)5-的合成与表征[J].海南师范大学学报:自然科学版,2010,23(2):172-175.
[19]Brevard C,Schimpf R,Tourné G,et al.Tungsten-183 NMR:A complete and unequivocal assignment of the tungsten-tungsten connectives in heteropolytungstates via two-dimensional 183W NMR techniques[J].J Am Chem Soc,1983,105:7059-7063.
[20]王恩波,胡长文,许林.多酸化学概论[M].吉林:东北师范大学出版社,2009.
[21]Kozhenikov I V.Advances in catalysis by heteropolyacids [J].Russian Chemical Reviews,1987,56:1417-1443.
[22]巴德,福克纳.电化学方法-原理及应用[M].北京:化学工业出版社,2005.
[23]王秀丽,赵岷.多酸电化学导论[M].北京:中国环境科学出版社,2006.
[24]华英杰,王崇太,李高仁,等.Keggin型缺位磷钨杂多阴离子的电化学性质及电催化还原过氧化氢[J].化学学报, 2009,67(8):795-800.
[25]Sadakane M,Steckhan E.Investigation of the manganesesubstituted α-Keggin-heteropolyanion K6SiW11O39Mn(H2O)by cyclic voltammetry and its application as oxi⁃dation catalyst[J].J Mol Catal A:Chemical,1996,114:221-228.
责任编辑:毕和平
Synthesis,Characterization and Electrochemistry Property of Keggin-type Cu-substituted Heteropoly Compound
ZOU Xiaomei,CHEN Yan,ZHAO Ziming,XU Xiaonan,HUA Yingjie*
(School of Chemistry and Chemical Engineering,Hainan Normal University,Haikou 571158,China)
Keggin-type Cu(II)-substituted heteropolyanion PW11O39Cu(II)(H2O)5-(PW11Cu)was synthesized in neutral aque⁃ous solution and characterized by IR,UV-Vis and cyclic voltammetry.Experimental results showed that in the 700-1100 cm-1 fingerprint area PW11Cu exhibits five characteristic absorption peaks,corresponding to the anti-symmetric stretching vibration of P-Oa,W=Od,W-Ob-W and W-Oc-W,respectively.There are two strong UV absorptions at near 200 nm and 249 nm and a continuous visible absorption band in the district of 650~800 nm for PW11Cu.In addition to W-O skeletonwaves a pair of Cu(II)/Cu(I)redox wave appears in the cyclic voltammograms.
Cu(II)-substituted heteropolyanion;IR;UV-Vis;cyclic voltammetry
O 646
A
1674-4942(2014)04-0396-05
2014-08-21
国家自然科学基金(21161007);海南省国际科技合作重点项目(KJHZ2014-08);海南省重点科技项目(ZDXM20130088);海南师范大学研究生创新项目
*通讯作者
