雷帕霉素对肺间质纤维化大鼠IL-17、IL-2、TGF-β 和IL-6及调节性T细胞的影响
2014-07-07孙洁民李剑平
黄 莺,徐 芳,万 勇,孙洁民,李剑平
(湖北省武汉市第一医院呼吸内科,湖北 武汉 430022)
◇药学研究◇
雷帕霉素对肺间质纤维化大鼠IL-17、IL-2、TGF-β 和IL-6及调节性T细胞的影响
黄 莺,徐 芳,万 勇,孙洁民,李剑平
(湖北省武汉市第一医院呼吸内科,湖北 武汉 430022)
目的 研究雷帕霉素对大鼠肺纤维化的影响及其机制。方法 SD大鼠15只,随机分为博来霉素5只,生理盐水对照组5只,雷帕霉素干预组5只。采用气管内注入博来霉素(5 mg·kg-1)的方法复制大鼠肺纤维化模型。对照组采用气管内注入生理盐水(1.25 mL·kg-1)的方法制造阴性对照。气管灌注博来霉素后第3天给予雷帕霉素干预组大鼠雷帕霉素灌胃(每天1 mg·kg-1),连续10 d达到雷帕霉素对肺纤维化的干预。第28天分别处死动物,肺组织病理切片 HE染色,免疫组织化学方法检测 IL-17、IL-2、TGF-β和 IL-6的表达;流式细胞术检测 CD4+调节性 T细胞和 CD8+调节性 T细胞的比例。结果 雷帕霉素干预组肺纤维化严重程度较博来霉素组明显减轻,Ashcroft评分存在统计学差异(P<0.01);IL-6、IL-17、TGF-β和 IL-2表达水平在博来霉素组较正常对照组和雷帕霉素干预组升高(P<0.01)。雷帕霉素组的 IL-17、TGF-β的表达水平较对照组升高(P<0.01),但是较博来霉素组降低(P<0.01)。各组总体样本数据行相关分析提示 IL-6和 IL-17表达水平具有正相关性,IL-17与 TGF-β表达水平也具有正相关性。雷帕霉素干预组 CD4+CD25+Foxp3+细胞占 CD4+CD25+细胞、CD4+细胞和淋巴细胞百分比较对照组升高,CD8+CD25+Foxp3+细胞的相关比例也较对照组和博来霉素组升高,并具有统计学差异(P<0.05)。博来霉素组 CD8+CD25+Foxp3+细胞占 CD8+CD25+细胞百分比较对照组高,并具有统计学差异(P<0.01)。结论 雷帕霉素具有抑制肺纤维化的作用,其抗纤维化的作用可能通过促进调节性 T细胞作者:雨林木风的诱导增殖及其对Th17细胞等效应性细胞的抑制作用发挥来实现。
博来霉素;雷帕霉素;调节性 T细胞;肺纤维化
近期有文献指出调节性 T细胞在肺纤维化患者中,不仅存在数量的下降,同时伴有其抑制效应型T细胞分泌炎性因子功能的下降,最终导致肺纤维化患者调节性 T细胞抑制功能的不足[1]。我们认为肺纤维化作为一种伴有自身免疫紊乱的疾病,也可能存在调节性 T细胞和Th17细胞的不平衡。
雷帕霉素是一种新型的免疫抑制药物,属于大环内酯类药物,近期有研究发现雷帕霉素对调节性T细胞例外,具有增强外周和胸腺幼稚 T细胞Foxp3的表达水平的作用[2]。说明雷帕霉素具有扩增调节性T细胞的作用。那么雷帕霉素是否具有确切的抗肺纤维化的作用,其是否通过对调节性T细胞的扩增达到控制肺纤维化的作用呢。我们针对此问题展开了研究工作,取得了重要的发现。
1 材料和方法
1.1 材料 15只体重在180~200 g的健康 SPF级雌性 SD大鼠,购自武汉大学动物中心。eBioscience公司流式抗体(CD4-FITC、CD8-FITC、CD25-PE、Foxp3-PE-Cy5、Foxp3 Staining Buffer Set)、santa cruz biotechnology公司免疫组化一抗抗体(IL-17、TGFβ1、IL-6、IL-2)、抗兔二抗(购自DAKO公司,针对IL-2、IL-17、TGF-β三种一抗,货号 K5007)、抗羊二抗(购自 KPL公司公司,针对IL-6一抗)。博来霉素(天津太和制药有限公司,每支4 mg)红细胞裂解液 (Beckman Coulter公司PN A11894)、雷帕霉素100 mg(上海源叶生物科技公司 货号53123-88-9)。
1.2 动物分组和处理 SD大鼠15只,随机分为博来霉素5只,生理盐水对照组5只,雷帕霉素干预组5只。采用气管内注入博来霉素(5 mg·kg-1)的方法复制大鼠肺纤维化模型[3]。对照组采用气管内注入生理盐水(1.25 mL·kg-1)的方法制造阴性对照。气管灌注博来霉素后第3天给予雷帕霉素干预组大鼠雷帕霉素灌胃(每天 1 mg·kg-1)[4],连续10 d达到雷帕霉素对肺纤维化的干预。造模 28 d期满后处死全部大鼠,水合氯醛麻醉大鼠后,取外周血3 mL,于左侧肺下叶相同部位的肺组织取材进行常规包埋,石蜡切片。
1.3 肺组织切片 HE染色和免疫组织化学检查制成5 μm厚度的石蜡切片。用苏木素染色液染细胞核3 min,流水洗,盐酸酒精分化,流水洗,氨水返蓝30 s,蒸馏水洗,显微镜下观察染色情况。酒精伊红染细胞质15 s。染色后梯度酒精脱水,二甲苯透明,中性树胶封片。并在显微镜下对肺间质的厚度和肺纤维化的范围进行观察。分别对 IL-2、IL-17、IL-6、TGF-β1在肺组织内的表达。
1.4 流式细胞术检测 通过贝克曼流式细胞仪进行检测。以 FSC-SSC散点图设定淋巴细胞。然后以 CD4-FITC和 SSC设定 CD4+T淋巴细胞门 N。以 CD4+淋巴细胞门N为门选取CD25+CD4+双阳性细胞,并以此 CD25+CD4+双阳性细胞为门 L2。以 CD25+CD4+双阳性细胞为门 L2选取CD4+CD25+Foxp3+三阳性细胞。通过以上设定,算出CD4+CD25+淋 巴 细 胞/CD4+淋 巴 细 胞、CD4+CD25+Foxp3+淋巴细胞/CD25+CD4+淋巴细胞、CD4+CD25+Foxp3+淋巴细胞/CD4+淋巴细胞比例。同样 CD8+CD25+淋巴细胞/CD8+淋巴细胞、CD8+CD25+Foxp3+淋巴细胞/CD25+CD8+淋巴细胞、CD8+CD25+Foxp3+淋巴细胞/CD8+淋巴细胞比例也通过类似设定检测。
1.5 图像分析 石蜡切片 HE染色完成后,以 Ashcroft评分评估肺纤维化的程度。免疫组织化学染色完成后,每张切片选取 5个肺间质相似区域,在400倍放大的高倍视野下通过显微镜拍照取图,每次取图保持显微镜光源强度和显微镜放大倍数保持恒定。通过image-pro plus分析软件对每张图片根据免疫组化阳性着色的深浅及其阳性面积范围计算视野下的积分光密度。每张切片所有视野的积分光密度取平均值作为该张切片的积分光密度。以积分光密度作为评估目标蛋白表达强弱的指标。
1.6 统计学分析 各组大鼠 Ashcroft评分因方差不齐,采用 Kruskal-wallis法进行总体分布统计学分析,使用Nemenyi进行两两比较。3组大鼠的 IL-17和 TGF-β积分光密度采用完全随机设计的多个样本方差分析,对各组间两两比较使用LSD-t检验;IL-6和 IL-2不符合方差齐性数据采用各组总体均数比较采用Kruskal-wallis法进行统计学分析。CD8+%数 据 经 过 检 测不 符 合 方差 齐 性,采 用Kruskal-wallis法进行统计学分析;其余各组流式细胞学检测数据满足方差齐性,采用单因素方差分析,对各组间两两比较使用 LSD-t检验。数据使用均数±标准误表达,以P<0.05具有统计学差异。对免疫组化各细胞因子表达水平之间的关系,采用Pearson积差相关分析。以上数据处理均通过SPSS16.0统计学软件进行统计学分析。
2 结果
2.1 肺组织病理学变化 正常对照组肺脏组织行切片HE染色发现,肺泡间隔正常,肺泡的连续性未受到破坏,肺泡的直径和面积大小均匀,大部分区域终末小气道及血管周边无明显炎性侵润表现,有少数个别区域终末小气道管壁有增厚现象及少许炎性侵润表现,未发现纤维化形成。博来霉素组肺泡间隔增宽,肺泡的连续性受到破坏,肺泡的直径和面积大小不均匀,终末小气道周边炎性细胞侵润明显,血管周边也发现明显的炎性细胞侵润现象。同时伴有纤维化形成,以支气管周边区域较为明显,外周局部区域也有局灶性的纤维化表现。雷帕霉素组终末小气道周边仍有炎性细胞侵润,血管周边也有炎性细胞侵润现象,但较博来霉素组明显减轻,未发现纤维化形成(见图 1)。参照文献实行Ashcroft评分结果如下,对照组:0.28±0.45,博来霉素组:5.76±1.76,雷帕霉素组:2.92±0.64。对各组 Ashcroft评分进行统计学分析,经过方差齐性检测发现方差不齐,采用 Kruskal-wallis法进行统计学分析,结果显示四组大鼠评分结果具有统计学差异,P<0.01。并参照文献使用 Nemenyi进行两两分析,结果显示:雷帕霉素干预组评分与正常对照组有统计学差异,P<0.01,但较博来霉素组明显减低,P<0.01。
2.2 肺组织免疫组织化学结果 白介素 IL-17表达:博来霉素组所表达量最高,对照组所表达的白介素17的量最低,其次是雷帕霉素干预组;雷帕霉素组和对照组表达量具有统计学差异;雷帕霉素组白介素17表达量较博来霉素组低,具有统计学差异,见图2。
白介素 IL-6表达:博来霉素组表达最高,对照组所表达的 IL-6的量最低,其次是雷帕霉素干预组;雷帕霉素组和对照组表达量不具有统计学差异;雷帕霉素组 IL-6表达量较博来霉素组低,具有统计学差异,见图3。
白介素 IL-2表达:博来霉素组所表达量高;对照组所表达的 IL-2的量最低,其次是雷帕霉素干预组,雷帕霉素组和对照组表达量不具有统计学差异;雷帕霉素组 IL-2表达量较博来霉素组低,具有统计学差异,见图4。
TGF-β表达:博来霉素组所表达量最高;对照组所表达的白介素TGF-β的量最低,其次是雷帕霉素干预组,雷帕霉素组和对照组表达量具有统计学差异;雷帕霉素组白介素 TGF-β表达量较博来霉素组低,具有统计学差异,见图5。
2.3 流式细胞术结果 雷帕霉素干预组 CD4+CD25+Foxp3+细胞占 CD4+CD25+细胞、CD4+细胞和淋巴细胞百分比较对照组和博来霉素组升高,雷帕霉素干预组 CD8+CD25+Foxp3+细胞的比例也较对照组和博来霉素组有提升,并具有统计学差异。博来霉 素 组CD8+CD25+Foxp3+细 胞 占 CD8+CD25+细胞百分比较对照组高,并具有统计学差异。博来霉素组 CD4+CD25+Foxp3+细胞占 CD4+细胞、CD4+CD25+细胞及淋巴细胞的百分比较正常对照组无统计学差异,见表1。

图1 各组肺组织免疫组化 HE染色 ×100
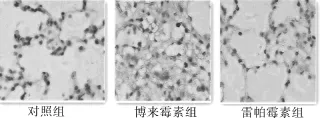
图2 各组 IL-17免疫组化表达 ×400

图3 各组 IL-6免疫组化表达 ×400

图4 各组 IL-2免疫组化表达 ×400
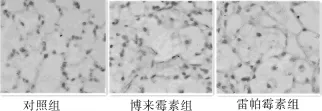
图5 各组 TGF-β免疫组化表达 ×400
3 讨论
雷帕霉素作为免疫抑制剂对于体内多种 T细胞具有抑制增殖的作用,目前已经广泛应用于多种自身免疫性疾病和器官移植后抗排斥反应的治疗[5-6]。其 作 用 机制 是 通过 与雷 帕 霉 素靶 蛋 白mTOR结合,阻断效应型T细胞的增殖[7],我们的研究发现,雷帕霉素干预组终末小气道及血管周边仍有炎性侵润表现,但是较博来霉素组明显降低,气道周边范围肺泡间隔基本正常,肺泡的连续性基本未受到破坏,未发现纤维化形成。Ashcroft评分评估肺纤维化的程度,肺纤维化程度较博来霉素组明显改善。目前国内外也有研究者使用雷帕霉素对博来霉素所致大鼠肺纤维化进行干预[8],其研究结果与我们相同。说明雷帕霉素具有抑制大鼠肺纤维化的作用,但是具体机制尚不明确。
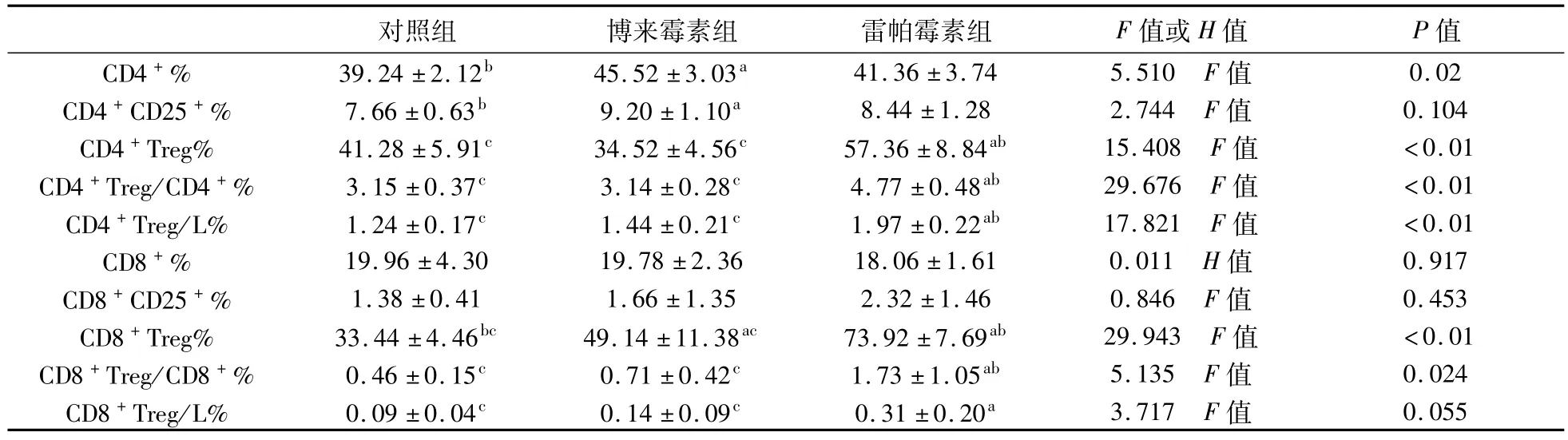
表1 流式细胞术结果
有文献指出,肺纤维化患者中存在调节性T细胞数量不足,并且具有对效应性 T细胞抑制功能减弱的表现,动物实验发现,对大鼠调节性T细胞进行扩增,能够降低大鼠肺纤维化的程度[1,9]。说明调节性 T细胞可能具有抑制肺纤维化的作用。我们的研究结果发现博来霉素组大鼠发生明显肺纤维化,其IL-17表达水平明显升高,与正常对照组具有明显统计学差异;但是其调节性T细胞所占比例较正常对照组却没有统计学差异,其CD8+Treg%较正常对照组高,但是其总的数量却较正常组无统计学差异。这就说明在博来霉素干预组大鼠中存在Th17细胞功能数量明显上升的同时,调节性 T细胞的数量却无明显提升,其功能和数量相对于Th17细胞是相对下降的。
国外研究发现对PI3K,Akt,mTOR通路信号关键分子的阻断可以增强外周和胸腺幼稚T细胞Foxp3的表达水平[10]。我们实验中的雷帕霉素干预组 CD4+调节性 T细胞和 CD8+调节性T细胞的比例也较对照组和博来霉素组具有明显提升,说明雷帕霉素通过与雷帕霉素靶蛋白 mTOR结合,具有提高调节性 T细胞数量,并通过提高调节性 T细胞数量和功能抑制肺纤维化病情发展。
我们的研究结果显示博来霉素组上述几个细胞因子的表达水平较对照组升高,通过对各项指标的数据行相关分析发现,IL-6和 IL-17的表达水平具有线性正相关。已经有研究发现在IL-6和 TGF-β协同下,可以促使幼稚 T细胞向Th17方向分化,从而减少向调节性 T细胞方向分化[11]。而IL-17对 IL-6的表达具有诱导作用[12],同时有文献指出IL-6具有对肺纤维化内的成纤维细胞的凋亡抑制的作用,而成纤维细胞通过分泌 IL-6提升 IL-6的表达水平[13]。根据上述研究结果,我们推测 IL-6及分泌 IL-6的细胞、成纤维细胞、和 Th17细胞之间存在正反馈循环。这个正反馈循环不仅使调节性 T细胞和效应型 T细胞功能数量失衡并促进病灶内慢性炎症反应持续存在,同时加速成纤维细胞在病灶内聚集和异常表型的转化。本研究中的雷帕霉素干预组 IL-17、IL-6、TGF-β、IL-2表达水平较博来霉素组明显降低,说明雷帕霉素可能也通过提高调节性 T细胞数量发挥免疫抑制作用,直接抑制多种效应型 T细胞,致使 IL-6、TGF-β、IL-2炎性因子的分泌减少,打破上述的多种细胞及多种细胞因子参与的正反馈过程,减少成纤维细胞在病灶内聚集和表型转化,达到抑制肺纤维化的目的。
总之,肺纤维化的发病机制目前尚未完全明确,治疗手段也相对匮乏。我们的研究结果显示雷帕霉素具有抑制肺纤维化的作用,其抗纤维化的作用可能通过促进调节性 T细胞的诱导增殖及其对Th17细胞等效应性细胞的抑制作用来实现。
[1] 梅 杨,葛 锐,潘发明,等.调节性 T细胞与常见自身免疫性疾病[J].安徽医药,2010,14(3):249-252.
[2] Ogino H,Nakamura K,Iwasa T,et al.Regulatory T cells expanded by rapamycin in vitro suppress colitis in an experimental mouse model[J].J Gastroenterol,2011,47(4):366-376.
[3] Gao J,Huang Y,Li P,et al.Antifibrosis effects of total glucosides of Danggui-Buxue-Tang in a rat model of bleomycin-induced pulmonary fibrosis[J].Ethnopharmacol,2011,136(1):21-26.
[4] Yoshizaki A,Yanaba K.Treatment with rapamycin prevents fibrosis in tight-skin and bleomycin-induced mouse models of systemic sclerosis[J].Arthritis Rheum,2010,62(8):2476-2487.
[5] Ozdemir BH,Ozdemir AA,Erdal R,et al.Rapamycin prevents interstitial fibrosis in renal allografts through decreasing angiogenesis and inflammation[J].Transplant Proc,2011,43(2):524-526.
[6] 彭磊磊,葛圣林,张成鑫.不同剂量雷帕霉素对小鼠体内 CD4+ CD25+Treg细胞的影响[J].安徽医药,2011,15(3):284-286.
[7] Julien LA,Roux PP.mTOR,the mammalian target of rapamycin [J].Med Sci(Paris),2010,26(12):1056-1060.
[8] Korfhagen TR,Le Cras TD,Davidson CR,et al.Rapamycin prevents transforming growth factor-alpha-induced pulmonary fibrosis[J].Am J Respir Cell Mol Biol,2009,41(5):562-572.
[9] Trujillo G,Hartigan AJ,Hogaboam CM.T regulatory cells and attenuated bleomycin-induced fibrosis in lungs of CCR7-/-mice [J].Fibrogenesis Tissue Repair,2010,3:18.
[10]Ogino H,Nakamura K,Iwasa T,et al.Regulatory T cells expanded by rapamycin in vitro suppress colitis in an experimental mouse model[J].J Gastroenterol,2012,47(4):366-376.
[11]潘 瑞,潘家华.T效应细胞通路在哮喘发病机制中的研究进展及靶向治疗前景[J].安徽医药,2011,15(4):397-400.
[12]Severino VO,Napimoga MH,Pereira SA.Expression of IL-6,IL-10,IL-17 and IL-8 in the peri-implant crevicular fluid of patients with peri-implantitis[J].Arch Oral Biol,2011,56(8):823-828.
[13]Zhang J,Feng MX,Qu JM.Low Dose Theophylline Showed an Inhibitory Effect on the Production of IL-6 and IL-8 in Primary Lung Fibroblast from Patients with COPD[J].Mediators Inflamm,2012,2012:492901.
Augmentation of IL-17,IL-2,TGF-β,IL-6 and CD4+CD25+Foxp3+Regulatory T Cells by rapamycin to repression of pulmonary fibrosis in rats
HUANG Ying,XU Fang,WAN Yong,et al
(Department of Respiratory Diseases,Wuhan No.1 Hospital,Wuhan,Hubei 430022,China)
Objective To study the influence of rapamycin on pulmonary fibrosis in rats and its mechanism.Methods Pulmonary fibrosis model was induced by using the method of intratracheal instillation of bleomycin(5 mg·kg-1).Control group was treated by intratracheal instillation of saline(1.25 mL·kg-1)to obtain the negative control.The rats of the rapamycin treated group were given rapamycin (1 mg·kg-1per day)by gastric perfusion for consecutive 10 days beginning on the third day after intratracheal instillation of bleomycin.On the day of 28th all rats were sacrificed and the peripheral blood and the lung tissues were harvested.The lung tissue were performed HE staining.And the severity of pulmonary fibrosis in rats was assessed by Ashcroft score.The lung tissues were performed immunohistochemical staining to detect the expression of IL-6,IL-17,TGF-beta and IL-2.The expression levels were judged by integrated optical density.Flow cytometry was used to detect the percentages of CD4+CD25+Foxp3+T cells,CD8+CD25+Foxp3+T cells.Results The severity of pulmonary fibrosis was improved in rats of rapamycin group,compared with the rats of bleomycin group.And there was significant difference in Ashcroft score(P<0.01)between rapamycin group and bleomycin group.The expression levels of IL-6,IL-17,TGF-β and IL-2 increased in bleomycin group,compared with the normal control group.The expression levels of IL-6,IL-17,TGF-β and IL-2 decreased in rapamycin group,compared with the bleomycin group.Correlation analysis for data suggested a positive correlation between IL-6 and IL-17 expression levels.And the expression levels of IL-17 were positive correlated with TGF-β.The percentages of CD8+CD25+Foxp3+T cells and CD4+CD25+Foxp3+T cells increased in rapamycin group,compared with the normal control group and bleomycin group.Conclusions Rapamycin can prevent bleomycin-induced pulmonary fibrosis,and its antifibrotic effect maybe works by the promotion of proliferation and function of regulatory T cells and the inhibition of proliferation and function of Th17 cells.
bleomycin;rapamycin;regulatory T cell;pulmonary fibrosis
10.3969/j.issn.1009-6469.2014.03.006
2013-09-19,
2013-10-29)
武汉市科技攻关计划资助项目(No 200751099415)
徐 芳,女,副主任医师,研究方向:肺间质纤维化,Email:xf-0526@sina.com
