β片层阻断肽H102对PAP小鼠脑内ERK信号转导通路的影响
2014-07-05王冰艳孙凤仙林来祥徐淑梅
王冰艳孙凤仙林来祥徐淑梅△
β片层阻断肽H102对PAP小鼠脑内ERK信号转导通路的影响
王冰艳1孙凤仙1林来祥2徐淑梅1△
目的研究β片层阻断肽H102对PAP双转基因小鼠脑内ERK信号转导通路的激活作用。方法将PAP双转基因小鼠随机分为模型组和给药组,每组10只,设同背景C57BL/6J小鼠为对照组。给药组每日鼻腔给予H102溶液(5.8 mg/kg)5µL,对照组、模型组每日鼻腔给予等体积H102空白辅料溶液。30 d后行Morris水迷宫测试。之后采用免疫组化及免疫印迹技术观察小鼠脑组织内RAS、P-MEK及P-ERK蛋白的表达变化。结果(1)Morris水迷宫测试。模型组小鼠学习记忆能力较对照组显著降低,给药组较模型组显著提高(均P<0.05)。(2)免疫组化及免疫印迹检测结果。模型组脑内RAS、P-MEK及P-ERK表达较对照组显著降低,给药组蛋白表达较模型组显著增高(均P<0.01)。结论β片层阻断肽H102可激活PAP双转基因小鼠脑内ERK信号转导通路,增加神经细胞PAS、PMEK及P-ERK的含量,改善PAP小鼠学习记忆能力。
阿尔茨海默病;丝裂原激活蛋白激酶激酶类;小鼠,转基因;投药,鼻内;ERK信号转导通路;β片层阻断肽;RAS;P-MEK;P-ERK
β样淀粉样蛋白(amyloid beta-protein,Aβ)的神经毒性作用被公认是导致阿尔茨海默病(Alzheimer’s disease,AD)发病的重要因素[1]。β片层阻断肽可影响Aβ的β折叠和聚集,进而阻断其神经毒性[2]。本课题组前期研究已证实β片层阻断肽可明显减少Aβ的表达和聚集,抑制神经细胞凋亡,改善模型小鼠的学习记忆能力[3]。ERK信号通路具有抗凋亡作用。有研究表明AD大鼠海马中ERK蛋白表达显著降低,空间学习、记忆能力减退[4-5]。本研究旨在观察β片层阻断肽H102鼻腔给药对PAP双转基因小鼠脑内ERK信号转导通路的激活作用,以探讨H102是否通过ERK信号通路影响神经细胞凋亡。
1 材料与方法
1.1 实验动物8月龄PAP双转基因小鼠20只,同月龄C57BL/6J小鼠10只,雌雄随机提供,体质量(25.69±2.7)g,SPF级,购自中国医学科学院北京协和医学院实验动物研究中心,饲养于天津医科大学动物中心。
1.2 药物及材料H102用固相合成法合成,高效液相色谱纯化,经质谱仪(MS)分析鉴定纯度均>95%,由上海吉尔生化有限公司合成。DAB显色试剂盒、即用型SABC免疫组化试剂盒及生物素二抗购自北京鼎国生物公司。RAS抗体购于Santa公司,P-ERK、P-MEK抗体购自CST公司,GAPDH抗体购于碧云天生物技术研究所,MT200-Morris水迷宫视频跟踪分析系统购自成都泰盟科技有限公司。
1.3 动物分组与给药方法采用随机数字表法将PAP小鼠分为模型组、H102给药组,每组10只。并设同月龄C57BL/6J小鼠10只为对照组。H102给药组每日经鼻腔给予浓度为5.8 mg/kg的H102溶液5µL,对照组和模型组经鼻腔给予等体积的H102空白辅料溶液(0.5%壳聚糖、0.1%BSA),每日给药1次。
1.4Morris水迷宫测试给药30 d后,行Morris水迷宫实验。(1)定位航行实验。将平台置于水迷宫的第三象限中央,每天相同时段小鼠游泳训练2次,每次90 s,将小鼠从相邻象限同一入水点放入水中,记录小鼠寻找并爬上平台所需时间即逃避潜伏期。若小鼠在90 s内未找到平台,则将其引至平台停留20 s,逃避潜伏期记为90 s,历时5 d。(2)空间探索实验。于水迷宫的第6天撤去平台,在相同时段每只小鼠游泳1次,计时90 s。记录小鼠在平台所在第三象限停留时间(residence time in the third quadrant,RTQ)、跨越隐匿平台的次数及入水朝向角等指标测试小鼠的记忆能力。
1.5 免疫组化染色Morris水迷宫实验结束后,10%水合氯醛腹腔注射,开腹后用PBS经左心室灌注至肝肺透明,小鼠断头取脑,一半脑组织放入4%多聚甲醛溶液内固定,一半脑组织分离海马与皮质放入液氮中备用。甲醛固定后的脑组织制成海马、皮质相关区域冠状切片,切片脱蜡至水后以3% H2O2室温孵育10 min及枸橼酸缓冲液微波沸腾抗原修复。5%正常山羊血清封闭。之后滴加按一定比例稀释的一抗(RAS 1∶50,P-MEK 1∶200,P-ERK 1∶200)工作液,4℃过夜后滴加适量生物素标记二抗工作液及辣根酶标记的链霉卵白素工作液,DAB显色剂显色3~15 min。阴性对照组用0.01 mol/L磷酸盐缓冲液(PBS)代替一抗进行免疫组化染色,其余步骤同上。在正立显微成像系统下观察并拍摄切片相同层次海马及皮质,用IPP 6.0软件对图片灰度进行分析。
1.6Western blot分析于液氮中取出分离的小鼠海马和皮质组织,以100 mL RIPA的裂解液加1%PMSF蛋白酶抑制剂及去磷酸化抑制剂于冰上进行匀浆,所得组织匀浆在4℃恒温13 000×g离心20 min,取上清,BCA法测定蛋白后调定各组蛋白为等浓度,加适量上样缓冲液,煮沸变性3 min。10%~12%分离胶电泳分离蛋白后湿转到PVDF膜上,PVDF膜用5%脱脂奶粉室温封闭2 h,加入稀释的一抗(RAS 1∶500,P-MEK 1∶1 000,P-ERK 1∶1 000)),4℃摇床过夜,加入稀释的二抗(1∶5 000),室温下孵育2 h,然后化学发光法曝光,用ImageJ图像处理软件分析所得条带的光密度(OD)值。
1.7 统计学方法采用SPSS 16.0软件处理数据,计量数据以均数±标准差(±s)表示,组间比较采用单因素方差分析法,多重比较采用SNK-q法。检验水准α=0.05。
2 结果
2.1 行为学测试结果
2.1.1 定位航行实验模型组、给药组逃避潜伏期长于对照组,第2天起给药组小鼠较模型组缩短(均P<0.05),见表1。
Tab.1 Comparison of average escape latency in navigation test between three groups of mice表1 3组小鼠定位航行实验平均逃避潜伏期比较(n=10,s,±s)
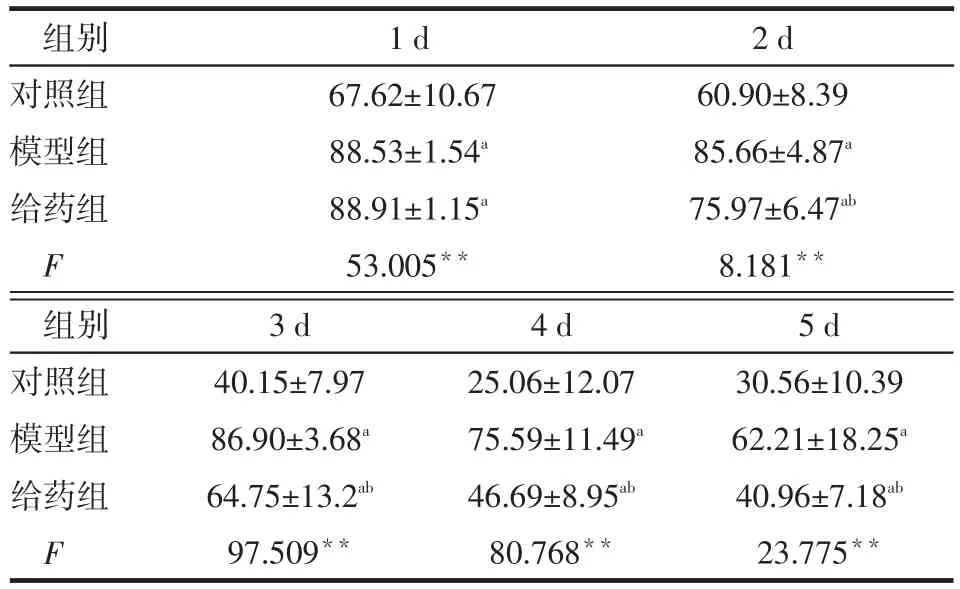
Tab.1 Comparison of average escape latency in navigation test between three groups of mice表1 3组小鼠定位航行实验平均逃避潜伏期比较(n=10,s,±s)
*P<0.05,**P<0.01;a与对照组比较,b与模型组比较,P<0.05;表2~4同
组别对照组模型组给药组F 1 d 67.62±10.67 88.53±1.54a88.91±1.15a53.005**2 d 60.90±8.39 85.66±4.87a75.97±6.47ab8.181**组别对照组模型组给药组F 3 d 40.15±7.97 86.90±3.68a64.75±13.2ab97.509**4 d 25.06±12.07 75.59±11.49a46.69±8.95ab80.768**5 d 30.56±10.39 62.21±18.25a40.96±7.18ab23.775**
2.1.2 空间探索实验模型组RTQ少于对照组,给药组较模型组延长,仍少于对照组(均P<0.05)。模型组跨越隐匿平台次数少于对照组(P<0.05),给药组较模型组跨越次数增加(P<0.05)。模型组入水朝向角大于对照组,给药组较模型组减小,仍大于对照组(均P<0.05),见表2。
Tab.2 Comparison of RTQ,frequency span hidden platform and the corner into the water in space exploration experiment between three groups of mice表2 3组小鼠空间探索实验RTQ、跨越隐匿平台次数及入水朝向角比较(n=10,±s)

Tab.2 Comparison of RTQ,frequency span hidden platform and the corner into the water in space exploration experiment between three groups of mice表2 3组小鼠空间探索实验RTQ、跨越隐匿平台次数及入水朝向角比较(n=10,±s)
组别对照组模型组给药组F RTQ(s)14.12±1.43 8.50±2.48a11.57±1.26ab36.429**跨越平台次数(次/90 s)2.46±0.83 0.53±0.74a1.93±0.80b23.793**入水朝向角(°)30.27±2.85 46.54±6.76a33.66±2.38ab55.738**
2.2ERK信号转导通路相关蛋白免疫组织化学结果(1)RAS。RAS蛋白存在于细胞胞浆内,对照组脑内神经细胞胞浆着色明显,RAS蛋白平均光密度值较高;模型组胞浆着色浅,蛋白表达低于对照组,给药组胞浆着色变深,蛋白表达较模型组增高,但仍低于对照组(均P<0.05),见图1,表3。(2)P-MEK与P-ERK。小鼠脑内P-MEK蛋白位于胞浆内,染色时胞浆着棕色,模型组切片胞浆着色较淡,蛋白表达低于对照组,给药组胞浆着色明显,蛋白表达较模型组、对照组均增高(均P<0.05),见图2,表3。小鼠脑内P-ERK蛋白部分位于胞浆,部分移位于核内,模型组蛋白表达低于对照组,给药组蛋白表达较模型组增高,但仍低于对照组(均P<0.05),见图3,表3。
Tab.3 The expression of purpose protein detected by immunohistochemistry表3 目的蛋白免疫组化表达(n=10,×105,±s)

Tab.3 The expression of purpose protein detected by immunohistochemistry表3 目的蛋白免疫组化表达(n=10,×105,±s)
组别对照组模型组给药组F RAS 7.38±0.44 3.88±0.75a5.38±0.53ab105.595**P-MEK 7.31±0.90 5.28±0.74a8.16±0.86ab37.659**P-ERK 1.74±0.16 1.06±0.17a1.23±0.15ab59.882**
2.3ERK信号转导通路相关蛋白Western blot结果(1)RAS。模型组蛋白表达低于对照组,给药组高于模型组及对照组(均P<0.05)。(2)P-MEK和PERK。模型组脑内P-MEK蛋白表达水平低于对照组,给药组高于模型组及对照组(均P<0.05);模型组脑内P-ERK蛋白表达低于对照组(P<0.05),给药组蛋白表达高于模型组,见图4、5,表4。

Fig.4 RAS and P-ERK protein expression in mouse detected brain by Western blot assay图4 小鼠脑内RAS、P-ERK蛋白Western结果

Fig.5 P-MEK protein expression in mouse brain by Western blot assay图5 小鼠脑内P-MEK蛋白Western结果
Tab.4 The expression of purpose protein detected by Western blot assay表4 目的蛋白Western表达结果(n=10,±s)

Tab.4 The expression of purpose protein detected by Western blot assay表4 目的蛋白Western表达结果(n=10,±s)
组别对照组模型组给药组F RAS 0.596±0.055 0.516±0.040a0.739±0.052ab46.684**P-MEK 0.409±0.021 0.357±0.043a0.502±0.029ab46.866**P-ERK 0.693±0.014 0.652±0.035a0.709±0.011b14.929**
3 讨论
AD是一个包括轻度认知损害(mild cognitive impairment,MCI)在内的连续的疾病过程,其重要病理学特征是Aβ错误折叠聚集而形成的老年斑,Aβ二级结构中β折叠的形成是聚集所必需的[6]。β片层阻断肽可与Aβ结合,减少Aβ的聚集和老年斑的形成,从而抑制其下游病理过程,但具体机制尚不清楚。本课题前期研究已经证实β片层阻断肽可减少凋亡相关蛋白Bad的表达,增加抗凋亡蛋白Bcl-2的表达[7]。Bad蛋白家族与ERK信号转导通路可发生多位点的相互作用,Bad可活化R-RAS及其活性区域,亦可被RAF激酶活化。同时ERK可作为Bad的上游作用激酶,P-ERK可磷酸化Bad ser112位点,磷酸化后的Bad与14-3-3蛋白结合并滞留于胞浆,从而使Bad的促凋亡作用受到抑制[8]。
ERK属于MAPK家族,被激活后转位于细胞核内,磷酸化并激活转录因子,调控基因的表达,引起细胞的增殖和分化[9]。RAS-MEK-ERK信号转导通路可以被生长因子受体、PLC等激活。有研究表明少量Aβ可激活ERK,同时NADPH氧化酶抑制剂可阻断上述作用,这种现象可出现在AD早期[10]。在AD患者及PAP双转基因小鼠脑内神经生长因子减少,ERK表达减少,给予相应生长因子、何首乌等中草药或抗糖尿病药物后ERK通路相关蛋白表达增强,AD转基因小鼠症状改善[11]。另外RAS可能介导Aβ引起的线粒体损害和突触传递障碍[12]。低强度激光疗法,丙戊酸等治疗可激活RAS/ERK通路,改善AD症状[13-14]。因此ERK信号转导通路在AD发病和治疗中的多个点位均具有重要作用。
本实验通过Morris水迷宫测试发现PAP双转基因小鼠学习记忆能力较对照组明显减弱,H102给药组较模型组学习记忆能力提高,提示给予β片层阻断肽H102后PAP双转基因小鼠神经细胞凋亡减少,学习记忆能力得到改善。免疫组化检测显示模型组脑内RAS、P-MEK及P-ERK蛋白表达均低于对照组,给药组表达均较模型组增高。而免疫印迹检测显示模型组脑内RAS、P-MEK、P-ERK蛋白表达均低于对照组,给药组表达较模型组及对照组均明显增高。即PAP双转基因小鼠脑内ERK信号转导通路受到抑制,而β片层阻断肽H102可激活ERK信号转导通路,结合本课题前期研究提示β片层阻断肽H102可能通过激活ERK通路产生抗凋亡作用。同时由于ERK通路还参与胰岛素作用,记忆相关蛋白的激活,因此β片层阻断肽H102通过ERK通路介导的作用可能不止于抗凋亡。本研究结果中个别蛋白给药组表达高于对照组,可能由于ERK信号转导通路与AD其他通路有交叉作用,β片层阻断肽H102可通过多个位点激活ERK通路相关蛋白,导致给药组相关蛋白表达较对照组增加。另外RAS、P-ERK蛋白免疫组化与免疫印迹实验各组对比不对应,可能由于免疫组化为半定量测量,其数值与切片位置、细胞多少均有较大关系,导致出现与免疫印迹测试不同的结果。
本实验采取鼻腔给药途径,药物从鼻腔上皮转运到中枢神经系统(CNS)的精确通路和机制还没有被完全阐明。有研究证明经鼻腔给予大分子物质分别可沿着鼻腔上皮嗅神经和三叉神经通路传递到达嗅球和脑干,再从这些初始脑部入口进一步散布到其他脑区域[15],本研究认为β片层阻断肽H102经鼻路径入脑后除可以抑制Aβ聚集,影响相关蛋白表达,通过多种机制发挥治疗作用。

Fig.1 The expression of RAS protein in mouse brain detected by immunohistochemistry(Immunohistochemistry,×400)图1 小鼠脑内RAS蛋白免疫组化表达(免疫组化,×400)

Fig.2 The expression of P-MEK protein in mouse brain detected by immunohistochemistry(immunohistochemistry,×400)图2 小鼠脑内P-MEK免疫组化表达(免疫组化,×400)

Fig.3 The expression of P-ERK protein in mouse brain detected by immunohistochemistry(Immunohistochemistry,×400)图3 小鼠脑内P-ERK蛋白免疫组化表达(免疫组化,×400)
[1]孙欣,杨宇,吴江.β淀粉样蛋白在阿尔茨海默病中所致的细胞内毒性作用[J].中风与神经疾病杂志,2011,28(3):277-279.
[2]Zhao J,Xu SM.Inhibitory activities of β-sheet breakers on aggregation and toxicity of β-amyloid protein[J].Chin J New Drugs Clin Rem,2008,27(9):675-679.[赵娟,徐淑梅.β片层阻断肽对淀粉样β蛋白聚集和毒性的抑制作用[J].中国新药与临床杂志,2008, 27(9):675-679.]
[3]Li M,Lin LX,Xu SM.Effects of H102 on cholinergic system and free radicals of APP transgenic mouse[J].Chin J New Drugs Clin Rem,2009,28(2):106-110.[李梅,林来祥,徐淑梅.H102对APP转基因小鼠胆碱能系统及自由基的影响[J].中国新药与临床杂志,2009,28(2):106-110.]
[4]Kaminska B,Gozdz A,Zawadzka M,et al.MAPK signal transduction underlying brain inflammation and gliosis as therapeutic target[J]. Anat Rec,2009,292(12):1902-1913.
[5]Cui X,Wang B,Zong Z,et al.The effects of chronic aluminum exposure on learning and memory of rats by observing the changes of Ras/Raf/ERK signal transduction pathway[J].FoodChem Toxicol, 2012,50(2):315-319.
[6]Kuperstein I,Broersen K,Benilova I,et al.Neurotoxicity of Alzheimer’s disease Aβ peptides is induced by small changes in the Aβ42 to Aβ40 ratio[J].EMBO J,2010,29(19):3408-3420.
[7]Sun FX,Wang M,Xu YL,et al.The combined effects of β-sheet breaker and Hucmsc on APP transgenic mice[J].Chin J Appl Physiol,2013,29(3):239-244.[孙凤仙,王曼,徐艳玲,等.β片层阻断肽联合人脐带间充质干细胞对APP转基因鼠的治疗作用[J].中国应用生理学杂志,2013,29(3):239-244.]
[8]Mendoza MC,Er EE,Blenis J.TheRas-ERK and PI3K-mTOR pathways:cross-talk and compensation[J].Trends BiochemSci,2011, 36(6):320-328.
[9]Burkhard K,Smith S,Deshmukh R,et al.Development of extracellular signal-regulated kinase inhibitors[J].Curr Top Med Chem, 2009,9(8):678.
[10]Serrano F,Chang A,Hernandez C,et al.NADPH oxidase mediates β-amyloid peptide-induced activation of ERK in hippocampal organotypic cultures[J].Mol Brain,2009,2(1):31.
[11]BomfimTR,Forny-Germano L,Sathler LB,et al.An anti-diabetes agent protects the mouse brain from defective insulin signaling caused by Alzheimer’s disease–associated Aβ oligomers[J].J Clin Invest,2012,122(4):1339.
[12]Szatmari EM,Oliveira AF,Sumner EJ,et al.Centaurin-α1-Ras-Elk-1 Signaling at Mitochondria Mediates β-Amyloid-Induced Synaptic Dysfunction[J].J Neurosci,2013,33(12):5367-5374.
[13]Meng C,He Z,Xing D.Low-Level Laser Therapy Rescues Dendrite Atrophy via Upregulating BDNF Expression:Implications for Alzheimer’s disease[J].J Neurosci,2013,33(33):13505-13517.
[14]Zhang XZ,Li XJ,Zhang HY.Valproic acid as a promising agent to combat Alzheimer’s disease[J].Brain Res Bull,2010,81(1):3-6.
[15]Thorne RG,Hanson LR,Ross TM,et al.Delivery of interferon-β to the monkey nervous system following intranasal administration[J]. Neuroscience,2008,152(3):785-797.
(2014-03-21收稿2014-05-23修回)
(本文编辑李国琪)
The Effects of β-Sheet Breaker Peptide H102 on ERK Signal Transduction Pathway in Brain of PAP Double Transgenic Mice
WANG Bingyan1,SUN Fengxian1,LIN Laixiang2,XU Shumei1
1 Department of Physiology,2 Institute of Endocrinology,Tianjin Medical University,Tianjin 300070,China XU Shumei,E-mail:xushm@tijmu.edu.cn
ObjectiveTo investigate the activation of β-sheet breaker peptide H102 on ERK signal transduction pathway in brain of PAP double transgenic mice.MethodsPAP double transgenic mice were randomly divided into model group and H102 treatment group(n=10 for each group).A group of C57BL/6J mice with the same genetic background was served as controls.H102(5.8 mg/kg)5µL was infused by intranasal administration to mice in H102 treatment group,and equal volume of blank solution of H102(chitosan,BSA)was given to mice in control group and model group.The ability of spatial reference memory was tested by Morris water maze after 30 days of treatment.Then immunohistochemistry tests and Western blot technique were used to detect the content of RAS,P-MEK and P-ERK proteins in mouse brain.Results(1) The ability of learning and memory was significantly lower in model group than that of control group.The ability of learning and memory was significantly improved in treatment group than that in model group(P<0.05).(2)The contents of RAS,PMEK and P-ERK in mouse brain were significantly lower in model group than those of control group,and these protein expressions were significantly increased in treatment group than those in model group(P<0.01).Conclusionβ-sheet breaker peptide H102 can activate ERK signal transduction pathway in brain of PAP double transgenic mice,increase PAS,PMEK and P-ERK levels in nerve cells,and improve the ability of learning and memory in PAP mice.
Alzheimer disease;mitogen-activated protein kinase kinases;mice,transgenic;administration,intranasal;ERK signal transduction pathway;β-sheet breaker;RAS;P-MEK;P-ERK
R742
A
10.3969/j.issn.0253-9896.2014.07.007
国家科技重大专项基金资助项目(2009ZX09103-029);天津市科技支撑重点项目(09ZCKFSH00100)
1天津医科大学生理教研室(邮编300070);2内分泌研究所
△通讯作者E-mail:xushm@tijmu.edu.cn
