JNK磷酸化14-3-3在大鼠缺血性脑损伤中的作用
2014-07-05王晓天刘晓梅汤仁仙尤红娟李小翠秦苏萍宋远见
王晓天 刘晓梅 汤仁仙 尤红娟 李小翠 秦苏萍 宋远见
JNK磷酸化14-3-3在大鼠缺血性脑损伤中的作用
王晓天 刘晓梅 汤仁仙 尤红娟 李小翠 秦苏萍 宋远见
目的探讨c-Jun氨基末端激酶(JNK)磷酸化14-3-3在大鼠缺血性脑损伤中的作用。方法20只大鼠均分为4组:假手术组、缺血复灌组、SP600125组和溶剂对照组。制作大鼠全脑缺血模型,应用免疫沉淀和免疫印迹法检测4组大鼠脑缺血复灌12 h海马CA1区神经元14-3-3磷酸化(p-14-3-3)、14-3-3与Bax结合、Bax在胞浆和线粒体的蛋白表达情况。结果与假手术组相比,缺血复灌组、溶剂对照组及SP600125组胞浆中的p-14-3-3蛋白、线粒体中的Bax蛋白均增高,14-3-3与Bax的结合降低,SP600125组的胞浆p-14-3-3蛋白、线粒体Bax蛋白低于缺血复灌组和溶剂对照组,14-3-3与Bax的结合高于缺血复灌组和溶剂对照组(均P<0.05)。结论JNK磷酸化14-3-3在大鼠缺血性脑损伤中发挥了重要作用。
14-3-3蛋白质类;JNK丝裂原活化蛋白激酶类;bcl-2相关X蛋白质;脑缺血
14-3-3是一种锚合蛋白,以二聚体的形式广泛存在于胞浆中,通过募集胞浆内的凋亡蛋白如Bax、Bad、Ask1等,行使其抗凋亡的功能[1-3]。Park等[1]报道c-Jun氨基末端激酶(JNK)可磷酸化14-3-3蛋白,干扰Bax与14-3-3的结合,使Bax从14-3-3锚合蛋白上解离,转位到线粒体,促进线粒体内促凋亡因子的释放,诱导细胞凋亡。本实验制作大鼠四动脉结扎全脑缺血模型,通过注射JNK抑制剂SP600125,观察其对缺血海马CA1区神经元中14-3-3磷酸化及Bax线粒体转位的影响,探讨JNK介导的14-3-3磷酸化在大鼠缺血性脑损伤中的重要作用,以期为缺血性脑血管疾病的防治提供新思路。
1 材料与方法
1.1 材料正常健康SD大鼠20只,体质量250~300 g,购自徐州医学院实验动物中心。14-3-3、p-14-3-3(Ser-58)抗体(Santa Cruz Biotechnology公司),Bax抗体(Cell Signaling Biotechnology公司),SP600125(Biomol公司)。
1.2 方法
1.2.1 模型制备及分组大鼠均分为4组:假手术组、缺血复灌组、SP600125组和溶剂对照组。采用四动脉结扎法制作全脑缺血模型[4],将大鼠麻醉后,分离其双侧颈总动脉并电凝椎动脉,次日于清醒状态下结扎双侧颈总动脉,全脑缺血15 min,再灌注12 h处死,为缺血复灌组。假手术组的处理同缺血复灌组,但不结扎双侧颈总动脉。SP600125组将3 g/L的SP600125溶于1%二甲基亚砜(DMSO),于缺血前20 min脑室注射,10µL/只,10 min内注射完[5]。溶剂对照组于缺血前20 min脑室注射等体积1%DMSO。
1.2.2 免疫印迹法检测蛋白表达水平在4℃提取线粒体样本:大鼠缺血复灌12 h,断头快速取脑,分离海马CA1区,立即匀浆,1 000×g离心15 min,取上清,17 000×g离心20 min,沉淀为粗制线粒体部分,上清为与线粒体部分相对应的胞浆部分,BCA法测蛋白浓度后分装。取等量变性蛋白质样本(胞浆部分和线粒体部分),经SDS-聚丙烯酰胺凝胶电泳分离后,转移至硝酸纤维素膜,封闭,一抗4℃过夜,二抗室温孵育2 h,显色,测磷酸化14-3-3蛋白(p-14-3-3)、14-3-3和Bax蛋白表达情况。扫描膜上显色条带,并用Image J软件分析,蛋白表达相对值以各组蛋白灰度值与内参GAPDH灰度值的比值来表示。
1.2.3 免疫沉淀法检测蛋白相互结合情况取等量胞浆部分蛋白质样品,加入5倍体积IP缓冲液,以25 μL蛋白A/G-琼脂糖预吸附1 h,10 000×g离心2 min,取上清,加入1~2 μg Bax抗体,旋转混匀过夜,再加入25 μL蛋白A/G-琼脂糖,旋转混匀2 h,10 000×g离心2 min,沉淀用IP缓冲液洗3遍,加蛋白上样缓冲液,混匀后置沸水浴中5 min,10 000×g离心2 min,吸上清,用14-3-3抗体行免疫印迹分析,以Bax/14-3-3表示胞浆中Bax与14-3-3蛋白结合情况。
1.3 统计学方法采用SPSS 16.0软件进行统计分析。所有数据均以±s表示,两组样本均数比较用t检验,多样本均数比较用单因素方差分析,组间多重比较采用q检验,P<0.05为差异有统计学意义。
2 结果
2.1 4组胞浆中p-14-3-3及14-3-3蛋白水平比较与假手术组相比,其他3组的p-14-3-3水平明显增高,SP600125组的p-14-3-3水平低于缺血复灌组和溶剂对照组(均P<0.05);而溶剂对照组与缺血复灌组无明显差异,见图1、2。4组14-3-3蛋白表达水平差异无统计学意义(F=0.147,P>0.05),见图2。

Fig.1 Comparison of p-14-3-3 protein expression level between four groups图1 4组p-14-3-3蛋白表达水平比较

Fig.2 The protein expressions of p-14-3-3 and 14-3-3 were detected by immunoblotting in four groups图2 免疫印迹法检测4组p-14-3-3和14-3-3蛋白表达
2.2 4组Bax与14-3-3蛋白结合情况比较与假手术组相比,其他3组胞浆中Bax与14-3-3蛋白结合显著减少,SP600125组胞浆中Bax与14-3-3的结合高于缺血复灌组和溶剂对照组(均P<0.05);而溶剂对照组与缺血复灌组差异无统计学意义,见图3、 4。4组Bax蛋白表达水平差异无统计学意义(F= 0.291,P>0.05),见图4。
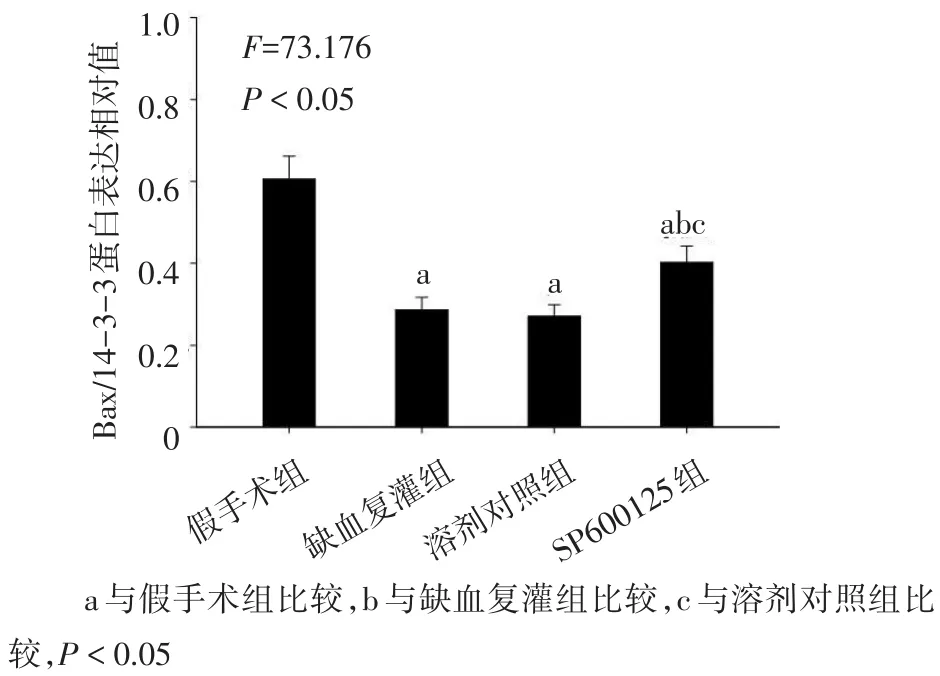
Fig.3 Comparison of the binding of Bax and 14-3-3 between four groups图3 4组Bax与14-3-3蛋白结合情况比较

Fig.4 The binding of Bax and 14-3-3 and the expression of Bax protein were detected by immunoprecipitation and immunoblotting in four groups图4 免疫沉淀和免疫印迹法检测4组Bax与14-3-3蛋白结合、Bax蛋白表达
2.3 4组线粒体中Bax蛋白表达水平比较与假手术组相比,其他3组线粒体组分中Bax蛋白表达水平明显增高,SP600125组线粒体组分中Bax蛋白表达水平低于缺血复灌组和溶剂对照组(均P<0.05);而溶剂对照组与缺血复灌组相比差异无统计学意义,见图5、6。
3 讨论
JNK是丝裂原活化的蛋白激酶家族的成员,可被紫外线照射、炎性因子、生长因子撤除等多种凋亡刺激所激活[6-8]。JNK信号通路在脑缺血再灌注诱导的神经元凋亡中发挥了重要作用。短暂脑缺血后JNK即被激活,激活的JNK顺次磷酸化其核底物如c-Jun和胞浆底物如Bcl-2、Bad等,诱导神经元凋亡。有文献报道JNK可磷酸化另一胞浆底物14-3-3蛋白,促进细胞凋亡[9]。为此,本研究选择了JNK抑制剂SP600125作为工具药,以检测脑缺血复灌过程中JNK能否磷酸化14-3-3,结果显示SP600125可显著抑制14-3-3的磷酸化,提示在脑缺血复灌过程中JNK可以使14-3-3磷酸化。
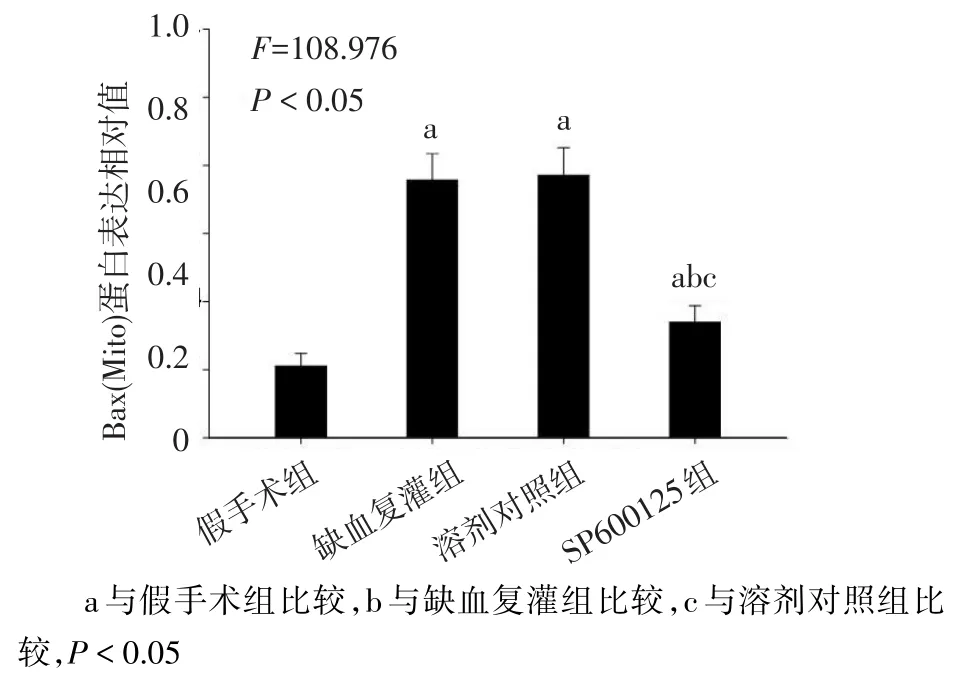
Fig.5 Comparison of Bax protein expression level in mitochondria between four groups图5 4组线粒体中Bax蛋白表达水平比较

Fig.6 The expression of Bax protein in mitochondria was detected by immunoblotting in four groups图6 免疫印迹法检测4组线粒体中Bax蛋白表达
14-3-3是一种锚合蛋白,以二聚体的形式广泛存在于胞浆中,它通过募集胞浆内的凋亡蛋白如Bax、Bad等,而将其锚定在胞浆中,抑制其促凋亡活性。本课题组前期研究发现14-3-3蛋白可通过与Bad结合,阻止Bad转位到线粒体,从而抑制神经元凋亡[10]。本文主要研究了14-3-3蛋白募集胞浆内的另一凋亡蛋白Bax,抑制Bax转位至线粒体,行使其抗凋亡的功能,结果显示SP600125可使胞浆中Bax与14-3-3的结合显著增加,线粒体组分中Bax蛋白明显减少,提示JNK磷酸化14-3-3蛋白,使Bax从锚合蛋白14-3-3上释放,促进Bax转位到线粒体,诱导细胞凋亡。Bax从14-3-3蛋白上释放,可能是由于14-3-3磷酸化修饰后从空间构型上干扰了其与Bax的结合。Bax转位到线粒体外膜上,以同源二聚体的形式参与离子通道的形成,导致细胞色素c的释放;也可能是通过开放其他的通道使细胞色素c释放至胞浆[11]。
综上,本实验证实了脑缺血复灌过程中JNK可以使14-3-3磷酸化,也提示了14-3-3磷酸化后,干扰了其与Bax的结合,Bax与14-3-3分离,转位到线粒体外膜,诱导神经元凋亡。因此,JNK磷酸化14-3-3在大鼠脑缺血复灌过程中发挥了重要作用,为临床防治人类缺血性脑卒中提供了新的思路。
[1]Park JK,Kang MY,Kim YH,et al.PKC delta in preeclamptic placentas promotes Bax dissociation from 14-3-3 zeta through 14-3-3 zeta phosphorylation[J].Placenta,2008,29(7):584-592.
[2]Fan J,Zhang N,Yin G,et al.Edaravone protects cortical neurons from apoptosis by inhibiting the translocation of BAX and Increasing the interaction between 14-3-3 and p-BAD[J].Int J Neurosci, 2012,122(11):665-674.
[3]Puckett MC,Goldman EH,Cockrell LM,et al.Integration of apoptosis signal-regulating kinase 1-mediated stress signaling with the Akt/protein kinase B-IκB kinase cascade[J].Mol Cell Biol,2013, 33(11):2252-2259.
[4]Pulsinelli WA,Brierley JB.A new model of bilateral hemispheric ischemia in the unanesthetized rat[J].Stroke,1979,10(3):267-272. [5]Guan QH,Pei DS,Liu XM,et al.Neuroprotection against ischemic brain injury by SP600125 via suppressing the extrinsic and intrinsic pathways of apoptosis[J].Brain Res,2006,1092(1):36-46.
[6]Zhang J,Bowden GT.Activation of p38 MAP kinase and JNK pathways by UVA irradiation[J].Photochem Photobiol Sci,2012,11(1): 54-61.
[7]Kristiansen M,Menghi F,Hughes R,et al.Global analysis of gene expression in NGF-deprived sympathetic neurons identifies molecular pathways associated with cell death[J].BMC Genomics,2011, 12:551.
[8]Lisanti MP,Tsirigos A,Pavlides S,et al.JNK1 stress signaling is hyper-activated in high breast density and the tumor stroma:Connecting fibrosis,inflammation,and stemness for cancer prevention [J].Cell Cycle,2014,13(4):580-599.
[9]Kim YS,Jung MH,Choi MY,et al.Glutamine attenuates tubular cell apoptosis in acute kidney injury via inhibition of the c-Jun N-terminal kinase phosphorylation of 14-3-3[J].Crit Care Med,2009, 37(6):2033-2044.
[10]Wang XT,Pei DS,Xu J,et al.Opposing effects of Bad phosphorylation at two distinct sites by Akt1 and JNK1/2 on ischemic brain injury[J].Cell Signal,2007,19(9):1844-1856.
[11]Kuwana T,Mackey MR,Perkins G,et al.Bid,Bax,and lipids cooperate to form supramolecular openings in the outer mitochondrial membrane[J].Cell,2002,111(3):331-342.
(2014-02-25收稿2014-04-05修回)
(本文编辑闫娟)
The Effects of 14-3-3 Phosphorylation Induced by JNK on Ischemic Brain Injury in Rats
WANG Xiaotian,LIU Xiaomei,TANG Renxian,YOU Hongjuan,LI Xiaocui,QIN Suping,SONG Yuanjian Department of Pathogenic Biology and Immunology,Xuzhou Medical College,Xuzhou 221002,China
ObjectiveTo investigate the effects of 14-3-3 phosphorylation(p-14-3-3)induced by C-Jun N-terminal kinase(JNK)on ischemic brain injury in rats.MethodsTwenty rats were divided into 4 groups:sham operation group, ischemia-reperfusion group,SP600125 group and solvent control group.The rat model of cerebral ischemia was established. The p-14-3-3,the binding of 14-3-3 and Bax and the protein expression of Bax in cytoplasm and mitochondria in hippocampal CA1 region were detected by immunoprecipitation(IP)and immunoblotting 12-hour after ischemia-reperfusion in four groups.ResultsCompared with the sham operation group,protein expression levels of p-14-3-3 in cytoplasm and Bax in mitochondria were significantly increased,the binding of 14-3-3 and Bax was significantly decreased in ischemia-reperfusion group,solvent control group and SP600125 group.The protein expressions of p-14-3-3 and Bax were significantly lower in SP600125 group than those of ischemia-reperfusion group and solvent control group.The binding of 14-3-3 and Bax was significantly higher in SP600125 group than that of ischemia-reperfusion group and solvent control group(P<0.05).Conclusion14-3-3 phosphorylation induced by JNK plays important effects on ischemic brain injury in rats.
14-3-3 proteins;JNK mitogen-activated protein kinases;bcl-2-associated X protein;brain ischemia
R743.31
A
10.3969/j.issn.0253-9896.2014.07.008
国家自然科学基金资助项目(81371300)
徐州医学院病原生物学与免疫学教研室(邮编221002)
