法夫酵母整合型表达载体的构建
2014-07-02陈丽娜朱艳冰李利君
陈丽娜,朱艳冰,倪 辉,2,3,李利君
(1.集美大学生物工程学院,福建 厦门 361021;2.福建省高校食品微生物与酶工程技术研究中心,福建 厦门 361021;3.厦门市食品与生物工程技术研究中心,福建 厦门 361021)
0 引言
虾青素 (Astaxanthin)是一种抗氧化性极强的类胡萝卜素,被广泛应用在食品、饲料、医药、化妆品、保健品等行业[1-6].法夫酵母(Phafia rhodozyma)发酵生产虾青素具有虾青素积累量高、发酵周期短、不受气候条件影响、发酵工艺容易满足等优点[7],被认为是最具产业化前景的天然虾青素来源.野生型法夫酵母菌株的虾青素产量只有400 μg/g左右[8],经过很多学者的改进,目前法夫酵母菌株的虾青素产量已经提高至3000 μg/g[9].因此,选育高产菌种是提高虾青素发酵产量的有效途径.传统的育种方法如诱变、原生质体融合等虽然在20世纪最后20年发挥了重要的作用,但由于盲目性高、筛选工作量大和突变钝化等问题,已经难以进一步提高菌种的生产能力[10].利用DNA重组技术育种,通过构建载体,有针对性地在载体上设计基因同源重组片段和筛选标记基因,可以较好地解决以上问题.但是,由于没有针对法夫酵母开发的商业化质粒,要想从事相关的研究,首先需要构建相应的载体.法夫酵母的rRNA基因是多拷贝基因,在载体上插入该基因片段作为同源重组基因片段,可使载体高拷贝地整合到法夫酵母染色体上,并得到稳定遗传[10-12].如在载体携带的氨基糖苷类磷酸转移酶基因 (aminoglycoside phosphotransferase gene,KmR),用法夫酵母的肌动蛋白启动子或甘油醛-3-磷酸脱氢酶(gpd)启动子启动表达,就能使对G418敏感的法夫酵母菌株获得G418抗性[11-13].Wery等[11-12]就根据以上原理,成功构建了法夫酵母的整合型载体pGB-Ph9和pPR2T,用于法夫酵母的DNA重组实验.本文借鉴Wery等构建载体的思路,以来源于法夫酵母本身的rRNA基因为基因同源重组片段,尝试构建携带G418抗性基因的整合型载体,并在法夫酵母染色体上整合并表达出G418抗性,为利用DNA重组技术选育法夫酵母的虾青素高产菌株研究奠定基础.
1 材料与方法
1.1 材料与试剂
pET28a为Novagen公司产品;pMD18-T载体和限制性内切酶为TaKaRa产品;酵母基因组DNA快速提取试剂盒、柱式DNA凝胶回收试剂盒、质粒小量提取试剂盒、Taq DNA聚合酶、T4DNA连接酶为东盛生物科技有限公司产品;G418为美国BIOSHARP产品;E.coli DH5α(DE3)菌株,法夫酵母JMU-MVP14、JMU-7B12、JMU-VDL668菌株为本实验室保存;相关引物由华大基因合成;核酸序列的测定由英潍捷基 (上海)贸易公司完成;试剂均为国产化学纯或分析纯.
1.2 仪器与设备
高速冷冻离心机 (Eppendorf,德国);PCR仪 (Eppendorf,德国);蛋白分析仪 (Eppendorf,德国);恒温水浴锅 (金坛市富华仪器有限公司,中国);凝胶成像分析仪 (上海培清有限公司,中国);基因导入仪 (宁波新芝生物科技股份有限公司,中国);摇床 (上海智城分析仪器制造有限公司,中国);隔水式培养箱(上海浦东荣丰科学仪器有限公司,中国).
1.3 引物
通过GenBank数据库获得法夫酵母中18S rRNA的核苷酸序列 (登录号为D31656.1)、编码肌动蛋白 (actin)的核苷酸序列 (登录号为X89898.1)、编码甘油醛-3-磷酸脱氢酶(gpd)的核苷酸序列(登录号为DQ002007.1)和编码氨基糖苷类磷酸转移酶的核苷酸序列 (Novagen公司提供的pET28a载体序列)设计构建法夫酵母整合载体所用的引物,见表1.

表1 引物序列Tab.1 List of primers
1.4 法夫酵母对G418的敏感性研究
将3种法夫酵母菌株的菌液涂布于G418质量浓度分别为0、50、100、150、200、250 μg/mL的YPD培养基平板上,22℃培养7 d,观察3个菌株在平板上的生长情况.
1.5 法夫酵母总DNA的提取
法夫酵母菌株JMU-MVP14培养48 h,离心收集菌体,并用PBS缓冲液洗涤3遍.采用液氮研磨法破壁,直到菌体呈粉红色粉末,称取0.05 g粉末于离心管中,利用酵母基因组DNA快速提取试剂盒提取法夫酵母总DNA,保存于-20℃.
1.6 法夫酵母整合载体的构建
1.6.1 载体元件的克隆 以法夫酵母总DNA为模板,分别利用18S rDNA-F/18S rDNA-R、Pactin-F/Pactin-R、Tactin-F/Tactin-R、Pgpd-F/Pgpd-R、Tgpd-F/Tgpd-R引物扩增法夫酵母的18S rRNA基因、actin启动子、actin终止子、gpd启动子、gpd终止子.以pET28a质粒为模板,利用kna-F/kna-R为引物扩增KmR基因,将PCR产物割胶回收.分别以AknaB-F/AknaB-R、GknaA-F/GknaA-R为引物利用重叠PCR技术扩增Pact-KmR-Tact(两端含BamHI限制性酶切位点)及Pgpd-KmR-Tgpd(两端含AatII限制性酶切位点)两个片段,凝胶回收重叠PCR产物.
1.6.2 载体元件的连接 1)通过T克隆将18S rRNA基因片段连接到pMD18-T载体的T克隆位点上,经过转化、筛选、提取等步骤得到质粒pMD-18s.2)用BamHI酶切Pact-KmR-Tact片段和pMD-18s质粒,用AatII酶切Pgpd-KmR-Tgpd片段和pMD-18s质粒,再用凝胶回收试剂盒回收酶切产物.3)使用CIAP去磷酸化酶将酶切回收的pMD-18s载体的5'端去磷酸化,37℃反应6 h,然后85℃加热15 min使CIAP去磷酸化酶失活,再用凝胶回收试剂盒回收质粒片段.4)用T4DNA ligase将Pact-KmR-Tact和Pgpd-KmR-Tgpd片段连接到pMD-18s质粒上,分别得到质粒pMD-18spakta和pMD-18spgktg.
1.7 整合载体转化法夫酵母细胞
从新鲜培养的法夫酵母菌株JMU-MVP14平板中挑取单菌落接种于30 mL YPD培养基中,22℃、180 r/min培养3 d.以1∶100的比例将上述菌液转接到100 mL YPD培养基,22℃、180 r/min培养,参照文献 [13]中的方法,取不同生长期 (OD600,1.0~1.5,2.0~2.5)的法夫酵母菌体制备感受态细胞.用SacII限制性内切酶酶切pMD-18spakta质粒和pMD-18spgktg质粒,然后用凝胶回收试剂盒回收酶切产物.取60 μL感受态细胞与6 μL线性化质粒混匀转移到电击杯中冰浴5 min,设置电转化参数 (U=1000,1200,1500 V;R=200 Ω;C=25 μF)进行电转化实验.
1.8 转化结果检验
电转化后菌液22℃孵育2.5 h,取150 μL菌液涂布于含20 μg/mL G418的YPD培养基平板,22℃恒温培养直至菌落长出.从转化平板上随机选取单菌落,挑取菌体重悬于10 μL的水中,并加入5 μL的溶壁酶litycase(5 U/μL),30℃孵育10 min,再将样品冻浸入液氮中1 min.以该溶液为模板,kna-F/kna-R为引物进行PCR扩增,再将PCR产物进行琼脂糖凝胶电泳,验证转化结果.
2 结果
2.1 法夫酵母的G418敏感性
将3株不同的法夫酵母菌株JMU-7B12、JMU-VDL668、JMU-MVP14涂布于含不同浓度G418的平板上培养,考察这些菌株对G418的敏感性,结果见表2.JMU-7B12、JMU-VDL668菌株在含有50~250 μg/mL G418的平板上均有部分菌落生长,可见这2株菌对G418不敏感.相比之下,JMUMVP14菌株对G418较为敏感,当平板中G418的质量浓度为50 μg/L时,JMU-MVP14菌株的生长就被完全抑制,因此,选择法夫酵母JMU-MVP14菌株作为整合载体电转化实验的宿主.
为了找到合适的G418筛选质量浓度,本实验进一步测定了抑制JMU-MVP14菌株生长所需的最低G418浓度,结果见表3.当ρ(G418)〈20 μg/mL时,JMU-MVP14菌株可以生长;当ρ(G418)≥20 μg/mL时,JMU-MVP14菌株完全被抑制生长,所以20 μg/mL可作为整合载体转化实验中的G418筛选质量浓度.

表2 法夫酵母菌株对G418的敏感性结果Tab.2 The sensitivity results of P.rhodozyma strains for G418

表3 法夫酵母菌株JMU-MVP14对G418的敏感性结果Tab.3 The sensitivity results of JMU-MVP14 strain for G418
2.2 法夫酵母总DNA的提取
利用酵母基因组DNA快速提取试剂盒从法夫酵母菌株JMU-MVP14的菌体中提取总DNA,取3 μL进行琼脂糖凝胶电泳,结果如图1所示.由图1可见,总DNA条带明亮、拖尾较少.利用蛋白分析仪测得法夫酵母总DNA的A260/280为1.81,纯度较高,可用作后续PCR实验的模板.
2.3 整合载体的构建
以法夫酵母总DNA为模板,利用18S rDNA-F/18S rDNA-R为引物扩增获得法夫酵母的18S rRNA基因片段约1.5 kb;利用引物对Pactin-F/Pactin-R、Tactin-F/Tactin-R、Pgpd-F/Pgpd-R、Tgpd-F/Tgpd-R分别克隆得到actin启动子、actin终止子、gpd启动子、gpd终止子;以pET28a质粒为模板,利用kna-F/kna-R为引物扩增获得KmR基因.运用重叠PCR将启动子序列连接到KmR基因的5'端,将终止子序列连接到Km 基因的3'端,分别得到重组片段Pact-Km Tact和Pgpd-KmR-Tgpd,大小都约2.0 kb.
将克隆好的各部分元件,按照图2所示流程逐步完成载体的构建.首先在质粒pMD18-T的T克隆位点插入18S rRNA基因片段,得到质粒pMD-18s,再在质粒pMD-18s的多克隆位点插入Pact-KmR-Tact片段和Pgpd-KmR-Tgpd片段,分别得到质粒pMD-18spakta和质粒pMD-18spgktg.通过酶切 (见图3)和测序各部分元件的连接顺序和酶切位点进行了验证,结果表明2个载体构建正确.

图1 法夫酵母的总DNAFig.1 Total DNA of Phaffia rhodozyma
2.4 整合载体转化法夫酵母细胞
载体的转化效率与制备感受态时菌体细胞所处的生长状态有非常大的关系.在本实验中,当菌体的OD600=1.0~1.5时制备的感受态的转化效果最好.电转化时的电场强度对转化效率和菌体存活率也有很大的影响,实验结果如表4所示,当电场强度为5 kV/cm时,法夫酵母的电转化效率最高,假阳性菌落数的比例最大,随着电场强度增大,法夫酵母的电转化效率降低,同时假阳性菌落所占比例减小.

表4 电场强度对转化效率的影响Tab.4 Effect of field strength on transformation frequency

图2 法夫酵母整合载体构建流程图Fig.2 The flow chart of constructing the integration vector of Phaffia rhodozyma

图3 质粒酶切鉴定Fig.3 Identification of plasmids digesting with restriction enzymes
2.5 转化结果的检验
随机选取G418抗性平板上的单菌落,挑取适量菌体,破壁,制成溶液,以该溶液为模板,kna-F/kna-R为引物进行PCR扩增.阳性转化子可克隆得到约800 bp的条带,而假阳性和空白对照菌则克隆不出任何条带.本实验选取的菌落验证结果如图4,选取的7个pMD-18spakta质粒转化菌中,1—4为阳性克隆,5—7为假阳性菌,选取的7个pMD-18spgktg质粒转化菌中,8—13为阳性克隆,14为假阳性菌.分别挑取3号和8号菌接种于装有30 mL YPD培养基 (含G418)的三角瓶中,22℃,180 r/min培养,连续传代培养10次后,2个菌株仍可以在含20 μg/mL G418的培养基中生长.以2个菌株的DNA为模板,利用引物kna-F/kna-R进行PCR扩增,均得到约800 bp的条带,见图5.

图4 菌落PCR产物Fig.4 Products of colony PCR
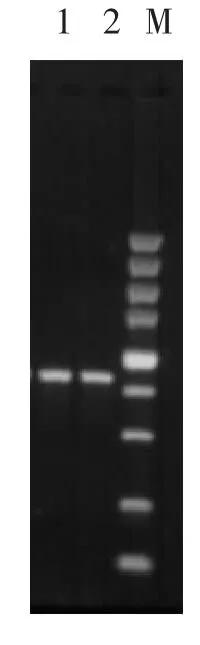
图5 菌液PCR产物Fig.5 PCR products of incubating medium
3 讨论
对不同法夫酵母菌株JMU-MVP14、JMU-VDL668、JMU-7B12的G418敏感性研究发现,JMUMVP14菌株对G418最敏感,可作为载体电转化的宿主.G418的质量浓度过高不利于转化子的生长,质量浓度过低则平板上会出现较多的假阳性克隆,增加筛选的工作量.因此,合适的G418浓度是获得转化子的关键.本实验进一步测定了抑制JMU-MVP14菌株生长所需的最低G418质量浓度.从实验结果可以看到,当G418质量浓度为20 μg/mL时,JMU-MVP14菌株就能完全被抑制生长,因此以20 μg/mL作为G418的筛选浓度.
以来源于法夫酵母本身的18S rRNA基因为同源重组片段,分别利用法夫酵母本身的肌动蛋白启动子和甘油醛-3-磷酸脱氢酶启动子驱动氨基糖苷类磷酸转移酶基因 (KmR)的表达,构建得到法夫酵母的整合型载体pMD-18spakta和pMD-18spgktg,酶切鉴定以及测序分析都表明整合载体构建正确.
取不同生长状态下的法夫酵母细胞制备感受态,并在不同的电压下完成电转化实验,结果表明,当菌体的OD600=1.0~1.5时制备的感受态细胞的转化效果最好,这与Faber等[14]研究发现菌体细胞处于对数生长中期时制备的感受态的转化效率最高的报道相符.转化实验中电压也是实现电击转化的重要参数,一般认为,电穿孔作用是通过触发细胞膜的电通透性增大,形成电致孔洞,从而使DNA等多种生物大分子进出细胞.在电击过程中,电压过低,细胞不宜极化产生微孔通道,质粒DNA不能进入细胞,无法完成转化;电压过高,导致大部分细胞因孔洞形成较大,难以复原而死亡.法夫酵母的细胞壁较厚,含有丰富的糖蛋白,载体转化的难度较大.本实验中当电场强度为5 kV/cm时,法夫酵母的电击转化效率最高,假阳性菌落数的比例也最大,随着电场强度增大,法夫酵母的电击转化效率降低,同时假阳性菌落所占比例减小.综合考虑载体的转化效率和菌体的存活率,选择6 kV/cm作为法夫酵母电转化实验的最佳电场强度.
整合载体pMD-18spakta和pMD-18spgktg用限制性内切酶SacII线性化后分别电转化导入法夫酵母细胞,质粒通过18S rRNA基因发生同源重组整合到法夫酵母细胞染色体上,导致KmR基因插入到染色体中,并在启动子的驱动下表达,使法夫酵母具有G418抗性.通过G418抗性平板的筛选和菌落PCR的鉴定,获得载体成功整合到细胞染色体上并表达出G418抗性的法夫酵母菌株,该菌株能够在含20 μg/mL G418的YPD平板上生长,连续传代培养10次后菌株仍具有G418抗性.通过PCR验证,菌株的DNA依然携带整合上去的KmR基因,说明载体整合到法夫酵母染色体上后得到稳定遗传.在转化子的筛选过程中发现,G418抗性平板上有较大比例的假阳性克隆存在,这可能是因为2个载体整合到法夫酵母细胞染色体上都是通过一次同源重组,比较不稳定,部分转化子产生回复突变[15];还可能是因为表型延迟[16],整合载体转化到法夫酵母细胞后只在染色体的一条链上进行rRNA基因位点的整合,在细胞分裂增殖过程中,产生未发生载体整合的细胞,当有G418抗性的细胞将环境中的G418分解后,没有抗性的细胞得以优势生长.
[1]MIKI W.Biological functions and activities of animal carotenoids[J].Pure and Applied Chemistry,1991,63(1):141-146.
[2]GOTZ T,WINDHOVEL U,BOGER P,et al.Protection of photosynthesis against ultraviolet-β radiation by carotenoids in transformants of the cyanobacterium synechococcus PCC7942 [J].Plant Physiology,1999,120(2):599-604.
[3]NAKANO T,TOSA M,TAKEUCHI M.Improvement of biochemical features in fish health by red yeast and synthetic astaxanthin[J].Journal of Agricultural and Food Chemistry,1995,43(6):1570-1573.
[4]CROSS C E,HALLIWELL B,BORISH E T,et al.Oxygen radicals and human disease[J].Annals of Internal Medicine,1987,107(4):526-545.
[5]EONSEON J.From biosynthesis to biotechnological mass production and application[J].Journal of Microbiology and Biotechnology,2003,13:165-174.
[6]LYONS N M,O'BFIEN N M.Modulatory effects of an algal extract containing astaxanthin on UVA-irradiated cells in culture[J].Journal of Dermatological Science,2002,30(1):73-84.
[7]PARAJO J,SANTOS V,VAZQUEZ M.Optimization of carotenoid production by Phaffia rhodozyma cells grown on xylose[J].Process Biochemistry,1998,33(2):181-187.
[8]JOHNSON E A,LEWIS M J.Astaxanthin formation by the yeast Phaffia rhodozyma [J].Journal of General Microbiology,1979,115:173-183.
[9]倪辉,洪清林,肖安风,等.一株法夫酵母虾青素高产菌株的生产性能 [J].生物工程学报,2011,27(7):1065-1075.
[10]VISSER H,VAN OOYEN A J J,VERDOES J C.Metabolic engineering of the astaxanthin-biosynthetic pathway of Xanthophyllomyces dendrorhous[J].FEMS Yeast Research,2003,4:221-231.
[11]WERY J,GUTKER D,RENNIERS A C H M.High copy number integration into the ribosomal DNA of the yeast Phaffia rhodozyma [J].Gene,1997,184:89-97.
[12]WERY J,VERDOES J C,VAN OOYEN A J J.Efficient transformation of the astaxanthin-producing yeast Phaffia rhodozyma [J].Biotechnology Techniques,1998,12(5):399-405.
[13]SOUTHERN P J,BERG P.Transformation of mammalian cells to antibiotic resistance with a bacterial gene under control of the SV40 early region promoter[J].Journal of Molecular and Applied Genetics,1982,1:327-341.
[14]FABER K N,HAIMA P,HARDER W,et al.Highly-efficient electrotransformation of the yeast Hansenula polymorpha[J].Current Genetics,1994,25:305-310.
[15]王越,巩新,唱韶红,等.α-1,6-甘露糖转移酶基因敲除的毕赤酵母菌株构建及其用于融合蛋白HSA/GM-CSF表达的研究[J].生物工程学报,2007,23(5):907-914.
[16]周德庆.微生物学教程 [M].2版.北京:高等教育出版社,2002:216.
