盐酸溶液中二环己基硫脲对304不锈钢的缓蚀作用
2014-07-02钱菁沈长斌
钱菁,沈长斌
(1.新昌县产品质量监督检验所,浙江 绍兴312500;2.大连交通大学 材料科学与工程学院,辽宁 大连116028)*
0 引言
由于具有耐久性、优良的机械和抗腐蚀性能,304L镍铬不锈钢在工业上得到广泛应用.在侵蚀性介质中由于点蚀使得氧化膜失效行为严重影响其应用[1].由于能形成水溶性的金属氯化物以及经济性等原因,盐酸广泛地应用于酸洗,除锈等领域[2].为了控制对基体金属表面的侵蚀,特别是在高浓度酸性环境和温度在273和333 K变化的条件下,有效的缓蚀剂的应用是很有必要的[3].同时含有氮原子和硫原子的有机化合物的缓蚀效率要优于仅含有氮原子或硫原子的有机化合物的缓蚀效率.硫脲分子含有一个硫原子和两个氮原子,因此硫脲及其衍生物的缓蚀效率要高于单独含有硫原子或氮原子的化合物[4].本文旨在研究一种硫脲衍生物—二环己基硫脲(DCTU)在酸性溶液中作为304L不锈钢缓蚀剂的缓蚀效率.选择二环己基硫脲(DCTU)作为缓蚀剂基于两个原因,一是该衍生物可以使用较便宜的原料合成;二是水溶液中电负性的氮原子和硫原子的存在可以促进化合物在304L不锈钢表面的吸附.
通过动电位极化曲线,研究了四个温度,六个浓度条件下二环己基硫脲(DCTU)对304L在2 mol/L盐酸溶液中的缓蚀作用.
1 实验方法
1.1 样品
304L不锈钢样品的化学成分:C为0.03%;Cr为18.2%;Ni为8.4%;其余为 Fe.样品处理过程如下:
用于试验的样品依次用220,320,400,800,1000和1200#金刚砂纸打磨,最后用研磨膏抛光.在进行动电位极化曲线测试前,用环氧树脂将样品封好,然后金刚砂纸打磨,抛光,其试验暴露面积为10 mm×10 mm.
1.2 腐蚀介质
AR级HCl和二次蒸馏水用来制备2 mol/L HCl溶液.
1.3 缓蚀剂
DCTU的化学方程式如图1所示.浓度范围为0.0001 ~0.0017 mol/L.
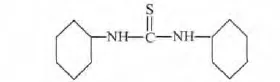
图1 DCTU化学方程式
1.4 实验装置
动电位极化曲线测试在电化学工作站上进行(型号:LK-98II).三电极系统,饱和甘汞电极(SCE)为参比电极,铂片为辅助电极.扫描速度为0.166 mV·s-1,工作温度 303,313,323 和 333 K.icorr是腐蚀电流密度,Ecorr为腐蚀电位.腐蚀形貌观察采用JSM-6360LV型扫描电子显微镜(SEM).
2 结果和讨论
表1列出了给定条件下DCTU对304L不锈钢在2 mol/L HCl溶液缓蚀作用的参数.根据式(1)~(3),分别计算出腐蚀速率CR(mpy),表面覆盖度θ和缓蚀效率IE%[5].
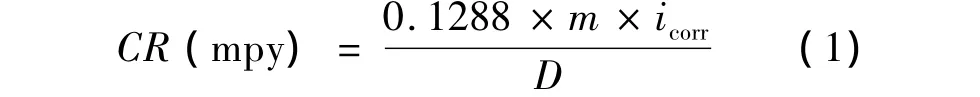
式中,icorr为腐蚀电流密度(μA·cm-2);m为样品质量(kg);D为样品密度(kg/m3).
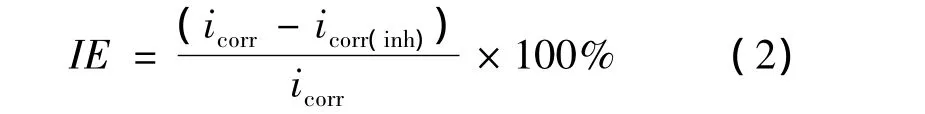
式中,icorr和 icorr(inh)分别为添加缓蚀剂前后的腐蚀电流密度(μA/cm2).
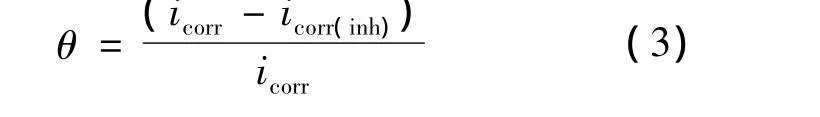
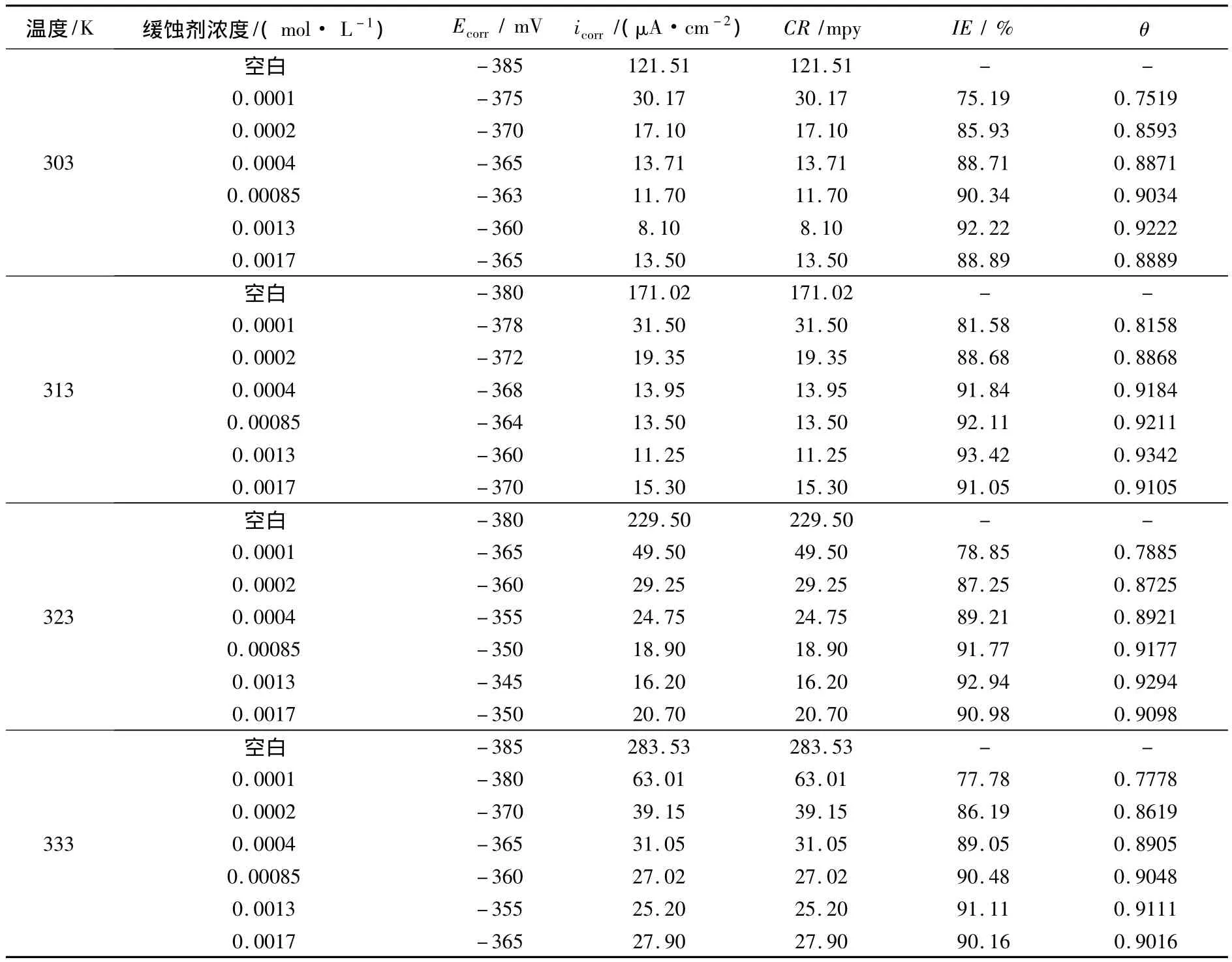
表1 不同温度,不同浓度缓蚀剂条件下,2 M HCl溶液中动电位测试结果
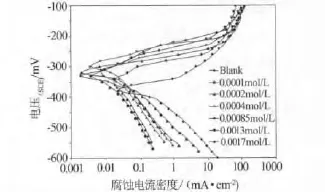
图2 不同浓度缓蚀剂条件下304L的动电位极化曲线
图2为温度为303K下,不同浓度缓蚀剂条件下,304L在2 mol/L HCl溶液中的动电位极化曲线,根据表1和图2,可以看出腐蚀电位Ecorr有一个较大的正向位移,同时电流密度急剧下降.腐蚀电位的正向位移表明DCTU对HCl溶液中的304L不锈钢是一有效的阳极缓蚀剂.并且缓蚀效率随浓度增加而增加,达到一临界值0.001 3 mol/L.效率的增加可归因于吸附和成膜机制而造成的覆盖效应,覆盖效应将降低受侵蚀的面积.缓蚀效率最低为75%(缓释剂浓度为0.000 1 mol/L),最高为近93%(浓度为 0.001 3 mol/L).高的吸附作用主要由极性集团和双键的π电子引起的.
温度对缓蚀效率的影响如表1所示.由表可知:在空白溶液中,腐蚀电流密度和腐蚀速率随温度增加显著地增加.温度的增加表明水溶液导电率的增加,使得氢原子在金属表面的扩散速率增加,腐蚀速率加快.同时可以看出:当温度从303增加到333 K,IE变化不是很明显,表明DCTU对温度不是很敏感;当添加缓蚀剂后,温度虽有所增加,IE也略有增加.
为了对与2 mol/L HCl溶液相接触的304L不锈钢表面进行评估,采用扫描电子显微镜(JSM-6360LV)对动电位极化曲线测试完毕后的试样进行观察.图3为观察结果(2 mol/L HCl溶液,303K,0.001 3 mol/L DCTU).304L 不锈钢在 HCl溶液的腐蚀为晶界处或金属—腐蚀介质界面处发生的阳极溶解,甚至会导致表面中心区域的点蚀.由图3(c)可知,在添加缓蚀剂后304L不锈钢表面的腐蚀情况要明显好于未添加缓蚀剂的SS(见图3(b)).观察结果表明,缓蚀剂形成一层保护膜,阻止酸液对合金表面的侵蚀.

图3 304L不锈钢腐蚀形貌照片(200倍)
有机物的吸附在金属腐蚀缓蚀领域有着重要的作用.假定缓蚀剂吸附于金属表面从而减少阳极和/或阴极反应的面积,很多研究者[5]Temkeins吸附等温式来研究缓蚀剂特性.图4为2 mol/L HCl,不同温度下,DCTU在304L不锈钢表面的Temkeins关系曲线,从log C对θ的关系曲线可以看出,符合直线关系,表明缓蚀剂在304L不锈钢表面的吸附符合Temkeins吸附等温式,并且验证了吸附模式为单层吸附,单层吸附导致阳极或阴极反应面积的减少.
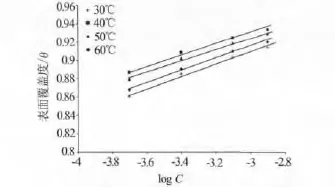
图4 log C对的关系曲线
表2为在2 mol/L HCl添加了0.001 3 mol/L DCTU的腐蚀液中的动力学参数.活化能(Ea),吸附Gibbs自由能(ΔGads)和平衡常数(K)由下式计算所得[5]:
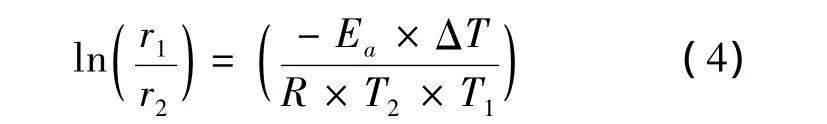
式中,r1和r2分别为温度T1和T2下的腐蚀速率,ΔT为温度差.
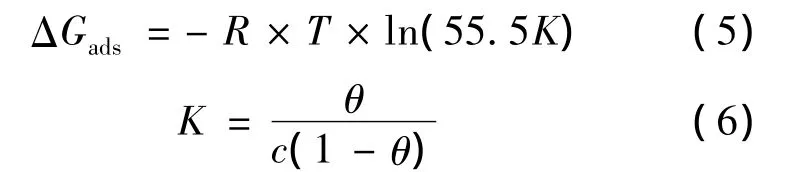
式中,R常用气体常数,55.5为水的浓度(单位:mol/L);θ为覆盖率;C为浓度(单位:mol/L).
表2中ΔGads为负值表明为自发吸附.在添加缓蚀剂的溶液中,Ea值越高,对通过物理吸附引起的腐蚀过程阻碍作用越大.
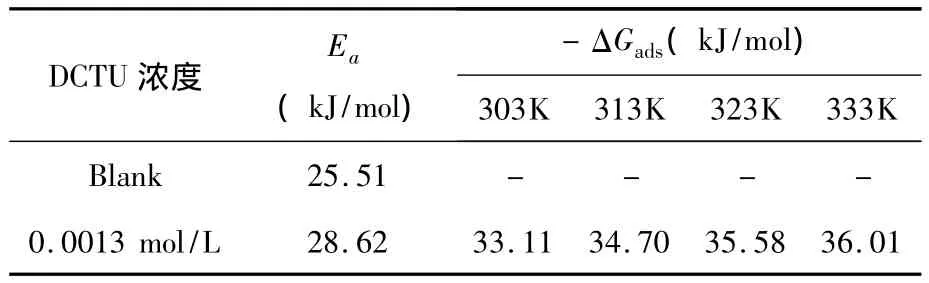
表2 DCTU溶液中腐蚀动力学参数
对于缓蚀过程而言,通常假定缓蚀剂在金属/溶液表面的吸附为其缓蚀机制的第一步.一般来讲,有机分子参与的缓蚀现象涉及到四种吸附类型:①带电分子和带电金属间的静电引力(electrostatic attraction,②分子中未共享电子对与金属的交互作用,③π电子和金属的交互作用,④以上几种作用的组合[5].有机化合物的缓蚀效率取决于多重因素,主要包括活性吸附中心的数目及其电荷密度,分子尺寸以及和金属表面的交互作用模式等.DCTU展示出的高的缓蚀效率可归因于存在一个C=S集团和两个–NH集团,它们均为供电子集团(electron donating groups).同时,由于来自Fe原子的3d电子和硫原子的3d空轨道的叠合形成的dπ–dπ键也会增加化合物的缓蚀效率.
3 结论
304L不锈钢的腐蚀速率在未添加缓蚀剂的情况下随温度升高显著增大.随着二环己基硫脲(DCTU)的加入,304L不锈钢在不同温度下的2 mol/L HCl溶液中缓蚀行为遵循Temkeins吸附等温式,并有物理吸附控制.缓蚀剂的加入同时提高了腐蚀过程的活化激活自由能.
[1]韩亚军,陈友媛.316L不锈钢在不同电导率海水和NaCl溶液中的电化学腐蚀行为[J].材料导报,2012,26(10):57-60.
[2]王丰万,周永璋.常温快速除氧化皮酸洗工艺[J].材料保护,2004,37(4):5-7.
[3]邱海燕,李建波.酸化缓蚀剂的发展现状及展望[J].2005,17(4):255-258.
[4]SHEN C B,WANG S G,YANG H Y,et al.Corrosion Effect of Allylthiourea on Bulk Nanocrystalline Ingot Iron in Diluted acidic Sulphate Solution [J].Electrochim Acta,2007,52:3950-3957.
[5]曹楚南.腐蚀电化学原理[M].北京:化学工业出版社,2004.
