高强度聚焦超声消融兔腹主动脉旁肝肿瘤的安全性和有效性*
2014-07-02刘映江龚春梅
税 莲 何 敏 刘映江 龚春梅 张 炼
高强度聚焦超声消融兔腹主动脉旁肝肿瘤的安全性和有效性*
税 莲 何 敏 刘映江 龚春梅 张 炼
目的:观察高强度聚焦超声消融兔腹主动脉旁肝肿瘤后肝肿瘤剂量学、磁共振图像、病理学及生存期影响,评价HIFU消融兔腹主动脉旁肝肿瘤安全性和有效性。方法:分别于HIFU组(32只)和对照组(20只)实验兔建立腹主动脉旁的VX2肝肿瘤模型,HIFU组瘤兔于MR引导的高强度聚焦超声消融肿瘤,分析腹主动脉旁肿瘤消融剂量学,MR观察消融前后肿瘤影像学变化,病理学观察肿瘤消融后坏死情况,对比观察HIFU组与对照组瘤兔生存期。结果:MRI和病理学均表明MR引导下HIFU能完全消融兔腹主动脉旁VX2肝肿瘤,EEF为25.72±11.40 J/mm3HIFU组的生存期明显高于对照组,差异具有统计学意义(P<0.05)。结论:HIFU能安全有效消融兔腹主动脉旁VX2肝肿瘤并且能明显提高存活期。
高强度聚焦超声 兔 腹主动脉 肝脏肿瘤 磁共振
高强度聚焦超声(high intensity focused ultrasound,HIFU)作为一种新的非侵入性肿瘤治疗技术,能有效破坏靶组织而对靶区周围正常组织无损伤[1-4]。已有研究表明,在单点辐照羊门静脉周围正常肝组织发现距血管距离越近所需能量越高[5]。基于该结果,本文进一步研究大血管的“冷却效应”对HIFU消融的影响。该文通过HIFU完全消融距兔腹主动脉间距<1 cm的肝肿瘤,探讨消融血管旁肿瘤的消融剂量;对比HIFU消融组与对照组瘤兔的生存期,明确HIFU对大血管旁肿瘤消融的生存期影响。
1 材料与方法
1.1 实验动物分组
对照组:新西兰大白兔20只,建立距兔腹主动脉间距<1 cm的肝肿瘤模型后纳入对照组,体重2.0~2.5 kg,雌雄不限,由重庆医科大学动物实验中心提供。实验组:32只瘤兔成功建立距兔腹主动脉间距<1 cm的肝肿瘤模型并完成HIFU消融。
1.2 主要设备和仪器
本研究采用由重庆海扶医疗科技股份有限公司研发的磁共振导航的高强度聚焦超声治疗系统,与Siemens Magnetom Symphony A Tim 1.5T MR系统相匹配。彩色多普勒诊断仪(型号:7300),探头频率为3.5 MHz(意大利百盛公司),重庆海扶医疗科技有限公司提供。眼科镊、止血钳、手术刀等手术器械由重庆医科大学生物医学工程学院提供。
1.3 实验方法
1.3.1 建立腹主动脉旁肝癌模型瘤块制备 将带有VX2肿瘤的瘤兔常规麻醉固定后沿腹中线逐层进入腹腔,剥离肝脏上的肿瘤,取肿瘤边缘鱼肉样组织制成1 mm×2 mm×2 mm大小的瘤块备用。建立模型:将实验兔剑突区域脱毛、麻醉、固定、消毒后,沿剑突下做一纵行切口,逐层进入腹腔,牵拉出肝左中叶,在脏面肝门处植入VX2肿瘤块,压迫止血后将肝脏送回腹腔,逐层缝合。接种后,MRI筛选肿瘤距腹主动脉间距小于1 cm的瘤兔作为实验对象[6]。
1.3.2 HIFU消融 HIFU组成功建模的瘤兔于MR引导下行HIFU消融,实验前12h禁食、禁饮、脱毛,沿兔耳缘静脉予3%戊巴比妥钠溶液1 mL/kg后酒精脱脂、脱气泵脱气、俯卧位固定于HIFU治疗床板上。MR扫描肝脏,定位靶区(图1A),选择肿瘤所在层面,从肿瘤深面到浅面的顺序依次单点辐照。通过MR温度监测靶区温度变化(图1B),当焦点温度>60℃时移动焦点,逐层覆盖肿瘤至完整消融整个肿瘤。
1.3.3 磁共振观察 HIFU组瘤兔于消融前结合MRI图像测量肿瘤-腹主动脉间距及瘤体各径线计算肿瘤的体积,公式为:
V=0.5233×a×b×c[7](a:横径,b:前后径,c:上下径)
分别于HIFU消融前后予增强剂马根维显1 mL/kg,耳缘静脉注射行肝脏MRI动态增强扫描,扫描参数为:FOV:300×300 mm,层厚:3.0 mm,TR:502.0 ms,TE:12.0 ms,对比消融前后肿瘤的坏死情况。
1.3.4 消融后病理学检测 随机抽取HIFU组中瘤兔6只,于HIFU消融后2日处死,取肿瘤置于甲醛溶液中,常规石蜡包埋后HE染色,光镜下观察肿瘤消融情况。
1.3.5 生存期观察 将HIFU消融后的瘤兔与对照组瘤兔在相同条件下饲养至自然死亡,观察两组间瘤兔的生存期,比较HIFU对生存期的影响。
1.4 统计学分析
采用SPSS 17.0软件统计分析,计量资料以x±s表示。采用独立样本t检验进行组间的比较。P<0.05为差异有统计学意义。
2 结果
2.1 血管旁肿瘤消融剂量学
实验组瘤兔肿瘤均完全消融,消融参数见表1。
2.2 肿瘤影像学观察
对比观察消融前后MRI肿瘤图像发现:如图1A、1B所示HIFU消融前肿瘤在T2WI呈高信号,T1WI增强肿瘤呈轻度不均匀强化。HIFU消融后肿瘤T1WI增强呈低信号,无强化(图1C)。

表1 HIFU组肿瘤消融参数Table 1 Ablation results of rabbits with VX2 tumors in the HIFU group
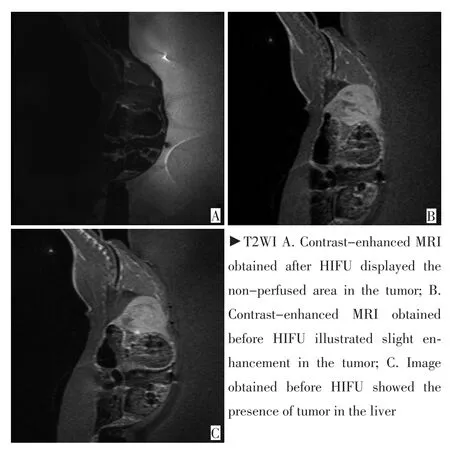
图1 腹主动脉旁兔VX2肿瘤HIFU消融前后MRI对比(白色箭头:肿瘤)Figure 1 MRI contrast of a rabbit VX2 tumor near the abdominal aorta tumor before and after HIFU ablation(white arrow:tumor)
2.3 病理学观察
HIFU消融后肿瘤成乳白色,质地变硬(图2A),与消融前肿瘤差异较大(图2B)。消融后肿瘤细胞胞质红染,细胞核溶解消失、偶尔可见核碎片(图2C)。对比消融前后肿瘤细胞HE染色变化:消融前,肿瘤细胞核大,深染,胞质比例失调(图2D)。消融后腹主动脉无明显损伤,光镜下,血管壁完整,弹力纤维排列整齐,内膜连续性好,血管内皮无坏死、细胞脱落,血管内未见血栓形成,周围组织未见细胞肿胀、脱落(图3)。

图2 消融前后肿瘤病理学对比Figure 2 Pathological comparison of the tumor before and after HIFU ablation

图3 HIFU组消融后腹主动脉(H&E×400)Figure 3 Abdominal aortic pathology after tumor ablation(H&E×400)
2.4 生存期比较
对照组20只实验兔其中2只在建模后急性期死亡,余下瘤兔均成功建立模型。建模成功率为90.0%。HIFU组中余26只,急性期死亡3只,余23只,与对照组18只均继续饲养,观察生存期(表2)。

表2 HIFU组与对照组生存期对比Table 2 Comparison of survival between the HIFU and control groups
3 讨论
目前高强度聚焦超声因其无创性,可重复性,在实体肿瘤的治疗应用逐渐广泛。由于肝脏部分肝叶位置的特殊性,如肋骨遮挡、靠近大血管等,使得各种局部治疗方法都有一定局限性[8]。早期高强度聚焦超声治疗肝癌,需切除肋骨开放声通道[9]。随着HIFU基础研究和临床研究的发展,通过调整治疗参数,优化治疗剂量,如今HIFU治疗肝癌是无需切除肋骨,解除了患者手术痛苦,缩短治疗时间。
剂量学研究主要为了避免HIFU治疗中过多投放剂量,导致正常组织损伤过度,从而指导HIFU的临床治疗。同时剂量学的影响因素较多,如声通道上的组织密度,消融病灶质地、血供以及超声本身发生的折射、反射等影响因素[10]。因此,剂量学的研究需结合其众多影响因素综合评估。本研究着重于MR引导下HIFU消融大血管旁肝肿瘤模拟临床大血管旁肝癌肿瘤的消融。通过MR实时测温系统,根据病灶位置温度变化情况,移动靶点,避免了消融中能量在某些区域过度沉积、扩散损伤周围正常组织。尽管,本研究模拟临床肝癌的消融过程但由于本研究中采用的肝肿瘤是兔VX2肿瘤,其本身质地、血供等情况与临床肝肿瘤仍存在一定的差异性。
本研究通过影像学和病理学方面评价了HIFU的消融效果。通过病理学检测消融前后肿瘤的灭活情况,进一步说明HIFU消融大血管旁肿瘤的有效性。比较HIFU组与对照组瘤兔生存期发现,HIFU组的生存期高于对照组。对照组的瘤兔在接种后第28天开始出现肝内转移,第35天出现肝内及肠系膜转移,第42天肺转移,其主要死亡原因考虑为肿瘤广泛转移。HIFU组瘤兔肿瘤完全消融后,使肿瘤灭活,推迟了肿瘤转移,延长了瘤兔的存活期。其中,HIFU组急性期死亡的瘤兔可能由于消融参数不合适,投放能量过多导致正常肝组织大范围损伤所致。后期实验通过调整消融时间及投放剂量后提高了瘤兔的存活率。高强度聚焦超声能安全有效的完全消融大血管旁肿瘤并延长生存期。
1 Zhang L,Wang ZB.High-intensity focused ultrasound tumor ablation:review of ten years of clinical experience[J].Front Med China, 2010,4(3):294-302.
2 Dobrotwir A,Pun E.Clinical 24 month experience of the first MRg-FUS unit for treatment of uterine fibroids in Australia[J].J Med Imaging Radiation Oncol,2012,56(4):409-416.
3 Khokhlova TD,Hwang JH.HIFU for palliative treatment of pancreatic cancer[J].J Gastrointest Oncol,2011,2(3):175-184.
4 Chen W,Zhu H,Zhang L,et al.Primary bone malignancy:effective treatment with high-intensity focused ultrasound ablation[J]. Radiology,2010,255(3):967.
5 Jiang F,HE M,Liu YJ,et al.High intensity focused ultrasound ablation of goat liver in vivo:Pathologic changes of portal vein and the "heat-sink"effect[J].Ultrasonics,2013,53(1):77-83.
6 Shui L,He M,Liu YJ,et al.Establishment of rabbit models of VX2 liver tumor adjacent to abdominal aorta[J].Chinese journal of interventional imaging and therapy,2013,10(10):629-632.[税 莲,何敏,刘映江,等.建立兔靠近腹主动脉VX2肝癌模型[J].中国介入影像与治疗学,2013,10(10):629-632.]
7 Janik P,Briand P,Hartmann NP.The Effect of estrone-progesterone Treatment on Cell Proliferation kinetics of hormone-dependent GR mouse mammary tumors[J].Cancer Res,1975,35(12):3698-3704.
8 Zhu H,Chen WZ,Wu F,et al.Clinical Research on High Intensity Focused Ultrasound Treatment for Residual Hepatic Tumor after Radiofrequency Treatment[J].Chinese Journal of Clinical Oncology,2007,34(19):1081-1084.[朱 辉,陈文直,伍 烽,等.高强度聚焦超声对射频消融后肝癌残余病灶的治疗[J].中国肿瘤临床,2007, 34(19):1081-1084.]
9 Zhu H,Zhou K,Zhang L,et al.High intensity focused ultrasound (HIFU)therapy for local treatment of hepatocellular carcinoma:role of partial rib resection[J].Eur J Radiol,2009,72(1):160-166.
10 Chen JY,Chen WZ.Doppler flow imaging characteristics of blood supply of uterine fibroids on the therapeutic dosage of ultrasound ablation[J].Chinese Journal of Obstetrics and Gynecology,2011,46 (6):403-406.[陈锦云,陈文直.子宫肌瘤的血液供应特征对超声消融治疗剂量的影响[J].中华妇产科杂志,2011,46(6):403-406.]
(2014-07-14收稿)
(2014-09-21修回)
(本文编辑:周晓颖)
Safety and effectiveness of high-intensity focused ultrasound ablation for liver tumor adjacent to rabbit abdominal aorta
Lian SHUI,Min HE,Yingjiang LIU,Chunmei GONG,Lian ZHANG
This work was supported by the National Key Basic Research and Development Plan(No.2011CB707900),The National Science &Technology Pillar Program during the Twelfth Five-year Plan Period(No.2011BAI14B01)and the Chongqing Natural Science Foundation(No.cstc2013jcyjA10109,cstc2011jjA10033,cstc2012jjA10083)
Lian ZHANG;E-mail:lianwzhang@yahoo.com
Objective:To evaluate the safety and efficacy of high-intensity focused ultrasound(HIFU)ablation for the VX2 liver tumor near the hepatic main blood vessels of rabbits by using dosimetry and magnetic resonance imaging(MRI)and by analyzing pathological changes and survival.Methods:Rabbits with VX2 liver tumor adjacent to the abdominal aorta were divided into the HIFU(n= 32)and control groups(n=20).MRI-guided HIFU was employed for the ablation of the liver tumor in the HIFU group.The ablation volume and the energy efficiency factor(EEF)of the 32 ablated rabbits were further analyzed.MRI and pathology were used to compare the changes in the tumor before and after HIFU.The survival of the animals in the HIFU and control groups was also determined.Results:Both pathology and imaging showed that the rabbit liver VX2 tumor adjacent to the abdominal aorta was completely ablated, with an EEF of(25.72±11.40)J/mm3.The survival rate was significantly higher in the HIFU group than in the control group(P<0.05).Conclusion:HIFU ablation is safe and effective in rabbit VX2 liver tumor near the abdominal aorta.This approach significantly increases survival.
high-intensity focused ultrasound,rabbit,abdominal aorta,liver neoplasm,magnetic resonance

10.3969/j.issn.1000-8179.20141176
重庆医科大学生物医学工程学院,省部共建国家重点实验室培育基地-重庆市超声医学工程重点实验室,重庆市生物医学工程学重点实验室(重庆市400016)
*本文课题受国家重点基础研究发展计划(编号:2011CB707900)、十二五科技支撑计划(编号:2011BAI14B01)和重庆市自然科学基金(编号:cstc2013jcyjA10109、cstc2011jjA10033、cstc2012jjA10083)资助
张炼 lianwzhang@yahoo.com
State Key Laboratory of Ultrasound Engineering in Medicine Co-Founded by Chongqing and the Ministry of Science and Technology, College of Biomedical Engineering,Chongqing Key Laboratory of Biomedical Engineering;Chongqing Medical University
税莲 专业方向为肿瘤无创治疗。
E-mail:shuilian815@163.com
