血栓心脉宁对β-淀粉样蛋白致大鼠老年性痴呆的治疗作用
2014-06-27方圣博谢湘林刘宏雁
方圣博,谢湘林,刘 蕾,杜 冰,刘宏雁
(吉林大学药学院药理学教研室,吉林长春 130021)
血栓心脉宁对β-淀粉样蛋白致大鼠老年性痴呆的治疗作用
方圣博,谢湘林,刘 蕾,杜 冰,刘宏雁
(吉林大学药学院药理学教研室,吉林长春 130021)
目的:观察血栓心脉宁对β-淀粉样蛋白(Aβ)致老年性痴呆(AD)大鼠行为学及大脑皮层和海马组织结构的影响,探讨血栓心脉宁对大鼠AD的治疗作用。方法:选取100只雄性Wistar大鼠,按体质量将大鼠随机分为假手术组、模型组、阳性药组(盐酸多奈哌齐,1.75 mg·kg-1)和血栓心脉宁1.1、2.2 g·kg-1剂量组。连续灌胃给药15 d。大鼠海马定位注射Aβ建立大鼠AD模型。进行Morris水迷宫试验、避暗及病理学实验。结果:水迷宫试验,与模型组比较,血栓心脉宁1.1 g·kg-1剂量组大鼠第2、4和5天到达平台的潜伏期和游程明显缩短(P<0.05或P<0.01);血栓心脉宁2.2 g·kg-1剂量组大鼠第3~6天到达平台的潜伏期缩短(P<0.05或P<0.01),第3~5天到达平台的游程明显缩短(P<0.05或P<0.01);第7天血栓心脉宁各剂量组大鼠在90 s内经过平台的次数、平台停留时间、平台区停留距离、有效区停留时间、有效区停留距离、平台停留时间/总时间、平台停留距离/总路程和有效区停留时间/总时间均明显增加(P<0.05或P<0.01)。避暗实验中,与模型组比较,血栓心脉宁各剂量组大鼠第2天的错误潜伏期及错误次数无显著差异(P>0.05)。病理学观察,血栓心脉宁各剂量组大鼠与模型组比较其病理学表现无明显差异,大脑皮层神经细胞有变性、坏死;海马神经细胞数少,层次不清楚,可见变性、坏死细胞。结论:血栓心脉宁可改善AD大鼠的学习记忆功能,但对其病理学病变无明显改善作用。
血栓心脉宁;老年性痴呆;β-淀粉样蛋白;大鼠,Wistar
血栓心脉宁的主要成分是丹参、川芎、毛冬青、水蛭、槐花、麝香、冰片、牛黄、人参茎叶皂苷和蟾酥等,因其具有开窍醒神、活血化瘀功效而广泛应用于心脑血管疾病的治疗[1]。老年性痴呆又称为阿尔茨海默症(Alzheimer’s disease,AD),是一种不可逆的神经退行性疾病,主要表现为学习记忆障碍[2]。血栓心脉宁对AD是否有治疗作用,国内文献尚未见报道。大量研究[3-5]表明:血栓心脉宁具有很好的抗自由基氧化损伤、降低丙二醛(malonic dialdehyde,MDA)水平、改善循环和抑制血栓形成等作用,这些作用机制与AD的发病机制有部分关联[6]。认知功能障碍和学习记忆能力下降是AD最主要的表现。本实验通过行为学(水迷宫、避暗)和病理学实验观察血栓心脉宁对AD大鼠的治疗作用,为其临床应用提供实验依据。
1 材料与方法
1.1 实验动物、主要药品和仪器100只清洁级Wistar雄性大鼠,体质量300~350 g,合格证号: SCXK-(吉)2007-0003,由吉林大学实验动物中心提供。血栓心脉宁(吉林华康药业股份有限公司提供,批号:110901),盐酸多奈哌齐(西安海欣制药有限公司,批号:111212A),β-淀粉样蛋白25-35(amyloidβprotein 25-35,Aβ25-35)(美国Sigma公司,批号:20110929)。Morris水迷宫及避暗装置(成都泰盟科技有限公司产品),单臂脑立体定位仪(深圳市瑞沃德生命科技有限公司,型号68001)。
1.2 实验方法在手术前随机选取假手术组15只大鼠,再按文献[7]制备大鼠AD模型。将腹腔注射10%水合氯醛(0.3 m L·100 g-1)的麻醉大鼠固定于立体定位仪上,头顶皮肤做正中竖切口,暴露顶骨。海马区定位坐标:前囟后3.5 mm,中线外侧2.0 mm,硬脑膜下2.7 mm。每侧用微量注射器分别注入5μL(10μL)聚集肽的Aβ25-35,5 min内注完,注射后留针5 min,以免拔针时药物溢出。假手术组手术方法相同,注射同体积的生理盐水。术后14 d将AD大鼠按体质量随机分为模型组、阳性药组(盐酸多奈哌齐,1.75 mg·kg-1)、血栓心脉宁1.1和2.2 g·kg-1剂量组,每组10只。连续灌胃给药(每日1次),15 d后进行水迷宫试验,实验期间继续给药。由于感染等原因,动物有死亡,各组大鼠例数不一致。水迷宫试验连续7 d,前6 d在1、2、3、4象限4个不同的入水点测定大鼠到达平台的潜伏期、游程、朝向角及平均速度;第7天撤掉平台,测定大鼠在90 s内经过平台次数、经过有效区次数、平台停留时间、平台区停留距离、有效区停留时间、有效区停留距离、平台停留时间/总时间、平台停留距离/总路程、有效区停留时间/总时间和有效区停留距离/总路程。水迷宫试验结束后,进行避暗实验,记录大鼠第2天进入暗箱潜伏期和大鼠被电击的次数(即错误次数)。行为学测定后,快速取鼠脑,10%甲醛固定,常规制备组织病理切片,观察其大脑皮层和海马组织的病理学变化。
1.3 统计学分析采用SPSS 18.0软件包进行统计处理。Morris水迷宫试验第1~6天大鼠到达平台潜伏期、游程、朝向角及平均速度,第7天大鼠在90 s内经过平台次数、经过有效区次数、平台停留时间、平台区的停留距离、有效区的停留时间、有效区的停留距离、平台停留时间/总时间、平台停留距离/总路程、有效区停留时间/总时间和有效区停留距离/总路程,避暗实验大鼠第2天进入暗箱潜伏期和错误次数均以±s表示,组间比较采用单因素方差分析。
2 结果
2.1 各组大鼠Morris水迷宫试验与假手术组比较,模型组大鼠第1~6天到达平台的潜伏期明显延长(P<0.05或P<0.01),见表1;第2~5天到达平台的游程明显延长(P<0.05或P<0.01),见表2;第1~6天的朝向角及游泳速度均无明显变化(P>0.05),见表3和4;第7天血栓心脉宁1.1和2.2 g·kg-1剂量组大鼠在90 s内经过平台经过次数、经过有效区次数、平台停留时间、平台停留距离、有效区停留时间、有效区停留距离和平台停留时间/总时间明显缩短(P<0.05),见表5。
与模型组比较,阳性药组大鼠在第5、6天到达平台的潜伏期明显缩短(P<0.05),第1~4天到达平台潜伏期有缩短的趋势,但差异无统计学意义(P>0.05),见表1;第5天到达平台游程明显缩短(P<0.05),第1~4天及第6天达平台的游程有缩短趋势,但差异无统计学意义(P>0.05),见表2;第6天的朝向角明显降低(P<0.05),见表3;第1~6天的游泳速度无明显变化,见表4; 第7天阳性药组大鼠90 s内在有效区停留时间明显延长(P<0.05),经过平台次数、平台停留时间、平台停留距离、有效区停留距离、平台停留时间/总时间、平台停留距离/总路程、有效区停留时间/总时间、有效区停留距离/总路程均有增加的趋势,但差异均无统计学意义(P>0.05);经过有效区次数无明显变化(P>0.05),见表5。与模型组比较,血栓心脉宁1.1 g·kg-1剂量组大鼠第2、4 和5天到达平台的潜伏期和游程均明显缩短(P<0.05或P<0.01),第3及6天有降低的趋势,但差异无统计学意义(P>0.05),见表1和2;第1~6天游泳速度及朝向角无明显变化(P>0.05),见表3和4。与模型组比较,血栓心脉宁2.2 g·kg-1剂量组大鼠第3~6天到达平台潜伏期明显缩短(P<0.05或P<0.01),第2天有降低的趋势,但差异无统计学意义(P>0.05),见表1; 第3~5天到达平台游程明显缩短(P<0.05或P<0.01),第2及6天有缩短的趋势,但差异无统计学意义(P>0.05),见表2;第1~6天游泳速度及朝向角无明显变化,见表3和4。第7天血栓心脉宁1.1和2.2 g·kg-1剂量组大鼠在90 s内经过平台次数、平台停留时间、平台停留距离、有效区停留时间、有效区停留距离、平台停留时间/总时间、平台停留距离/总路程、有效区停留时间/总时间明显增加(P<0.05或P<0.01);经过有效区次数、有效区停留距离/总路程无明显变化(P>0.05)。见表5。
2.2 各组大鼠避暗实验与假手术组比较,第2天模型组大鼠错误潜伏期明显缩短(P<0.05),错误次数明显增加(P<0.05)。与模型组比较,阳性药组及血栓心脉宁各剂量组大鼠第2天的错误潜伏期及错误次数差异无统计学意义(P>0.05)。见表6。
2.3 各组大鼠病理形态学与假手术组比较,模型组大鼠大脑皮层神经细胞有变性、坏死、噬神经细胞和水肿现象;模型组海马神经细胞数少,层次不清楚,可见较多的变性、坏死和水肿细胞。与模型组比较,阳性药组及血栓心脉宁各剂量组大鼠大脑皮层及海马无明显变化。见图1和2(插页四)。
表1 各组大鼠水迷宫试验的潜伏期Tab.1 Latency of Morris water maze test of rats in various groups(±s,t/s)
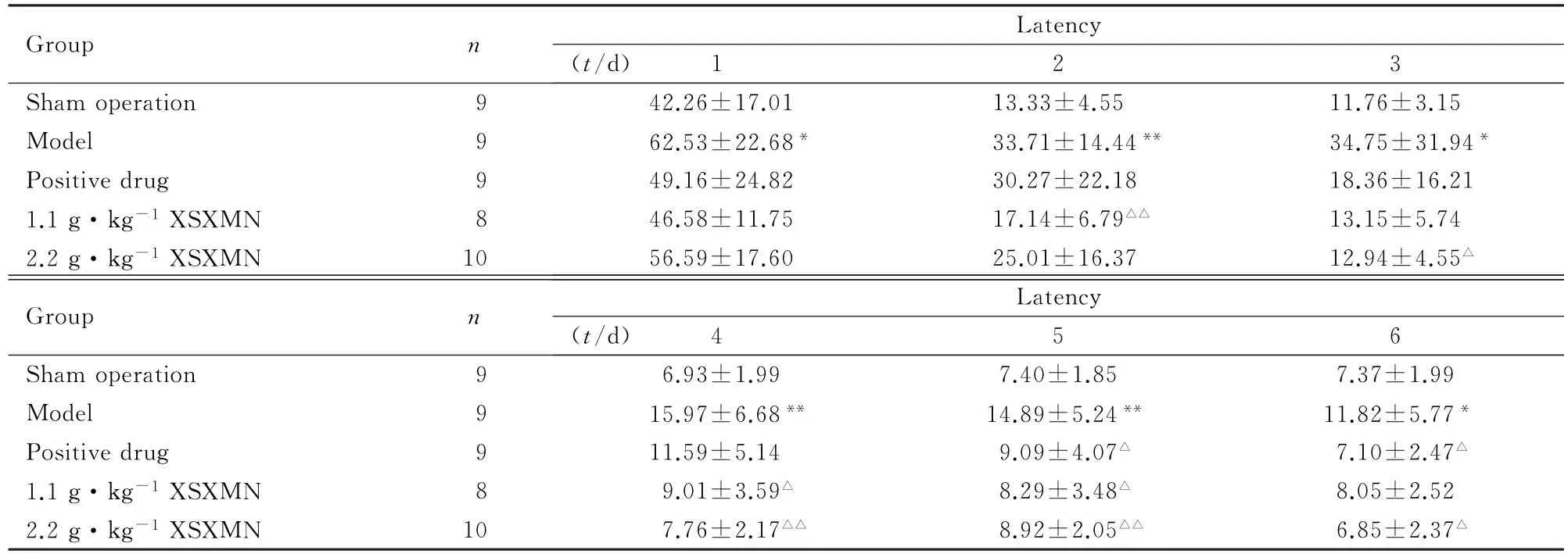
表1 各组大鼠水迷宫试验的潜伏期Tab.1 Latency of Morris water maze test of rats in various groups(±s,t/s)
∗P<0.05,∗∗P<0.01 vs sham operation group;△P<0.05,△△P<0.01 vs model group.
Group n Latency (t/d) 1 2 3 Sham operation 9 42.26±17.01 13.33±4.55 11.76±3.15 Model 9 62.53±22.68∗33.71±14.44∗∗34.75±31.94∗Positive drug 9 49.16±24.82 30.27±22.18 18.36±16.21 1.1 g·kg-1XSXMN 8 46.58±11.75 17.14±6.79△△13.15±5.74 2.2 g·kg-1XSXMN 10 56.59±17.60 25.01±16.37 12.94±4.55△Group n Latency (t/d) 4 5 6 Sham operation 9 6.93±1.99 7.40±1.85 7.37±1.99 Model 9 15.97±6.68∗∗14.89±5.24∗∗11.82±5.77∗Positive drug 9 11.59±5.14 9.09±4.07△7.10±2.47△1.1 g·kg-1XSXMN 8 9.01±3.59△8.29±3.48△8.05±2.52 2.2 g·kg-1XSXMN 10 7.76±2.17△△8.92±2.05△△6.85±2.37△
表2 各组大鼠Morris水迷宫试验的游程Tab.2 Swimming distances of Morris water maze test of rats in various groups(±s,l/cm)
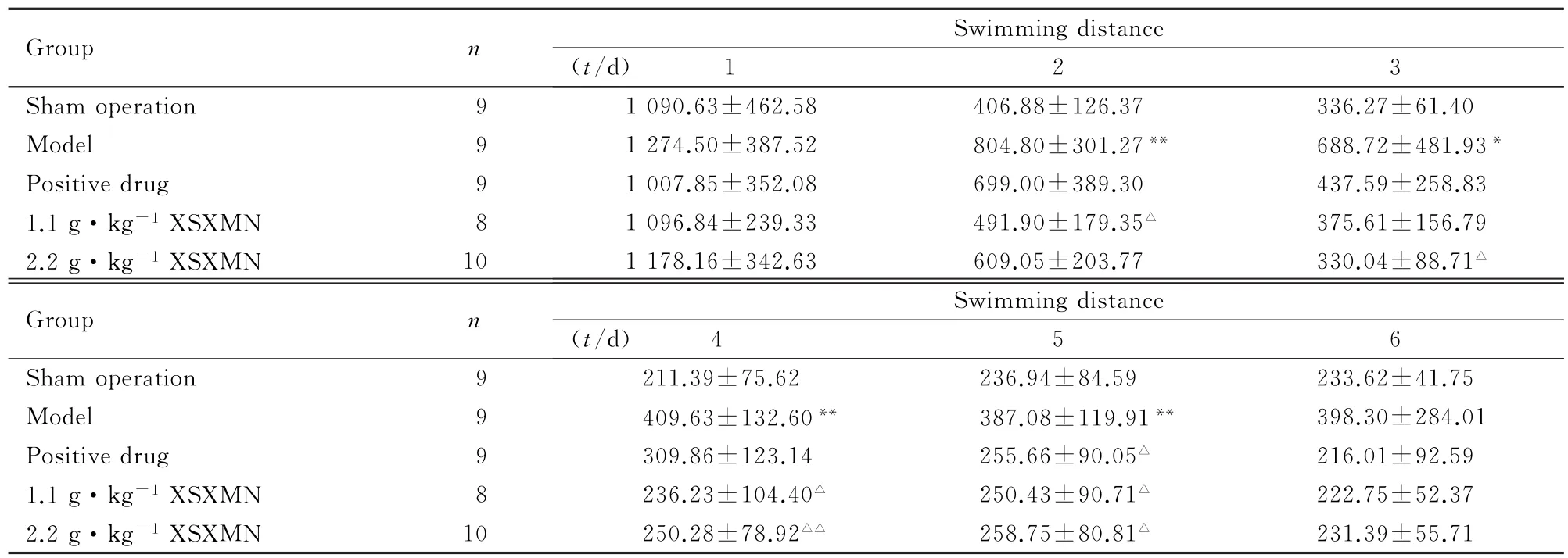
表2 各组大鼠Morris水迷宫试验的游程Tab.2 Swimming distances of Morris water maze test of rats in various groups(±s,l/cm)
∗P<0.05,∗∗P<0.01 vs sham operation group;△P<0.05,△△P<0.01 vs model group.
Group n Swimming distance (t/d) 1 2 3 Sham operation 9 1 090.63±462.58 406.88±126.37 336.27±61.40 Model 9 1 274.50±387.52 804.80±301.27∗∗688.72±481.93∗Positive drug 9 1 007.85±352.08 699.00±389.30 437.59±258.83 1.1 g·kg-1XSXMN 8 1 096.84±239.33 491.90±179.35△375.61±156.79 2.2 g·kg-1XSXMN 10 1 178.16±342.63 609.05±203.77 330.04±88.71△Group n Swimming distance (t/d) 4 5 6 Sham operation 9 211.39±75.62 236.94±84.59 233.62±41.75 Model 9 409.63±132.60∗∗387.08±119.91∗∗398.30±284.01 Positive drug 9 309.86±123.14 255.66±90.05△216.01±92.59 1.1 g·kg-1XSXMN 8 236.23±104.40△250.43±90.71△222.75±52.37 2.2 g·kg-1XSXMN 10 250.28±78.92△△258.75±80.81△231.39±55.71
表3 各组大鼠水迷宫试验的朝向角Tab.3 Starting angles of Morris water maze test of rats in various groups(±s,θ/°)
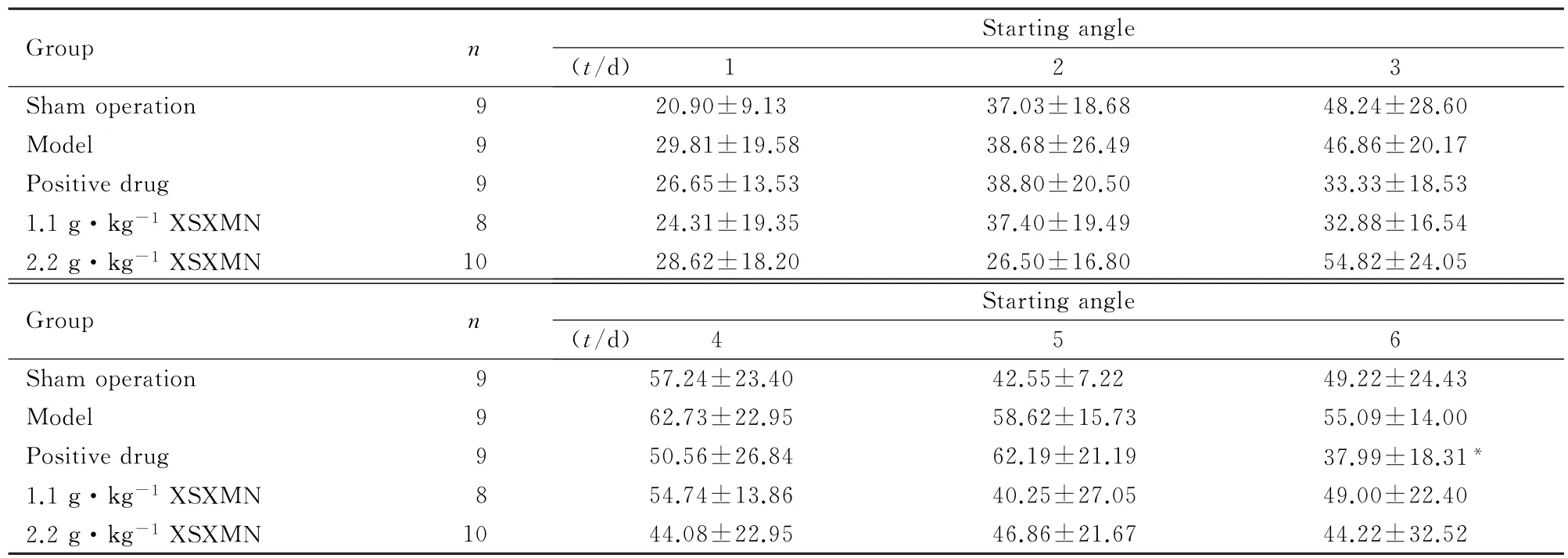
表3 各组大鼠水迷宫试验的朝向角Tab.3 Starting angles of Morris water maze test of rats in various groups(±s,θ/°)
∗P<0.05 vs model group.
Group n Starting angle (t/d) 1 2 3 Sham operation 9 20.90±9.13 37.03±18.68 48.24±28.60 Model 9 29.81±19.58 38.68±26.49 46.86±20.17 Positive drug 9 26.65±13.53 38.80±20.50 33.33±18.53 1.1 g·kg-1XSXMN 8 24.31±19.35 37.40±19.49 32.88±16.54 2.2 g·kg-1XSXMN 10 28.62±18.20 26.50±16.80 54.82±24.05 Group n Starting angle (t/d) 4 5 6 Sham operation 9 57.24±23.40 42.55±7.22 49.22±24.43 Model 9 62.73±22.95 58.62±15.73 55.09±14.00 Positive drug 9 50.56±26.84 62.19±21.19 37.99±18.31∗1.1 g·kg-1XSXMN 8 54.74±13.86 40.25±27.05 49.00±22.40 2.2 g·kg-1XSXMN 10 44.08±22.95 46.86±21.67 44.22±32.52
表4 各组大鼠水迷宫试验的平均速度Tab.4 Average speeds of Morris water maze test of rats in various groups[±s,v/(cm·s-1)]

表4 各组大鼠水迷宫试验的平均速度Tab.4 Average speeds of Morris water maze test of rats in various groups[±s,v/(cm·s-1)]
Group n Average speed (t/d) 1 2 3 Sham operation 9 29.82±4.64 32.27±4.54 31.38±7.72 Model 9 21.83±3.83 27.99±4.18 27.34±4.82 Positive drug 9 26.49±6.74 29.76±7.61 34.24±11.28 1.1 g·kg-1XSXMN 8 25.33±4.49 31.82±5.66 35.70±11.64 2.2 g·kg-1XSXMN 10 22.73±4.92 32.65±9.33 25.91±7.34 Group n Average speed (t/d) 4 5 6 Sham operation 9 29.57±6.75 33.48±7.73 35.02±9.67 Model 9 27.36±4.81 27.35±6.05 28.33±4.97 Positive drug 9 27.75±4.31 58.62±10.91 30.80±5.00 1.1 g·kg-1XSXMN 8 26.60±5.58 33.66±15.73 29.90±9.30 2.2 g·kg-1XSXMN 10 34.86±9.86 29.30±6.06 39.73±14.93
表5 各组大鼠水迷宫试验第7天的各项指标Tab.5 Each index of Morris water maze test of rats on the 7th day in various groups(±s)

表5 各组大鼠水迷宫试验第7天的各项指标Tab.5 Each index of Morris water maze test of rats on the 7th day in various groups(±s)
∗P<0.05,∗∗P<0.01 vs sham operation group;△P<0.05,△△P<0.01 vs model group.
Group n Times of passing platform Times of passing effective area Distance of staying on platform(l/cm) Duration of staying on platform(t/s) Distance of staying in effective area(l/cm) Sham operation 9 5.78±1.86 6.80±82.89 88.21±37.41 2.95±1.34 684.92±153.36 Model 9 3.33±2.00∗4.33±2.12∗50.25±30.24∗1.76±0.96∗446.59±240.27∗Positive drug 9 5.78±2.91 4.00±2.12 84.83±59.31 3.88±3.07 604.20±125.06 1.1 g·kg-1XSXMN 8 6.00±2.00△5.25±2.49 91.28±31.79△3.77±1.43△△658.08±151.51△2.2 g·kg-1XSXMN 10 5.00±1.25△5.80±2.25 78.62±12.04△3.35±0.82△△595.80±175.16△Group n Duration of staying in effective area(t/s) Duration of staying on platform/Total time Duration of staying in effective area/Total time Distance of staying in effective area/Total distance Distance of staying on platform/Total distance Sham operation 9 25.19±7.30 0.03±0.02 0.28±0.08 0.29±0.05 0.04±0.02 Model 9 16.45±6.83∗0.02±0.01∗0.20±0.10 0.23±0.10 0.03±0.01 Positive drug 9 25.77±7.30△0.04±0.03 0.29±0.08 0.30±0.07 0.04±0.03 1.1 g·kg-1XSXMN 8 27.31±6.18△△0.04±0.02△△0.30±0.07△0.31±0.07 0.04±0.02△2.2 g·kg-1XSXMN 10 25.22±5.92△0.03±0.01△0.28±0.06△0.28±0.10 0.04±0.01△
表6 各组大鼠避暗实验结果Tab.6 Results of dark avoidance task of rats in various groups(±s)

表6 各组大鼠避暗实验结果Tab.6 Results of dark avoidance task of rats in various groups(±s)
∗P<0.05 vs sham operation group.
Group n Latency(t/s)Error times Sham operation 9 272.55±32.98 0.55±0.53 Model 9 173.67±120.31∗2.44±2.45∗Positive drug 9 211.78±114.40 1.11±1.05 1.1 g·kg-1XSXMN 8 221.00±115.45 3.38±4.21 2.2 g·kg-1XSXMN 10 182.40±115.47 2.10±2.61
3 讨论
Morris水迷宫是用来测查动物空间学习记忆能力的主要方法,其实验原理是收集与空间定位有关的视觉信息,然后对信息进行整理、记忆、加固和提取,使大鼠找到水下隐藏的平台而从水中逃脱[8]。Morris水迷宫测试程序可分为定位航行实验和空间探索实验[9],定位航行实验考察动物的学习能力;空间探索实验主要考察动物的空间记忆能力。本研究结果显示:与模型组比较,血栓心脉宁各剂量组大鼠在前6 d定位航行实验中,到达平台潜伏期和游程有不同程度的缩短,第7天空间探索实验中测试的多项指标亦显著提高,提示血栓心脉宁可改善AD大鼠空间学习记忆能力,其改善作用可能与丹参、川芎和人参等组分相互作用有关。
避暗实验是利用啮齿类动物趋暗避明的生理习性设计的,可反映动物被动回避能力。本研究避暗实验结果显示:与模型组比较,血栓心脉宁各剂量组大鼠第2天的错误潜伏期及错误次数无显著差异,提示血栓心脉宁对AD大鼠的被动回避能力无明显改善作用。本研究中光镜下病理学观察显示:与模型组比较,血栓心脉宁各剂量组大鼠皮层和海马组织结构无明显改善。
学习记忆能力下降,特别是空间学习记忆能力的降低,严重影响了AD患者的生存质量,给家庭和社会带来巨大的负担。本研究证实血栓心脉宁对AD大鼠的空间学习记忆能力有明显改善作用,如能应用于AD患者,可增强患者的方向感和位置感,具有重大意义。
AD发病机制主要包括Aβ毒性学说、Tau蛋白、炎症机制、中枢胆碱能损伤、自由基与氧化应激学说、钙稳态失调、脂质代谢异常、线粒体功能紊乱和血管因素等[10-13]。其中Aβ毒性学说占有非常重要的地位。Aβ具有神经毒性作用,可引起神经细胞钙紊乱和炎症反应,诱导神经细胞产生氧自由基,改变细胞膜的离子通道、形成Aβ通道,影响能量代谢,增强氧化应激敏感性而加重脑组织损伤[14-16],各个环节相互影响,特别是Aβ与氧化应激呈正反馈作用。有研究[17-19]显示:血栓心脉宁能降低MDA和LPO水平,升高SOD及GSH-Px活性,减轻自由基的氧化损伤。本研究通过行为学实验证实血栓心脉宁可改善AD大鼠的空间学习记忆能力,对AD有治疗作用,其作用机制可能与其提高抗自由基相关酶和减少自由基氧化损伤有关,血栓心脉宁对AD治疗作用的确切机制有待于进一步探讨。
[1]杨小霞,李国前,王杰华,等.血栓心脉宁片对大鼠脑缺血再灌注肿瘤坏死因子-α的影响[J].中西医结合心脑血管病杂志,2011,9(11):1363-1364.
[2]孙 亮,陈 彪.阿尔茨海默病血浆诊断标志物研究进展[J].中国实用内科杂志,2012,32(5):383-385.
[3]刘建伟,曲绍春,于晓风,等.血栓心脉宁片对大鼠实验性脑缺血的保护作用[J].中西医结合心脑血管病杂志,2011, 9(3):333-334.
[4]郭清军.血栓心脉宁片对急性心肌梗死患者再灌注后心肌和微血管的保护性研究[J].中西医结合心脑血管病杂志, 2008,6(9):1019-1020.
[5]王 宏,曲绍春,于晓风,等.血栓心脉宁片对急性血瘀模型大鼠血小板功能和血液流变学的影响[J].中国老年学杂志,2010,30(11):3335-3337.
[6]贾建平,刘江红.阿尔兹海默病发病机制及治疗进展[J].中国现代神经疾病杂志,2010,10(1):43-48.
[7]刘宏雁,谢湘林,邹洪斌,等.盐酸多奈哌齐对β-淀粉样蛋白致老年性痴呆大鼠的治疗作用[J].中国老年学杂志, 2007,27(2):135-137.
[8]王俊亚,张冬梅.水迷宫试验的测试方法介绍及注意事项[J].现代医药卫生,2012,28(21):3289-3290.
[9]封 敏,卢圣锋,张承舜,等.国内大鼠Morris水迷宫试验现状与分析[J].辽宁中医杂志,2011,38(11):2170-2172.
[10]Liu Y,Hua Q,Lei H,et al.Effect of Tong Luo Jiu Nao on Aβ-degrading enzymes in AD rat brains[J].J Ethnopharmacol,2011,137(2):1035-1046.
[11]Martin L,Latypova X,Wilson CM,et al.Tau protein kinases:Involvement in Alzheimer’s disease[J].Ageing Res Rev,2013,12(1):289-309.
[12]侯宛褀,戴雪伶,姜招峰.炎性因子与阿尔茨海默病[J].生命科学,2013,25(11):1071-1076.
[13]孔艳艳,管一晖,郑 平.阿尔茨海默病发病机制与诊断治疗方法关联性研究进展[J].中国临床神经科学,2012, 20(4):452-456,474.
[14]刘文娟,戴雪伶,姜招峰.β-淀粉样蛋白神经毒性及其防治策略[J].生命科学,2011,23(10):1022-1026.
[15]孙婧霞,陈 雪,蒋常文.Aβ寡聚体与阿尔茨海默病的研究进展[J].临床医学工程,2012,19(12):2274-2276.
[16]刘晓杰,杨 威,祁金顺.氧化应激与阿尔茨海默病[J].生理学报,2012,64(1):87-95.
[17]赵星宇,睢大员,于晓风,等.血栓心脉宁片对大鼠急性心肌梗死的保护作用及其机制[J].中西医结合心脑血管病杂志,2008,6(2):177-179.
[18]张晓天,王 凯,周晓辉,等.血栓心脉宁片对急性血瘀大鼠血浆NO/ET-1的影响[J].中国实验诊断学,2012, 32(9):1575-1577.
[19]田涛涛,张玉莲,崔远武,等.针灸对照西药治疗老年性痴呆疗效的系统评价[J].长春中医药大学学报,2012, 29(1):48-50.
Therapeutic effect of XueShuanXin MaiNing on rats with Alzheimer’s disease induced byβamyloid protein
FANG Sheng-bo,XIE Xiang-lin,LIU Lei,DU Bing,LIU Hong-yan
(Department of Pharmacology,School of Pharmacy,Jilin University,Changchun 130021,China)
ObjectiveTo observe the influence of XueShuan Xin MaiNing(XSXMN)in the behavior and structures of cerebral cortex and hippocampus of the rats withβamyloid protein(Aβ)-induced Alzheimer’s disease(AD),and to explore its therapeutic effects on the rat AD.Methods100 male Wistar rats were selected.According to weight, the rats were randomly divided into sham operation group,model group,positive drug group(donepezil hydrochloride,1.75 mg·kg-1),XSXMN 1.1 g·kg-1group and XSXMN 2.2 g·kg-1group.The rat AD models were made by injecting Aβinto hippocampus.After oral administration for 15 d,Morris water maze test, dark avoidance task and pathology test were performed.ResultsIn Morris water maze test,compared with model group,the latency and swimming distance to platform of the rats in XSXMN 1.1 g·kg-1group were decreased on the 2nd,4th and 5th day(P<0.05 or P<0.01);in XSXMN 2.2 g·kg-1group,the latency to platform of the rats were decreased from the 3nd to 6th day(P<0.05 or P<0.01),the swimming distances to platform of the rats were decreased from the 3rd to 5th day(P<0.05 or P<0.01).On the 7th day,in XSXMN groups,the times ofpassing platform,time of staying on platform,distance of staying on platform,time of staying in effective area, distance of staying in effective area,time of staying on platform/total time,distance of staying on platform/total distance,time of staying on platform/total time were all increased significantly(P<0.05 or P<0.01)within 90 s.In dark avoidance task,compared with model group,the error latency and the error times of the rats in XSXMN groups had no obvious change on the 2nd day.The pathological results showed that there were degeneration nerve cells and necrosis nerve cells in the rat cerebral cortex in XSXMN groups,while in the rat hippocampus there were less number of nerve cells with obscure cell layer and many degeneration and necrosis cells were found;compared with model group,there was no obvious improvement.ConclusionXSXMN can improve the learning and memory function of the AD rats.
XueShuanXin MaiNing;Alzheimer’s disease;amyloidβ-protein;rats,Wistar
R749.16
A
2013-06-24
吉林省中医药管理局科研基金资助课题(2010-115)
方圣博(1988-),女,吉林省吉林市人,在读医学硕士,主要从事中枢药理学实验研究。
刘宏雁(Tel:0431-85619705,E-mail:hongyl@jlu.edu.cn)
1671-587Ⅹ(2014)05-0985-06
10.13481/j.1671-587x.20140516
