TAp63基因在多发性骨髓瘤中的表达及作用
2014-06-27刘善浩
刘善浩
(皖南医学院附属弋矶山医院 血液内科,安徽 芜湖 241001)
多发性骨髓瘤(multiple myeloma,MM)是浆细胞肿瘤,骨髓瘤细胞在骨髓内克隆性增殖引起溶骨性破坏,且瘤细胞合成功能缺陷的单克隆免疫球蛋白,出现反复感染、贫血、肾功能不全等临床表现。其病因尚不明确,可能与遗传、环境、理化物质、电离辐射、病毒感染等有关。
MM的发生发展涉及多种原癌基因、抑癌基因或转录因子,干扰了细胞增殖、分化和凋亡的正常信号通路,如原癌基因N-RAS、FGFR3等,抑癌基因p53、RB1等以及凋亡相关基因Bcl-2和Bcl-xl等,参与瘤细胞增殖分化、溶骨病变、肿瘤耐药等的发生,与MM的发病及预后有关。TAp63基因是p53基因家族成员,在造血及淋巴系统肿瘤高表达,尤其在B淋巴细胞来源的肿瘤中高表达[1],与肿瘤凋亡、进展及预后密切相关,其在MM发生发展中作用尚不明确,本研究采用RT-PCR检测19例MM患者骨髓及10例非恶性血液病患者骨髓TAp63 mRNA的表达水平,结合相关临床指标探讨TAp63 mRNA在多发性骨髓瘤中的表达及其在MM发病和预后中的可能作用。
1 资料与方法
1.1 一般资料 选择2012年5月~2013年12月就诊于我科的19例初诊MM患者各2 ml骨髓液标本用作初诊组(其中男性11例、女性8例;年龄44~77岁,中位年龄63岁;IgG型8例、IgA型6例、轻链型2例、不分泌型3例;D-S分期Ⅰ期0例、Ⅱ期2例、Ⅲ期17例;ISS分期Ⅰ期2例、Ⅱ期7例、Ⅲ期10例;所有病例诊断按照D-S诊断);同期选择10例非恶性血液病患者(男性6例,女性4例;年龄37~76岁,中位年龄58岁;排除其他肿瘤)骨髓液作为正常对照组。
1.2 方法 先将RNA逆转录成cDNA,操作严格按逆转录试剂盒说明书进行,然后用cDNA产物进行PCR扩增。PCR反应参照Di Como等合成两对引物[1],序列分别为:TAp63上游引物:5′-GTCCCAGAGCACACAGACAA-3′和下游引物:5′-GAGGAGCCGTTCTGAATCTG-3′,产物长度为267 bp;GAPDH上游引物:5′-GTGGTCTCCTCTGACTTCAACA-3′和下游引物:5′- CCACCACCCTGTTGCTGTAG-3′,产物长度136 bp。反应体系为50 μl:包括2 μl cDNA,上、下游引物各1 μl,25 μl 2×PCR MIX,并加去核酸水至50 μl。TAp63扩增条件为:先94℃变性5 min;然后94℃变性30 s,57℃退火40 s,72℃延伸30 s,循环40次;最后72℃10 min。反应结束后将TAp63和GAPDH的RT-PCR产物经1.5%琼脂糖凝胶电泳,紫外灯下观察结果并拍照。
1.3 结果的判定标准 RNA提取后用紫外分光光度计测定灰度值。
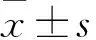
2 结果
用Bio-Rad凝胶成像系统分析TAp63 mRNA的相对表达量,结果以相对光密度值(relative optical density,ROD)表示,mRNA相对光密度值=目的基因条带光密度值/GAPDH条带光密度值,结果见图1。TAp63 mRNA表达量在MM患者中明显高于对照组,差异有显著统计学意义(P<0.001,见表1)。在不同ISS分期中显示:Ⅲ期(1.221±0.207)明显高于Ⅰ期及Ⅱ期(0.567±0.320),差异均有统计学意义(表2);同时经相关分析显示,多发性骨髓瘤患者TAp63 mRNA的表达强度与血清β2MG有显著正相关性(r=0.607,P=0.006),见图2。

表1 TAp63 mRNA 的表达量及差异性比较Tab 1 Comparison of the TAp63 mRNA expression level in two groups
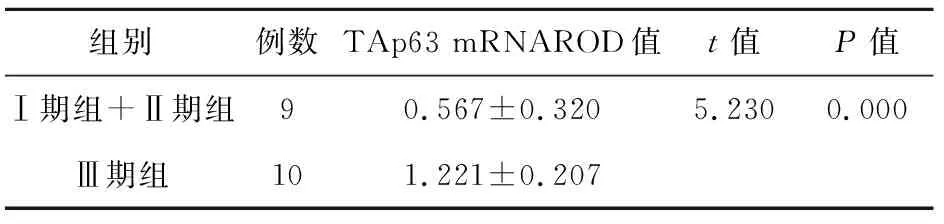
表2 多发性骨髓瘤患者组间TAp63 mRNA 的表达量差异性比较Tab 2 Comparison of TAp63 mRNA expression in MM patients at diverse stages
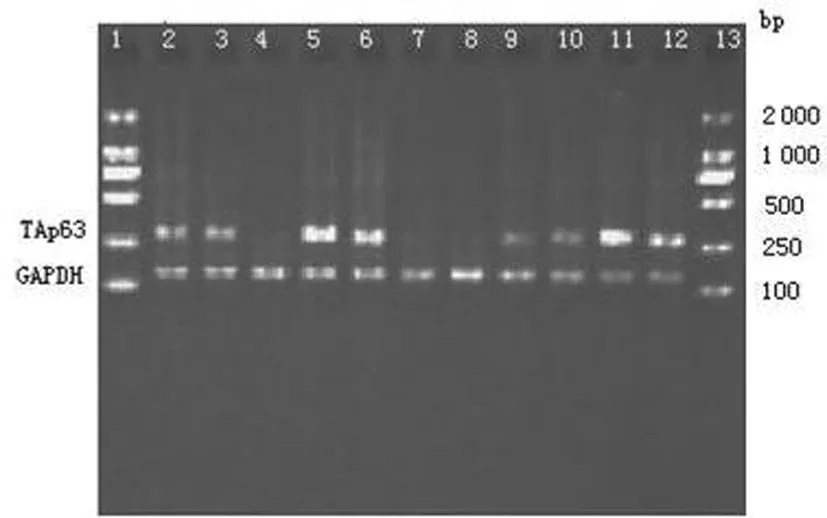
泳道2、3、5、6、9、10、11、12为多发性骨髓瘤组,泳道4、7、8为对照组,267bp处可见TAp63的阳性条带
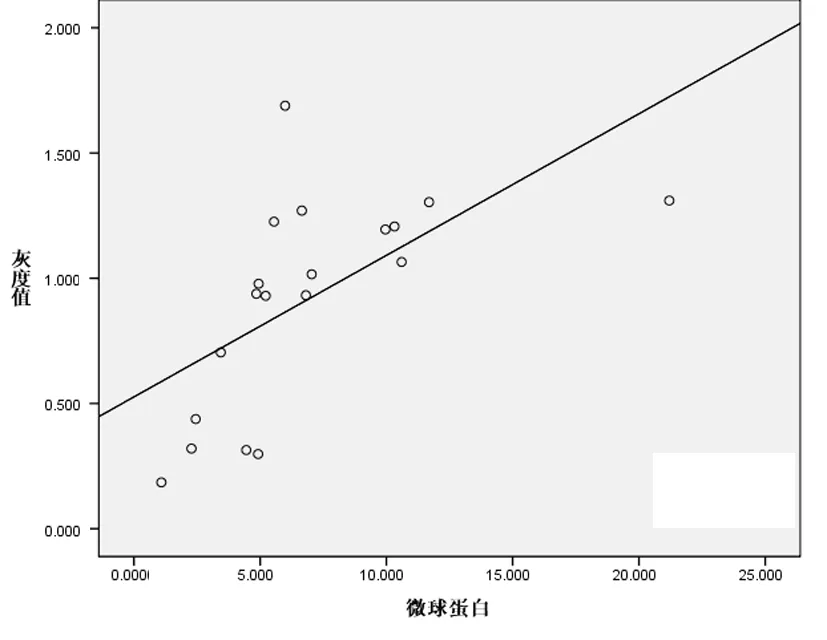
图2 TAp63 mRNA的灰度值与血清β2MG的相关性Fig 2 TAp63 mRNA grey value and correlation with serum β2MG
3 讨论
p63基因是p53基因家族成员,人类p63基因定位于第3q27~3q29,包含15个外显子,在两个不同的启动控制下,编码两类转录产物:一类为全长型p63(TAp63),另一类为截短型p63(△Np63)。多项研究提示TAp63在造血及淋巴系统肿瘤中高表达,尤其见于B淋巴细胞来源的肿瘤,金珍琳等研究表明TAp63在滤泡性淋巴瘤(FL)中表达明显高于反应性淋巴结增生[2];而在胃癌[3]、胰腺癌[4]等实体肿瘤中也可观察到TAp63的表达增高。
在本研究中,TAp63 mRNA在MM患者中表达量明显高于对照组,差异有统计学意义(P<0.01),且Ⅲ期患者TAp63 mRNA的表达量要高于Ⅰ期/Ⅱ期患者(P<0.05),提示TAp63基因可能在MM的疾病进展中起作用。
目前TAp63在肿瘤中的作用尚不明确,相关研究发现以下可能机制:①在甲状腺癌的研究中,发现TAp63可占据DNA中p53应答元件的结合位点,从而阻止了具有更多转录活性的p53家族成员与其结合,提示在甲状腺癌中TAp63通过抑制p53家族基因的功能而起到致癌基因的作用[5];②TAp63可以通过抑制P73介导的细胞凋亡从而促进鳞状细胞癌的生长[6];③通过激活诸如腺苷脱氨酶(ADA)等促进细胞分裂的靶基因而提高具有增殖潜力的肿瘤细胞的自我更新能力促使肿瘤的发生发展[7];④骨巨细胞瘤间质细胞(GCTSCs)是GCT的主要肿瘤细胞,研究发现在GCTSCs中TAp63高水平表达,而转染p63-siRNA后可下调CDC2和CDC25C基因的表达,从而降低GCTSCs的增殖率[8],推测TAp63还可通过影响细胞周期相关基因CDC2和CDC25C基因调控细胞增殖;⑤TAp63还可影响细胞因子的水平,改变骨髓造血微环境,从而影响瘤细胞的生存,如Inbal Binsky等发现在慢性淋巴细胞白血病(CLL)中通过自然配体刺激CD74可上调TAp63,TAp63升高可提高整合素VLA-4的表达,从而促进白血病细胞的归巢到骨髓,减少白血病细胞的凋亡[9]。提示TAp63可通过多种途径促进细胞增殖和抑制凋亡,导致了肿瘤的发生。
此外,TAp63的表达还与肿瘤的分化程度及预后相关。Fukushima等发现,在滤泡淋巴瘤中,TAp63蛋白的阳性率随着病理分级的增加而增加[10]。左学兰等研究发现,TAp63在B细胞淋巴瘤中与凋亡指数(AI)和增殖指数(PI)正相关[11]。而本研究中ISS分期Ⅲ期患者TAp63基因的表达量高于Ⅰ期/Ⅱ期患者(P<0.05),ISS分期包含β2M和白蛋白两个指标,统计学分析TAp63基因表达量与血清β2MG水平正相关。人β2MG与许多恶性血液病,如MM、白血病和淋巴瘤等密切相关,体外研究表明,原代骨髓瘤细胞和骨髓瘤细胞系均可产生β2MG,是一个反映骨髓瘤患者肿瘤负荷的替代指标,此外,β2MG还参与免疫系统的负调控和激活骨吸收,这些结果指出β2MG在MM的发病中具有重要作用。2003年Greipp等从多个单位收集了10 750例MM病例(1981~2001年),经多项指标分析,提示β2MG的血清水平是MM患者最重要的预后因素,高水平β2MG对MM的长期存活不利[12]。提示TAp63与MM预后有关。
综上所述,TAp63基因可能通过促进增殖、抑制凋亡等途径参与MM的发生发展,并与预后相关。当前一些促进凋亡及抑制细胞增殖的药物已在临床应用,对于MM的控制有一定疗效,但目前患者的中位生存期多在3~4年,有待于进一步提高,TAp63基因可能作为MM新的治疗靶点,获得新的希望。
【参考文献】
[1] DI COMO CJ,URIST MJ,BABAYAN I,etal.p63 expression profiles in human normal and tumor tissues[J].Clin Cancer Res,2002,8(2):494-501.
[2] 金珍琳,杨开颜,俞康,等.p63在Castleman病及滤泡性淋巴瘤中的表达[J].温州医学院学报,2009,39 (3),242-245.
[3] TANNAPFEL A,SCHMELZER S,BENICKE M,etal.Expression of the p53 homologues p63 and p73 in multiple simultaneous gastric cancer[J].J Pathol,2001,195:163-170.
[4] ITO Y,TAKEDA T,WAKASA K,etal.Expression of p73 and p63 proteins in pancreatic adenocarcinoma p73 overexpression is inversely correlated with biological aggressiveness[J].Int J Mol Med,2001,8:67-71.
[5] MALAGUARNERA R,MANDARINO A,MAZZON E,etal.The p53-homologue p63 may promote thyroid cancer progression[J].Endocr Relat Cancer,2005,12:953-971.
[6] LEONG CO,KUPERWASSER N,DEYOUNG MP,etal.p63 mediates survival in squamous cell carcinoma by suppression of p73-dependent apoptosis[J].Cancer cell,2006,9:45-56.
[7] MASTROPASQUA G,LEFKIMMIATIS K,CARATOZZOLO MF,etal.Connecting p63 to cellular proliferation:the example of the adenosine deaminase target gene[J].Cell Cycle,2006,5:205-212.
[8] CAROL PO YING LAU,MAN SHAN LI,LIN HUANG,etal.p63 regulates cell proliferation and cell cycle progression associated genes in stromal cells of giant cell tumor of the bone[J].Internati -onal Journal of Oncology,2013,42(2):437-443.
[9] INBAL BINSKY,FRIDA LANTNER,LEV SHVIDEL,etal.TAp63 regulates VLA-4 expression and chronic lymphocytic leukemia cell migration to the bone marrow in a CD74-dependent manner[J].J Immunol,2010,184(9):4761-4769.
[10] FUKUSHIMA N,SATOH T,NAOKO SUEOKA,etal.Clinico-pathological characteristics of p63 expression in B·cell lymphoma[J].Cancer Sci,2006,97(10):1050-1055.
[11] 左学兰,周颖,周新,等.存活蛋白和P63蛋白在B细胞非霍奇金淋巴瘤组织中的表达及其对细胞凋亡和增殖的作用[J].中国实验血液学杂志,2007,15(1):99-102.
[12] GREIPP PR,SANMIGUEL GF.A new int ernational staging system(ISS) for multiple myeloma(MM) from int ernational MyelomaWorking[J].Group J Blood,2003,102(11):118.
