茶多糖对实验小鼠B16F10细胞瘤治疗效应的机制研究
2014-06-27陈美周余方流
陈美周,余方流,董 群
(皖南医学院 微生物学与免疫学教研室,安徽 芜湖 241002)
黑色素瘤(melanoma)恶性程度极高,占皮肤肿瘤死亡病例的绝大部分,多发生于皮肤或接近皮肤的黏膜,也见于软脑膜和脉络膜。黑色素瘤于19世纪初由Garswell命名,是当前严重危害人类健康的一大疾病,尤其在新西兰和澳大利亚地区增长速度极其迅速,每年发病率增长速度约4%左右[1-2]。由于黑色素瘤全身转移发生早,晚期往往失去手术机会,而化疗和放疗对身体的危害性和副作用大,故积极探索和寻找有效治疗方法是当今医学领域重要的研究课题。近年来大量药理和临床研究表明,一些植物多糖能激活免疫细胞,提高机体免疫功能,增强抗肿瘤作用[3],而茶多糖在治疗肿瘤方面研究鲜为少见。本研究旨在深入探讨茶多糖对实验性小鼠治疗肿瘤效应及相关机制,以期为日常生活或临床治疗合理应用茶多糖奠定实验基础。
1 材料与方法
1.1 材料
1.1.1 细胞株与动物 小鼠B16F10肿瘤细胞株和YAC-1细胞株由东南大学基础医学院窦骏教授馈赠。C57BL/6雌性小鼠,鼠龄6周,体质量12~14 g,购自扬州大学医学比较中心,动物合格证明:SCXK(苏) 2012-0004。
1.1.2 主要试剂和仪器 MTT:Sigma产品;DMSO:天津市化学试剂一厂(分析纯);台盼蓝:sigma产品;RPMI 1640:Hyclone 产品;小牛血清:杭州四季春产品;IFN-γ和IL-4检测试剂盒:武汉贝茵莱生物科技有限公司产品;CO2恒温培养箱:Thermo公司产品;酶标仪:普朗DNM-9602;生物安全柜:Esco产品。
1.1.3 实验药物 茶多糖购自上海耐今实业有限公司(D601025)。
1.2 实验方法
1.2.1 小鼠黑色素瘤模型建立 取对数生长期的B16F10肿瘤细胞株,调整细胞浓度为1×106个/ml,每只注射0.2 ml,观察并记录小鼠肿瘤生长情况。
1.2.2 分组实验 C57BL/6雌性小鼠适应性培养1周,随机分成4组,茶多糖(tea polysaccharide,TPS)高剂量组(800 mg/kg)、TPS中剂量组(400 mg/kg)、TPS低剂量组(200 mg/kg)及生理盐水(NS)对照组。小鼠黑色素瘤模型建立后即对各组小鼠灌胃用药,对照组灌胃同等体积的NS,持续灌服28 d,最终摘眼球处死小鼠,留置血清,观察并记录实验小鼠体质量及肿瘤体积的变化等;计算抑瘤率,抑瘤率=(对照组瘤平均体积-实验组平均瘤体积)/对照组瘤平均体积×100%,瘤体积=π×(直径d/2)2。
1.3 NK活性的检测
1.3.1 效应细胞的制备 将小鼠颈椎脱位处死,酒精浸泡几分钟用酒精棉球消毒腹部,剪开腹部皮肤和腹膜,无菌取出脾脏和淋巴结,放入约有5 ml不完全1640的平皿中,用毛玻璃棒在无菌400目筛网研磨脾脏和淋巴结,将悬液细胞放入离心1次,1 000 r/min离心10 min左右,再用完全1640培养液重悬细胞,100倍稀释并用台盼蓝计数,调整活细胞浓度至1×107/ml,再用1640培养液调整至5×106/ml和2×106/ml,共3个浓度。
1.3.2 靶细胞的制备 取传代培养24~48 h对数生长期的YAC-1细胞,用RPMI不完全 1640 1 000 r/min离心10 min,再用完全1640培养液重悬细胞,100倍稀释并用台盼蓝计数,调整活细胞浓度至1×105/ml。
1.3.3 MTT法检测NK细胞的活性 96孔培养板中,试验孔加效、靶细胞各50 μl,效应细胞对照孔加效应细胞、培养液各50 μl,靶细胞对照孔加靶细胞、培养液各50 μl,每个标本做3个复孔,其效靶比分别为100∶1、50∶1、20∶1。将培养板放入CO2培养箱培养20h,然后各孔加入20 μl 5 mg/ml的MTT再孵育4 h,孵育结束后各孔加入150 μl DMSO使其沉淀溶解,微型振荡器振荡10 min,在酶标仪上用波长490 nm对OD值进行检测。杀伤活性=[1-(实验组OD平均值-效应细胞组OD平均值)/靶细胞组OD平均值]×100%。
1.4 ELISA法检测IFN-γ和IL-4的分泌 具体操作步骤参照IFN-γ和IL-4检测试剂盒详细说明书,均购自于南京迪瑞生物技术有限公司。

2 结果
2.1 一般状况 实验前各组小鼠一般状况良好,建模后小鼠一般状况渐渐下降,进食量和饮水量逐渐减少,毛色逐渐变得干枯,有的还有脱毛现象。TPS治疗组延缓了小鼠体质量改变,与对照组比较差异均有统计学意义(P<0.05),以中剂量治疗组尤为明显(P<0.01),见表1。
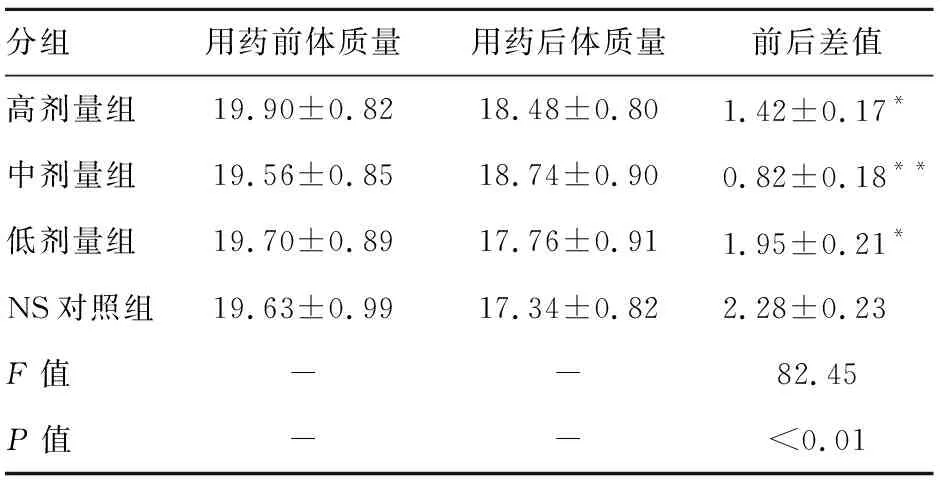
表1 各组实验小鼠治疗前后体质量变化(g,n=8)
2.2 瘤体积大小和抑瘤率 各组模型小鼠都长有一定大小的瘤块,其中NS对照组瘤块直径明显大于其他组,中剂量组瘤块直径明显小于其他组。治疗组各组小鼠瘤块直径与NS对照相比较皆有显著性差异(P<0.05),以中剂量治疗组最为明显(P<0.01),其抑瘤率达到50.73%,见表2。

表2 各组实验小鼠肿瘤直径大小差异比较(n=8)
2.3 TPS对荷瘤小鼠NK细胞活性影响 无论何种效靶比的荷瘤小鼠,TPS都能明显提高NK效应细胞杀伤活性,NS对照组的活性是最低的,并随效靶比值变大而逐渐变小。其中任何一种效靶比,都是中剂量组NK细胞活性最高,且效靶比为20∶1时NK细胞活性最高,达39.06%,其活性也是随效靶比升高而逐渐变小。当效靶比为100∶1时,TPS治疗组杀伤活性与NS对照组比较没有统计学意义(P>0.05),而中剂量组与对照组却有统计学差异(P<0.05);当效靶比为10∶1时,治疗组各组活性均高于NS对照组,其比较却没有统计学意义(P>0.05),中剂量组有差异(P<0.05),但低剂量组NK细胞活性下降的幅度明显比高剂量组大;当效靶比为20∶1时,治疗组与对照组比较均有统计学差异(P<0.05),其中中剂量组最为显著(P<0.01),见表3。

表3 TPS对荷瘤小鼠NK细胞活性影响(%,n=8)
2.4 TPS对荷瘤小鼠IFN-γ和IL-4分泌水平的影响 TPS能提高IFN-γ分泌水平和降低IL-4分泌的水平。TPS治疗各组IFN-γ分泌水平都比NS对照组老鼠高,模型组IFN-γ分泌水平与对照组比较差异都有统计学意义(P<0.05),且中剂量组与NS对照组比较差异有显著性统计学意义(P<0.01),而中剂量组分泌水平为最高,达到841.90 ng/L;TPS治疗各组IL-4分泌水平都比NS对照组老鼠低,各组与其比较差异均有统计学意义(P<0.05),且中剂量治疗组与NS对照组比较有明显差异(P<0.01),而中剂量组IL-4分泌水平为所有组中最低,其值为114.66,见表4。

表4 各组荷瘤小鼠IFN-γ和IL-4分泌水平的影响(n=8)
3 讨论
肿瘤是当前严重危害人类健康的一大疾病,积极探索有效预防与治疗肿瘤是当今医学领域重要的研究课题。通过合理饮食来预防肿瘤一直为众多学者密切关注。目前药物化疗仍然是治疗肿瘤的主要手段,但药物抗肿瘤往往会导致严重毒副作用。有研究表明,许多天然来源的多糖具有显著的抗肿瘤活性,比如香菇多糖[4-6]和黄芪多糖[7-8]在临床上已经开始作为治疗肿瘤新的药物。而TPS作为植物多糖在体内抗肿瘤活性尚不明了。茶叶中含有多种保健和药理活性成分,如茶多酚、TPS等[9]。近年来一些研究表明,茶多糖具有调节血糖、血脂,增强免疫及抗肿瘤等作用[10],但很多研究大都只集中在体外实验。
本实验通过接种B16F10肿瘤细胞建立小鼠黑色素瘤模型,经TPS灌胃一段时间后,发现TPS能改善实验小鼠一般生存状况,主要表现为减缓小鼠体质量减轻程度,增加抑瘤率,经检测显示增强了小鼠NK细胞活性、增强IFN-γ及降低IL-4的分泌。NK细胞是机体非特异性免疫的关键细胞,尤其在抗肿瘤方面起着相当重要的作用。笔者以YAC-1细胞为小鼠NK细胞经典靶细胞,采用体内模拟方法检测小鼠NK细胞杀伤活性,经TPS治疗后,荷瘤小鼠NK细胞活性在效靶比为20∶1时均有所增强,尤其中剂量治疗组NK细胞活性最高,达39.06%。另外,实验还发现TPS治疗能增加IFN-γ和降低IL-4的产生。众所周知,IFN-γ作为抗肿瘤的重要免疫分子,也是衡量机体细胞免疫功能的指标分子,主要由活化的Th1细胞所分泌。而IL-4则主要由Th2细胞活化增殖产生的,其作用体现为增强特异性体液免疫且抑制Th1细胞的分化。因而IFN-γ/ IL-4的表达可作为机体特异性细胞免疫与体液免疫功能变化的“晴雨表”,笔者认为TPS可能通过增强了机体特异性细胞免疫功能而达到较好的抗肿瘤效果。总之,经本实验研究提示:TPS显示抗肿瘤效应,可能与增强免疫反应机制有关,不仅增强了非特性免疫,还诱导了特异性细胞免疫。
茶多糖在粗老茶叶中含量较为丰富,开发利用茶多糖,不仅能提高粗茶的经济价值,还能为临床上肿瘤治疗提供新的探索方向。而对于茶多糖抗肿瘤作用的具体机制还有待进一步深入研究。
【参考文献】
[1] BAADE P,MENG X,YOULDEN D,etal.Time trends and latitudinal differences in melanoma thickness distribution in Australia,1990-2006[J].Int J Cancer,2012,130(1):170-178.
[2] GELLER AC,CLAPP RW,SOBER AJ,etal.Melanoma epidemic:an analysis of six decades of data from the Connecticut Tumor Registry[J].J Clin Oncol,2013,31(33):4172-4179.
[3] LIM TS,NA K,CHOI EM,etal.Immunomodulating activitiesof polysaccharides isolated from Pana xginseng[J].J MedFood,2004,7(1):1-6.
[4] 陈占红,叶魏武,李铁,等.香菇多糖合并化疗治疗晚期非小细胞肺癌[J].广西中医学院学报,2003,6(3):15-17.
[5] TAKESHITA K,WATANUKI S,MARUYAMA M,etal.Effect of Lentinan on lymphocyte subsets of peripheral blood,lymph nodes,and tumor tissues in patients with gastric cancer[J].Surg Today,1993,23(2):125-129.
[6] 申杰,苏秀兰,徐桂华,等.香菇多糖对晚期胃癌患者免疫功能的影响及临床疗效与安全性评估[J].中国循征医学杂志,2007,7(1):18-26.
[7] 方晓松,周颦.注射用黄芪多糖治疗原发性肝癌的疗效观察[J].重庆医学,2009,38(8):935-938.
[8] 王梅,李秀丽,刘蕊.黄芪多糖在恶性肿瘤治疗中的应用[J].中国中医药科技,2009,16(5):411-412.
[9] 汪东风,谢晓风,王泽农,等.粗老茶中的多糖含量及其保健作用[J].茶叶科学,1994,14(1):73-74.
[10] WANG Dongfeng,WANG Chenghong,LI Jun,etal.Components and activity of polysaccharides from coarse tea [J].J Agric Food Chem,2001,49 (1):507-516.
