男性胃原发性绒毛膜癌一例并文献复习
2014-06-27骆莉莉常滋毓杨丽丽
骆莉莉,王 欣,张 颖,常滋毓,杨丽丽
(蚌埠市第一人民医院 病理科,安徽 蚌埠 233000)
绒毛膜上皮细胞癌(choriocarcinoma)简称绒癌,是一种滋养层细胞的高度恶性肿瘤。绝大多数绒癌为妊娠性绒癌,来源于胎盘绒毛膜上皮组织,发生于有妊娠史女性。极少部分为非妊娠性绒癌也称为原发性绒癌,大多起源于性腺或机体的中线部位,男性发病极为罕见。我院于2012年4月9日收治1例男性胃原发性绒癌患者。现对此进行病理形态学观察和免疫组化检测,复习文献,探讨其发病因素、临床病理学和分子病理学特点及诊疗方法。
1 临床资料
1.1 病例介绍 男性,69岁,因“中上腹疼痛伴消瘦半月”入院,CT示:上腹部占位,病灶位于胃小网膜囊内。行手术探查,术中见胃窦部一长径5.0 cm肿块,活动度良好,与周围组织无粘连。
1.2 病理资料
1.2.1 巨检 胃大部切除标本,于胃窦部小弯侧浆膜下见一6 cm×5 cm×4 cm圆形肿块,界清,暗红色,囊实性,部分有包膜。剖面见大部分区域出血、坏死伴血凝块形成,实性区灰黄,质软。
1.2.2 组织学 病灶组织弥漫性出血、坏死。部分肿瘤细胞由异型明显的两种细胞混合构成,间质稀少,中央是单核细胞滋养细胞周围环绕多核合体滋养细胞的双相图像,围绕血管周围并侵犯血管壁(图1)。细胞滋养层细胞呈多边形,体积小,胞界清,胞质淡染,核圆形,位于中央,核仁明显。合体滋养层细胞体积大而不规则,胞界清,胞质嗜酸性,多核,核深染畸形 (图2)。两种细胞均较正常滋养细胞大2~3倍,且可见巨核瘤细胞。部分为低分化腺癌细胞,大小不一,呈圆形或卵圆形,细胞浆少,核大,异形深染,核浆比例大,瘤细胞排列成巢状或片状,无明显腺腔形成(图3)。肿瘤性滋养细胞和腺癌细胞相互移行,靠近血管周围为滋养细胞,远离血管为腺癌细胞。
1.2.3 免疫组化 瘤细胞:CK(+)、CK7(+)(图4);滋养细胞:HCG(合体滋养细胞+)(图5);腺癌细胞:EMA(+)(图6)、CEA(+);Ki-67 (+,约80%)。Calretinin(-)、CD56(-)、CK20(-)、CK5/6(-)、D2-40(-)、ER(-)、PR(-)、P63(-)、PSA(-)、Syn(-)、TTF-1(-)、vimentin(-)、WT1(-)。
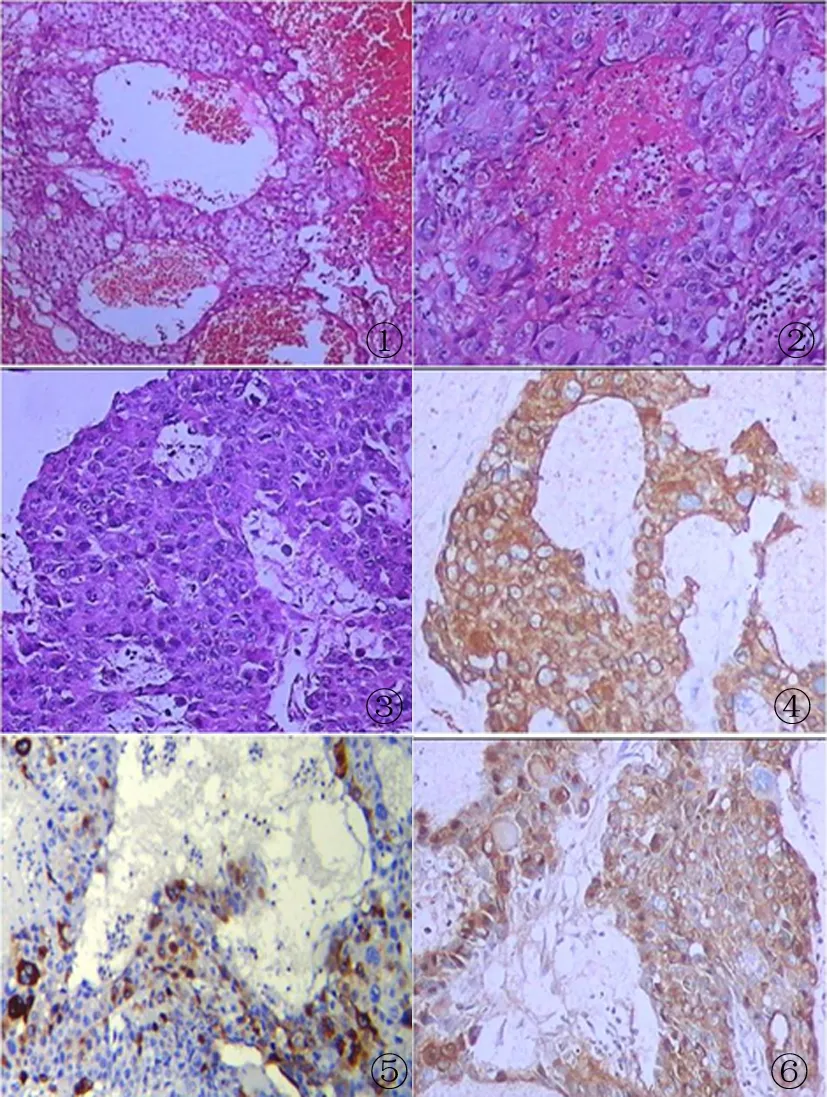
图1 滋养细胞围绕血管周围(HE,×10)图2 细胞滋养细胞和合体滋养细胞(HE,×10)图3 低分化腺癌细胞(HE,×10)图4 肿瘤细胞表达CK7(EnVision法,×10)图5 合体滋养细胞表达β-hCG (EnVision法,×10)图6 腺癌细胞表达EMA(EnVision法,×10)
1.2.4 术后诊断 术后患者经各种影像学检查,未发现原发生殖器肿瘤,无其他中线部位的病变。术后查血β-HCG(β-人绒毛膜促性腺激素)443.15 mIU/ml,结合病理形态学特征及血清学检查,最终诊断为胃原发性绒毛膜癌合并低分化腺癌。
2 治疗
术中切除远端胃、大网膜及小网膜,清除肿大淋巴结,行毕Ⅰ式吻合。术后给予胃肠减压、抑制胃酸分泌、补液、支持等治疗。待一般情况稳定后给予5-Fu、更生霉素、长春新碱化疗一个疗程,复查血β-HCG 51.34 mIU /ml,后因患者一般情况较差,停止化疗,术后6个月因绒癌肺转移、多脏器功能衰竭,死亡。
3 讨论
绒癌是一种分泌人绒毛膜促性腺激素(β-human chorionic gonadotropin,β-HCG)的高度恶性滋养细胞肿瘤。分为妊娠性和非妊娠性两种。绝大多数绒癌为妊娠性绒癌,发生于胎盘绒毛膜上皮组织,继发于正常或异常妊娠后的滋养细胞疾病[1]。非妊娠性绒癌又称为原发性绒癌,非常少见,男性原发性绒癌则更少见。大多起源于性腺如卵巢和睾丸,性腺外绒癌较罕见,一般发生在机体的中线部位如松果体、纵隔、腹膜后、肺、食管、胃、空肠、结肠、胰腺等[2]。
3.1 临床特点 根据不同的发生部位患者可出现咯血、中枢神经系统症状、呕血、黑便、贫血等症状[3],男性原发性绒癌患者还可能出现特异的体征:男性乳腺女性化、睾丸萎缩、性欲减退。转移途径以血行转移为主,短时间内便会转移至肺、肝和脑等重要脏器[4],引起全身多器官功能衰竭死亡。
3.2 发病机制 原发性绒癌的发病机制不明,目前有三种假说。①原始生殖细胞移行异常学说[5]:胚胎期原始的生殖细胞自卵黄囊沿着泌尿生殖道移行过程中迁移失败,异位的原始生殖细胞发生瘤性分化呈绒毛膜上皮癌;②自然消退的原发性生殖腺肿瘤的转移学说[6]:绒癌侵袭血管后,易于血行转移,患者以转移瘤为首发症状,而隐匿于生殖器官的原发病灶转移到胃后,可能已经自行消退;③非生殖器组织内原发性肿瘤逆分化学说[7]:非生殖系统组织中的非滋养层肿瘤细胞发生逆分化使得许多生殖系统外的组织也分泌β-HCG。胃的原发性绒癌可能来自于腺癌成分的逆分化,或者黏膜自身正常的可分泌hCG的细胞发展而来。
3.3 分子病理学 随着分子生物学技术的发展,人们对滋养细胞肿瘤基因表达进行研究,以寻找绒癌分子诊断与基因治疗的线索。俞丽丽等[8]研究印迹基因H19对人绒毛膜上皮癌细胞JEG-3基因表达谱的影响,发现印迹基因H19主要引起转录调控、受体结合、细胞代谢、细胞发育、细胞进程和生物学调节相关基因的改变,从而调节滋养细胞的生物学功能。曹波[9]对绒癌Bewo细胞染色体着丝粒点(centromeric dots,Cd)进行研究发现Bewo细胞染色体非整倍性畸变可能源于Cd缺失和Cd-NOR融合(D、G组染色体NOR银染物质与其邻近的Cd结构混合在一起)。屈茹楠等[10]研究表明O-GIcNAc蛋白修饰可能参与了绒毛膜癌细胞转移的调控。
3.4 诊断与鉴别诊断 诊断胃原发性绒癌必须非常谨慎,应进行全面检查,以排除其他部位隐匿的原发病灶。睾丸是最常见的原发部位,占33.0%[11],但常以转移灶为首发表现,而原发瘤很小,甚至完全退化。本例患者经各种影像学检查,既没有发现原发生殖器肿瘤,也无中线部位的病变,但这并不能排除原发灶微小,或已自行消退。目前研究发现,很多恶性肿瘤细胞都能表达异位HCG,异位HCG与恶性肿瘤自我生长调控、转移、分化程度、肿瘤微环境和免疫耐受等密切相关[12]。因此病理学图像、HCG水平,临床资料相结合,方能作出绒癌的诊断。
3.5 治疗与预后 男性原发性绒癌的治疗比较复杂,目前多采用综合性治疗手段,建议采用较强的联合化疗方案并在适当时机结合手术治疗,治疗期间肿瘤标记物的监测有助于评估疗效和预后[13]。化疗方案目前主要有EMA-CO、EMA-EP、PVE、BEP等,具体需根据患者的身体状况、治疗需要、药物耐受情况等选择或更换化疗方案。Waseda等[14]应用EP方案治疗一例胃原发性绒毛膜癌伴肝转移的患者,取得了良好的效果。化疗药物副作用较大,开发新的天然低毒的药物成了一个新课题。陈杰等[15]从天然药物半边旗中提取二萜类化合物5F,研究发现,5F能通过阻滞细胞周期、上调PTEN表达水平,下调cyclinD1表达,来抑制JAR细胞生长增殖。非妊娠性绒癌来自于自身的恶性肿瘤,手术切除是必要的。但因发现时往往瘤体大,肿瘤活性高,转移和侵犯的部位广泛,早期手术切净率低,并易促进血行转移,引起术后病情急剧恶化。目前主张在化疗后使血中HCG接近正常、肿瘤负荷明显降低的情况下行根治性手术,这样可以缩短疗程,降低复发率[16]。
非妊娠性绒癌的治疗效果较妊娠性绒癌的治疗效果差,主要原因有:①从免疫学看,妊娠性绒癌是有男性成分在内的异体肿瘤,免疫性强,化疗药物杀死一部分癌细胞后,剩余的癌细胞可由机体的免疫力加以处理杀死,而非妊娠性绒癌的癌细胞来自自身,抗原性较弱,免疫力差,化疗后残留的癌细胞无法控制因而容易复发,转移早,且易耐药。②非妊娠性绒癌除绒癌外还含有其他肿瘤成分,如本例患者伴发有低分化腺癌成分。治疗过程中即使绒癌成分获得控制,但其他恶性成分继续发展,影响预后和生存。③非妊娠性绒癌较少见,对此认识不足,难以早期诊断,而且早期的手术干预可能促进疾病的发展和转移。因此,提高对这类肿瘤的认识,早期正确诊断,积极采用化疗和手术相结合,兼治多种肿瘤成分,一般可以改进疗效。
总之,男性胃原发性绒癌是一种罕见的高度恶性肿瘤,预后极差。诊断时要排除转移性癌,一旦确诊,根据患者情况,积极采用联合治疗方案,并且定期进行影像学以及β-HCG水平的检测,密切随访。
【参考文献】
[1] 陈乐真.妇产科诊断病理学[M].2版.北京:人民军医出版社,2010:378-379.
[2] HERAI Y,NISHI K,YAMAMOTO H,etal.A case of primary choriocarci- noma of the mediastinum in a Japanese woman[J].Nihon Kokyuki Gakkai Zasshi,2006,44(5):384-388.
[3] 刘格利.绒毛膜癌转移二例误诊分析[J].实用心脑肺血管病杂志,2012,20(7):1249.
[4] JIANG Lun,WU Jingtao,PENG Xin.Primary choriocarcinoma of the colon:a case report and review of the literature[J].World J Surg Oncol,2013,28(11):1-5.
[5] FINE G,SMITH RW JR,PACHTER MR.Primary extragenital choriocarcinoma in the male subject.Case report and review of the literature[J].Am J Med,1962,32:776-794.
[6] SESTERHENN IA,DAVIS CJ JR.Pathology of germ cell tumors of the testis[J].Cancer Control,2004,11(6):374-387.
[7] DESHPANDE JR,KINARE SG.Choriocarcinomatous transformation in metastases of an anaplastic lung carcinoma:a case report[J].Indian J Cancer,1987,24(3):161-166.
[8] 俞丽丽,李力,赵丹,等.印迹基因H19对人绒毛膜上皮癌细胞JEG-3基因表达谱的影响[J].重庆医学,2013,42(29):3468-3471.
[9] 曹波.宫颈癌CasKi细胞和绒癌Bewo细胞染色体着丝粒点变异的研究[J].现代肿瘤医学,2012,20(12):2470 -2472.
[10] 屈茹楠,琚娜娜,吴明军,等.功能蛋白O-GlcNAc糖基化修饰调控绒毛膜癌细胞的转移[J].中国细胞生物学学报,2013,35(7):922-927.
[11] YOKOI K,TANAKA N,FURUKAWA K,etal.Male choriocarcinoma with metastasis to the jejunum:a case report and review of the literature [J].J Nippon Med Sch,2008,75 (2):116-121.
[12] 浦春,杨书才.β-HCG在恶性肿瘤诊断中的临床价值[J].中国医药指南,2011,9(32):329-330.
[13] 向阳.宋鸿钊滋养细胞肿瘤学[M].3版.北京:人民卫生出版社,2011:259-260.
[14] WASEDA Y,KOMAI Y,YANO A,etal.Pathological complete response and two-year disease-free survival in a primary gastric choriocarcinoma patient with advanced liver metastases treated with germ cell tumor-based chemotherapy:a case report[J].Jpn J Clin Oncol,2012,42(12):1197-1201.
[15] 陈杰,庞江琳,覃燕梅,等.5F对绒癌JAR细胞增殖、细胞周期及PTEN、cyclinD1表达的影响[J].中国妇幼保健,2012,27(11):1693-1695.
[16]FROYLICH D,SHILONI E,LAVIE O,etal.Colon and lung choriocarcinoma[J].Isr Med Assoc J,2010,12(10):642-644.
