CHD4蛋白截短体融合蛋白的表达、纯化和鉴定
2014-06-27张金莉郎慧芳万传君顾永清
徐 涛,张金莉,曾 妍,王 攀,郎慧芳,万传君,顾永清
(1.军事医学科学院放射与辐射医学研究所放射毒理与辐射危害评价研究室,北京 100850; 2.石河子大学医学院生化教研室,新疆石河子 832000;3. 南通大学附属医学院消化科 实验室,江苏南通 226000;4. 驻马店卫生学校微生物免疫教研室,河南驻马店 463000)
人类CHD4/Mi-2β蛋白属于ATP酶超家族,该蛋白质因氨基端开始依次含有染色质调节域(ATP-dependent chromatin-remodeling complexes)、类SWI2/SNF2 ATP酶/解螺旋酶域和DNA结合域而得名[1]。CHD4/Mi-2β与反式激活蛋白及抑制蛋白均能相互作用,并直接与染色质重构蛋白相关,为参与转录调控的多蛋白超复合物的形成提供新的视野[2]。CHD4/Mi-2β蛋白参与DNA的损伤反应,并且与DNA损伤标记蛋白γ-H2AX有共定位现象。沉默 CHD4/Mi-2β基因,细胞自发性DNA损伤增多和辐射敏感性增强。CHD4/Mi-2β是ATM激酶的底物,其S1349位点可被ATM磷酸化,CHD4/Mi-2β-pS1349蛋白与染色质结合更为紧密,为DNA损失修复提供时间上的保障[1,3-4]。CHD4/Mi-2β、HDAC1、MTA2是目前已知的染色质重构复合物NuRD的成员,其中HDAC1、MTA2已经被证实具有调节p53的功能,p53蛋白参与G1/S的调控和细胞凋亡[5-6]。CHD4/Mi-2β如何参与DNA的损伤修复过程尚未明确。为深入研究CHD4/Mi-2β的功能,本研究采用DNA重组技术,构建了CHD4/Mi-2β基因的结构域原核表达质粒,为进一步研究CHD4/Mi-2β的生物学功能奠定基础。
1 材料与方法
1.1材料CHD4-HA真核表达质粒含CHD4/Mi-2β基因编码区全长,由剑桥大学Steve Jackson博士惠赠。pGEX-5T质粒本实验室保持;KOD DNA聚合酶购自TOYOBO公司;DH5α、BL21(DE3)感受态细胞、质粒小量抽提试剂盒、PCR纯化试剂盒购自北京天根生化科技公司;限制性内切酶及DNA连接酶购自Bio Labs公司;GST亲和树脂购自北京韦氏博慧色谱科技有限公司;IPTG购自Promega公司;抗GST一抗购自Santa Cruz Biotechnology;抗山羊抗小鼠IgG辣根酶标记购自中杉公司;ELC购自Cell Signaling Biotechnology;引物合成与重组质粒的测序由北京华大基因完成。
1.2目的基因的获得及重组表达载体的构建根据CHD4/Mi-2β蛋白的结构域,设计3对引物,分别扩增含染色质的调节区、解旋酶区和DNA结合区,引物序列及PCR扩增条件见表1。在上游引物引入XmaⅠ酶切位点,下游引物引入KpnⅠ位点。PCR反应体系为50 μL,反应参数见表1。限制性内切酶双酶切PCR产物及pGEX-5T原核表达载体,割胶回收纯化后,将目的片段与线性化pGEX-5T载体连接,构建重组质粒pGST-CHD4-C、pGST-CHD4-D及pGST-CHD4-H,并由北京华大基因测序中心对其进行测序鉴定。
1.3蛋白的诱导表达将经测序鉴定正确的pGST-CHD4-C、pGST-CHD4-D及pGST-CHD4-H质粒转化感受态大肠杆菌BL21(DE3)细胞,挑取单克隆37 ℃培养,待细菌生长至对数生长期(A600=0.6~0.8)时,加入终浓度为0.8 mmol/L的IPTG,20 ℃继续培养4~5 h后4 ℃离心收集细菌。按照100 mL菌液加入4 mL冰预冷的PBST重悬细菌,冰上超声裂解菌液5 min,4 ℃ 12 000×g离心15 min,分别取上清进行SDS-PAGE后行考马斯亮蓝染色,分析目的蛋白的表达。
表1CHD4/Mi-2β截短体引物序列及扩增条件
Tab.1 Primer sequences and amplification conditions of recombinant plasmid of CHD4/Mi-2β

名 称引物序列PCR扩增条件CHD4-CUp:5>cgccccgggtstggcgtcgggcctgggctcc<3Dw:5 >cgcggtacctcaaggcctctccaacttccgaag <395℃ 5min;(94℃ 30s, 57℃ 30s,72℃ 150s)×35 cycles; 72℃ 7min。 片段2100bpCHD4-DUp:5 > cgccccgggtgacacagaattgcagggcatg<3Dw:5 > cgcggtacctcactgctgctgggctacctg<395℃ 5min;(94℃ 30s, 57℃ 30s,72℃ 120s)×35 cycles; 72℃ 7min。 扩增1938bpCHD4-HUp:5 > cgccccgggtccagaaacgccaacagttgat<3Dw:5>cgcggtacctcattcccgtaccacatactgggc<395℃ 5min;(94℃ 30s, 57℃ 30s,72℃ 120s)×35 cycles; 72℃ 7min。 扩增1767bp
1.4蛋白的洗涤及纯化取250 mL诱导菌液上清用0.45 μm滤膜过滤,与5 mL谷胱甘肽琼脂糖树脂匀浆混合,4 ℃旋转混悬仪上孵育4~5 h。4 ℃ 500×g离心5 min,小心去掉上清并留样少许进行SDS聚丙烯酰胺凝胶电泳,分别加入10倍柱床体积的冰冷PBST洗涤,重复洗涤3次。去掉上清,在谷胱甘肽琼脂糖树脂中加入1倍柱床体积的冰冷谷胱甘肽洗脱缓冲液洗脱,室温轻轻搅动10 min,4 ℃ 500×g离心5 min,上清移至新EP管,重复洗脱3次。收集的洗脱液进行SDS-PAGE分析。
1.5Westernblot检测纯化产物进行Western blot检测,按照GST抗体说明书要求进行,检测重组蛋白纯化产物的特异性。纯化产物行SDS-PAGE电泳分离,转移至PVDF膜,50 g/L脱脂奶粉室温封闭1 h,加入抗GST抗体(1∶1 000),4 ℃孵育过夜。TBST洗涤3次,10 min/次,加入相应的二抗,室温孵育1 h,TBST洗涤3次,10 min/次,ECL化学发光显影。
2 结 果
2.1截短体的构建及序列的鉴定以CHD4-HA质粒为模板,经PCR扩增出CHD4-C、CHD4-D、CHD4-H基因片段,PCR片段大小均在2 000 bp左右,符合预期扩增大小(图1)。PCR产物和原核表达载体pGEX-5T双酶切后连接,转化,挑取单克隆行PCR菌落阳性鉴定。由图2A可见,各个目的载体均有阳性克隆插入,阳性率约为50%。单克隆阳性菌摇菌并送测序,提取质粒用XmaⅠ/KpnⅠ双酶切鉴定,琼脂糖电泳后分别在约2 000 bp处有一DNA条带,符合预期结果(图2B)。阳性克隆质粒测序结果比对,与GenBank序列完全一致。

图1CHD4-C、CHD4-D、CHD4-H的PCR产物的电泳结果
Fig.1 Results of electrophoresis of PCR products of CHD4-D, CHD4-C and CHD4-H
1:CHD4-D;2:CHD4-C;3:CHD4-H。
2.2截短体蛋白的诱导表达与纯化将经测序鉴定正确的pGST-CHD4-C、pGST-CHD4-D及pGST-CHD4-H质粒转化感受态大肠杆菌BL21,0.8mmol/L的IPTG诱导细胞,SDS-PAGE分析细胞裂解上清,显示融合蛋白上清液中的表达量较高。各融合蛋白GST-CHD4-C、GST-CHD4-D及GST-CHD4-H分子质量分别符合预期值,表明蛋白诱导表达成功(图3A)。采用谷胱甘肽琼脂糖亲和层析纯化融合蛋白,收集洗脱液,行SDS-PAGE分析,可见蛋白纯化蛋白位置正确,无明显杂带,纯度达95%以上(图3B)。

图2阳性克隆筛选的琼脂糖凝胶电泳图
Fig.2 Positive clones were identified by agarose gel electrophoresis
A:PCR阳性克隆筛选的琼脂糖凝胶电泳图。M:DNA ladder(100~5 000 bp);1~4:CHD4-C菌落克隆;5~8:CHD4-D菌落克隆;9~13:CHD4-H菌落克隆;p:阳性对照;n:阴性对照。B:双酶切阳性克隆筛选的琼脂糖凝胶电泳图。M:DNA ladder(100~5 000 bp);1:pGEX-5T质粒;2、3、4、5:pGEX-5T、pGST-CHD4-C、pGST-CHD4-D和pGST-CHD4-H重组质粒由XmaⅠ/KpnⅠ双酶切。

图3CHD4/Mi-2β截短体融合蛋白的诱导表达及纯化的SDS-PAGE分析
Fig.3 SDS-PAGE analysis of recombinant plasmid CHD4/Mi-2β fusion protein by induced expression and purification
A:融合蛋白诱导表达的SDS-PAGE分析。M:Marker(25~130 ku);1、3、5、7:GST-CHD4-C、GST-CHD4-D、GST-CHD4-H和GST蛋白未加诱导剂对照;2、4、6、8:GST-CHD4-C、GST-CHD4-D、GST-CHD4-H和GST蛋白诱导后上清;箭头示目的融合蛋白。B:融合蛋白纯化后的SDS-PAGE分析。M:Marker(16~250 ku);1、3、5:GST-CHD4-C、GST-CHD4-D、GST-CHD4-H蛋白未加诱导剂对照;2、4、6:GST-CHD4-C、GST-CHD4-C、GST-CHD4-D纯化后蛋白。
2.3融合蛋白的Westernblot鉴定取1 μg纯化的GST融合蛋白行SDS-PAGE及Western blot进一步鉴定各截短体融合蛋白。结果显示,各蛋白均与抗GST抗体结合(图4),GST-CHD4-C、GST-CHD4-D及GST-CHD4-H蛋白位置符合预期大小,表明原核表达及纯化成功。
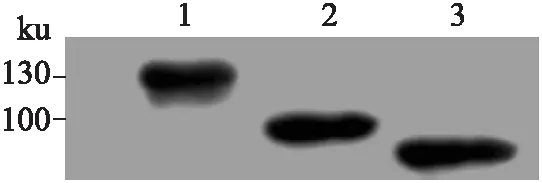
图4CHD4/Mi-2β截短体融合蛋白的Westernblot分析
Fig.4 Western blot analysis of CHD4/Mi-2β truncated fusion protein
1、2、3:GST-CHD4-C、GST-CHD4-D 和GST-CHD4-H蛋白。
3 讨 论
CHD4/Mi-2蛋白最初是从人类皮肌炎患者中鉴定出来的自身抗原,属于高度保守的CHD蛋白家族[7]。CHD4/Mi-2β与HDAC1、HDAC2、MTA2、MBD2和MBD3等蛋白构成NuRD复合物,该复合物具备核小体重构活性和组蛋白去乙酰化酶活性[8-9]。CHD4/Mi-2β的锌子键结构通过对组蛋白H3 Lys9的乙酰化或组蛋白H3的甲基化从而绑定到组蛋白H3的尾端,同一个锌子键结构域绑定不同的组蛋白标记,会产生相反的过程,比如基因的激活和抑制[10]。DNA修复和细胞周期监测点是维持基因组稳定性的两个关键分子机制,此功能的缺陷将显著增加细胞发生癌变的倾向性。POLE等研究发现,CHD4/Mi-2β本身虽然并不具有乙酰转移酶或脱乙酰酶功能,无法直接参与对p53乙酰化来调节细胞周期的进程,然而在NuRD复合物中,MTA2具有调节p53乙酰化功能。CHD4/Mi-2β的缺失不影响HDAC1、MTA2的表达水平,支持CHD4通过促进HDAC1对p53去乙酰化,参与细胞G1/S周期过渡的调节[11]。
CHD4/Mi-2β基因缺失后真核细胞稳定性下降,其机制尚需进一步明确。为研究CHD4/Mi-2β各结构域在真核细胞中的功能与作用机制,本研究构建了GST-CHD4-C、GST-CHD4-D及GST-CHD4-H 3个重组质粒。对pGEX-5T原核表达载体的选取具有以下几个优点:①PGEX-5T载体质粒构建中SD、RBS序列不需要考虑。其载体的SD及RBS序列,不会因为外源基因插入形式的不同而改变,是因为pGEX-5T载体的多克隆位点在GST基因之后,GST融合蛋白就可以表达出。②载体中具有可诱导的强启动子tac启动子。因为载体本身带有lac基因,在大肠杆菌lac Ⅰ菌株中,它的转录需经IPTG诱导的性质也不会改变。在表达外源蛋白的过程中,根据需
表达的外源蛋白的性质,进行适当的诱导,可以得到最高的产率。③蛋白纯化条件温和,有利于GST融合蛋白保持其蛋白活性。直接从细菌裂解液中用谷胱甘肽琼脂糖亲和层析吸附,洗脱条件温和,整个过程无变性剂的加入。④GST与目的蛋白洗脱液分离简便。因此,pGEX-5T载体更方便地与目的基因重组和筛选,更能有效地在原核细胞中表达。本研究成功构建了CHD4-C、CHD4-D、CHD4-H截短体,为CHD4的相关研究奠定了基础。
参考文献:
[1] URQUHART AJ, GATEIi M, RICHARD DJ, et al. ATM mediated phosphorylation of CHD4 contributes to genome maintenance[J]. Genome Integr, 2011, 2(1):1.
[2] 王会平,徐勤枝,周平坤. 染色质重构因子CHD蛋白家族的研究进展[J]. 国际放射医学核医学杂志,2006, 30(1):42-47.
[3] LARSEN DH, POINSIGNON C, GUDJONSSON T, et al. The chromatin-remodeling factor CHD4 coordinates signaling and repair after DNA damage[J]. J Cell Biol, 2010, 190(5):731-740.
[4] POLO SE, KAIDI A, BASKCOMB L, et al. Regulation of DNA-damage responses and cell-cycle progression by the chromatin remodelling factor CHD4[J]. EMBO J, 2010, 29(18):3130-3139.
[5] KHANNA KK, JACKSON SP. DNA double-strand breaks:signaling, repair and the cancer connection[J]. Nat Genet, 2001, 27(3):247-254.
[6] SHILOH Y. ATM and related protein kinases:safeguarding genome integrity[J]. Nat Rev Cancer, 2003, 3(3):155-168.
[7] TRAN HG, STEGER DJ, LYER VR, et al. The chromo domain protein chd1p from budding yeast is an ATP-dependent chromatin modifying factor[J]. EMBO J, 2000, 19(10):2323-2331.
[8] TONG JK, HASSIG CA, SCHNITZLER GR, et al. Chromatin deacetylation by an ATP-dependent nucleosome remodelling complex[J]. Nature, 1998, 395(6705):917-921.
[9] BOWEN NJ, FUJITA N, KAJITA M, et al. Mi-2β complex couples DNA methylation to chromatin remodelling and histone deacetylation[J]. Nat Genet, 1999, 23(1):62-66.
[10] MUSSELMAN CA, MANSFIELD RE, GARSKE AL, et al. Bing of the CHD4 PHD2 finger to histone H3 is modulated by covalent modifications[J]. Biochem J, 2009, 423(2):179-187.
[11] HIROSE F, OHSHIMA N, KWON EJ, et al. Drosophila Mi-2 negatively regulates dDREF by inhibiting its DNA-binding activity[J]. Mol Cell Biol, 2002, 22 (14):5182-5193.
