调控C-erbB2表达对脑胶质瘤细胞凋亡及 放疗敏感性的影响
2014-06-27谢万福徐高峰李传坤王茂德
谢万福,王 佳,郭 凯,徐高峰,李传坤,王茂德
(西安交通大学医学院第一附属医院神经外科,陕西西安 710061)
脑胶质瘤是一种最常见的原发性恶性肿瘤,其发病率高,复发率高,死亡率高,大多数患者在确诊1年内死亡。虽然在过去的20年中,手术、放疗和化疗均取得较大的进步,但是胶质瘤的预后并没有明显的改善。因此,在手术基础上寻找其他有效的治疗方法成为治疗胶质瘤的重要突破口。目前研究认为胶质瘤的发生发展机制主要是由于癌基因的激活和抑癌基因的失活导致肿瘤细胞增殖失控和凋亡缺陷,进而形成肿瘤。其中,C-erbB2基因的表达在肿瘤发生过程中的作用已得到越来越多的重视。研究发现,在脑胶质瘤中C-erbB2基因的高表达激活了凋亡的抑制剂丝氨酸激酶(AKT),引发细胞去凋亡化的发生[1-2]。另有研究报道,C-erbB2基因被抑制后,肿瘤细胞出现明显的凋亡效应,并且细胞凋亡的发生呈时间依赖性,同时使细胞的增殖活性降低[3]。因此,探索如何抑制胶质瘤相关癌基因表达和增加抑癌基因的表达,对于胶质瘤的早期预防和临床治疗具有重要的价值[4]。RNA干扰(RNA interference, RNAi)是指在进化过程中高度保守的、由双链RNA(double-stranded RNA, dsRNA)诱发的、同源mRNA高效特异性降解的现象。由于使用RNAi技术可以特异性剔除或关闭特定基因的表达,所以该技术已被广泛用于探索基因功能和传染性疾病及恶性肿瘤的基因治疗领域[5]。本实验拟采用封闭人C-erbB2基因表达的shRNA表达载体pGenesil-erbB2导入靶细胞BT325细胞内,从而通过不同的方法观察mRNA干扰对BT325细胞生物学行为的影响,并为进一步开展临床应用奠定基础。
1 材料与方法
1.1细胞株人胶质瘤细胞株BT325由西安交通大学医学院中心实验室提供。
1.2主要试剂本研究中所使用的载体pGenesil质粒和感受态大肠杆菌DH5α购自武汉市晶赛生物工程技术有限公司,DNA连接酶及缓冲液均购自New England Biolabs公司,凝胶回收试剂盒和小量质粒提取试剂盒购自北京天根生化技术有限公司,C-erbB2单克隆抗体购自北京中山生物试剂公司。本实验所用相关基本试剂及实验耗材均购自西安交通大学实验耗材供应中心,无菌台、培养箱、电泳仪、荧光显微镜等仪器均由西安交通大学医学院中心实验室提供。
1.3方法
1.3.1稳定转染质粒的构建与鉴定 以人C-erbB2 cDNA基因为靶标的引物设计,选取人C-erbB2 cDNA基因中的172-2260核苷酸为靶标,设计两条寡核苷酸片段。序列如下:寡核苷酸序列:BamHⅠ酶切位点5′-GATCCCGGAAACCTGGAACTCACCTACTTCAAGAGAGTAGGTGAGTTCCAGGT-TTCCTTTTTTGGAAA-3′,3′-GGCCTTTGGACC-TTGAGTGGATGAAGTTCTCTCATCCACTCAA-GGTCCAAAGGAAAAAACCTTTTCGA-5′HindⅢ酶切位点;阴性对照寡核苷酸序列:5′-GATCCAAGCTTCATAAGGCGCATAGCTTCAAGAG-AGCTATGCGCCTTATCAAGCTTTTTTTTGG-AAA-3′,3′-GTTCGAACTATTCCGCGTATCGA-AGTTCTCTCGATACGCGGAATAGTTCGAAA-AAAAACCTTTTCGA-5′。将合成的两条寡核苷酸片段用TE缓冲液(pH 8.0)稀释成0.05 nmol/μL。分别取5 μL混匀,沸水中放置10 min,缓慢冷却至室温,-20 ℃保存备用。之后取线性化的pGenesil-1质粒片段2 μL,两条寡核苷酸片段退火所得的产物2 μL,T4连接酶0.5 μL,T4连接酶缓冲液1 μL,H2O 4.5 μL,16 ℃连接过夜。以连接产物转化大肠杆菌DH5α感受态细胞,铺于含卡那霉素的LB平板上,37 ℃培养12~16 h。提取质粒,将提取的重组质粒pGenesil-erbB2和pGenesil-GHK同时用8 g/L琼脂糖凝胶进行电泳,进行初步判断后将摇出的菌液送往北京奥科生物技术有限责任公司测序鉴定。
1.3.2细胞的培养、转染与鉴定 将含细胞的冻存管从液氮罐中取出直接投入37 ℃温水中,待融化后将冻存管转移至无菌台中操作,进行换液、传代。通过LipofectAMINETM2000法,将pGenesil-erbB2、pGenesil-GHK稳定转染入BT325细胞,48 h后加入适量G418进行筛选,两周后出现多个单细胞集落,将混合集落扩大培养,冻存备用。将未转染的BT325细胞和稳定转入pGenesil-erbB2的BT325细胞置于荧光显微镜下观察,并分别制作细胞爬片,DAB显色后照相并进行灰度分析及RT-PCR检测。之后分别提取未转染的BT325细胞,并将稳定转染pGenesil-erbB2的BT325细胞和稳定转染pGenesil-GHK的BT325细胞的总蛋白进行蛋白杂交检测。
1.3.3γ射线照射后BT325细胞的存活率 取对数生长期的未转染BT325细胞,稳定转染pGenesil-erbB2的BT325细胞和稳定转染pGenesil-GHK的BT325细胞,分别制备成单细胞悬液。根据不同的照射剂量(照射剂量分为:8、6、4、2、1、0 Gy)分别将细胞株接种至直径为6 cm的培养皿。将上述0~8 Gy各组培养皿放在37 ℃培养箱中孵育。待细胞完全贴壁后进行γ射线照射,照射结束后,将上述培养皿移至37 ℃培养箱中,开放培养10 d,10 g/L结晶紫染色计数 (大于50个细胞的细胞集落算作一个克隆)。统计结果并计算出BT325细胞的存活曲线。
1.3.4将pGenesil-erbB2稳定转染入BT325细胞后细胞周期的检测 将对数生长期的转染的和未转染的BT325细胞接种于6孔平底细胞培养板中,每孔细胞接种的浓度为1×105/mL,每孔总液量2 mL。转染48 h后,用2.5 g/L的胰蛋白酶消化后,分别收集每孔细胞。用4 ℃预冷的0.01 mol/L的PBS洗涤2次(800 r/min,8 min),弃上清液,加4 ℃预冷的750 mL/L乙醇固定过夜,再次离心后弃上清液,用0.01 mol/L PBS洗涤一次(800 r/min,8 min),弃上清液,每孔加RNase(10 mg/mL)100 μL,室温孵育10 min。每孔细胞加PI(100 μg/mL)染液100 μL,37 ℃避光孵育30 min,上流式细胞仪检测。每个样品取1×104个细胞,细胞在488 nm处被氩激光激发,PI的红色荧光通过630 nm滤光片收集,结果用B-D FAC Sort Cell Quest软件做DNA分析。
1.3.5将pGenesil-erbB2稳定转染入BT325细胞后细胞凋亡的检测 用去离子水按1∶4稀释结合缓冲液,以4 ℃预冷的PBS洗涤细胞2次,用250 μL结合缓冲液重新悬浮细胞,使其细胞浓度为1×105/mL。加100 μL的细胞悬液入5 mL流式管中,每管加入5 μL Annexin V/FITC和5 μL 20 μg/mL的碘化丙锭,避光混匀,标记15 min。对照不加Annexin V作校正因子,在反应管中加入400 μL PBS。用流式细胞仪(FACS)检测,光源为488 nm氩离子激光器。
1.3.6统计学处理 采用SPSS 13.0软件,进行t检验。Real-time PCR结果应用SPSS 13.0软件进行统计学分析,各组计量资料以均值±标准差表示。用One-way ANOVA(单因素方差分析)进行各组间的比较,P<0.05认为差异有统计学意义。
2 结 果
2.1成功构建人C-erbB2基因shmRNA质粒挑选克隆经测序分析确认插入序列正确,表明pGenesil-erbB2中已含有shRNA模板DNA片段。阳性重组质粒送北京奥科生物技术有限责任公司测序鉴定,结果说明成功构建了C-erbB2基因shRNA表达质粒(图1)。
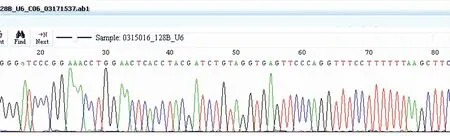
图1构建的pGENESIL-erbB2质粒测序图
Fig.1 Sequence diagram of pGENESIL-erbB2
2.2pGenesil-erbB2和pGenesil-GHK稳定转染入BT325细胞荧光显微镜观察发现未转染的细胞内未见荧光,而转染pGenesil-erbB2后的BT325细胞荧光显著。说明pGenesil-erbB2成功转染入BT325细胞(图2)。

图2质粒载体转染后的荧光照片
Fig.2 Fluorescent images of BT325 cells after the transfection of pGenesil-erbB2
A:对照组BT325细胞;B:转染pGenesil-erbB2后的BT325细胞。
2.3转染后BT325细胞的免疫组织化学鉴定C-erbB2蛋白主要分布在胞质内,空白对照组未转染的BT325细胞的灰度明显强于转染后的实验组pGenesil-erbB2-BT325细胞,说明经过转染后,C-erbB2目的蛋白含量明显下调(P<0.01)。同时形态学观察可见,转染后大部分细胞凋亡坏死,细胞形态破损。灰度值检测表明pGenesil-erbB2转染48 h后,C-erbB2蛋白表达明显降低(图3)。
2.4未转染和稳定转染后BT325细胞内C-erbB2目的蛋白的表达从实验组pGenesil-erbB2-BT325中目的蛋白的表达可以看出,RNAi组的蛋白表达量与对照组pGenesil-GHK-BT325和未转染BT325相比较,表达量明显降低,说明RNAi的效果比较明显,C-erbB2蛋白的表达被shRNA所抑制(图4)。吸光度分析显示相对对照组BT325,p27增加了3.8倍;p53增加了2.5倍;p-p53增加了3.6倍;Bcl-2降低了4.5倍;p-p38增加了3.4倍(P<0.05);p38无显著性差异(P>0.1)(图5)。

图3pGenesil-erbB2转染48h后C-erbB2蛋白表达量的变化
Fig.3 The expression of C-erbB2 protein at 48 h after the transfection of pGenesil-erbB2
A:BT325细胞转染前C-erbB2的表达情况;B:BT325细胞转染后C-erbB2的表达情况。

图4pGenesil-erbB2转染后对BT325细胞目的蛋白表达的Westernblot分析
Fig.4 Western blot analysis of the effect of pGenesil-erbB2 on the expression of target protein in BT325 cells
1:BT325细胞组;2:pGenesil-GHK-BT325细胞组;3:pGenesil-erbB2-BT325细胞组。
2.5未转染和稳定转染后BT325细胞内C-erbB2目的基因mRNA的表达从实验组pGenesil-erbB2-BT325中目的基因的mRNA的表达来看,转染组的C-erbB2 mRNA表达量与对照组pGenesil-GHK-BT325和未转染BT325相比较,表达量明显降低,说明RNAi的效果比较明显,C-erbB2基因的表达被shRNA所抑制(图6)。同时进行mRNA吸光度分析,相对未转染的BT325细胞,C-erbB2降低了8.3倍,p27增加了2.8倍,p53增加了2.7倍,Bcl-2降低了3.7倍(图7),差异具有统计学意义(P<0.05)。

图5pGenesil-erbB2转染后对BT325细胞目的蛋白表达的吸光度分析
Fig.5 Ratios of the absorbance of effect of pGenesil-erbB2 on the expression of target protein in BT325 cells

图6pGenesil-erbB2对BT325细胞C-erbB2mRNA表达的影响
Fig.6 RT-PCR analysis of the effect of pGenesil-erbB2 on the expressions of C-erbB2 in BT325 cells
1:Marker;2:pGenesil-erbB2-BT325细胞组;3:BT325细胞组;4:pGenesil-GHK-BT325细胞组。

图7pGenesil-erbB2转染后对BT325细胞C-erbB2,Bcl-2,p53,p27mRNA表达的影响
Fig.7 Ratios of the absorbance of effect of pGenesil-erbB2 on the expressions of C-erbB2, Bcl-2, p53 and p27 in BT325 cells
2.6将pGenesil-erbB2稳定转染入BT325细胞后对细胞周期的影响应用流式细胞仪检测细胞周期,结果显示未转染BT325细胞组和阴性对照pGenesil-GHK-BT325细胞组之间的各细胞周期时相变化较小,G1/G0期细胞占绝大多数,分别为71.75%和70.89%;实验组细胞pGenesil-erbB2-BT325的G1/G0期细胞显著减少(P<0.05),S期细胞大量增加(P<0.05),其中G1/G0期细胞仅占44.01%,而S期细胞占到51.15%(图8)。
2.7将pGenesil-erbB2稳定转染入BT325细胞后对细胞凋亡的影响应用Annexin V+PI流式细胞仪检测法获得的结果显示,未转染BT325细胞组和阴性对照pGenesil-GHK-BT325细胞组各时相之间没有显著差别,变化较少。细胞实验组pGenesil-erbB2-BT325组比未转染BT325细胞组和阴性对照pGenesil-GHK-BT325细胞组的正常细胞大量减少(P<0.05),早凋亡细胞和晚凋亡细胞明显增加(P<0.05)(图9)。
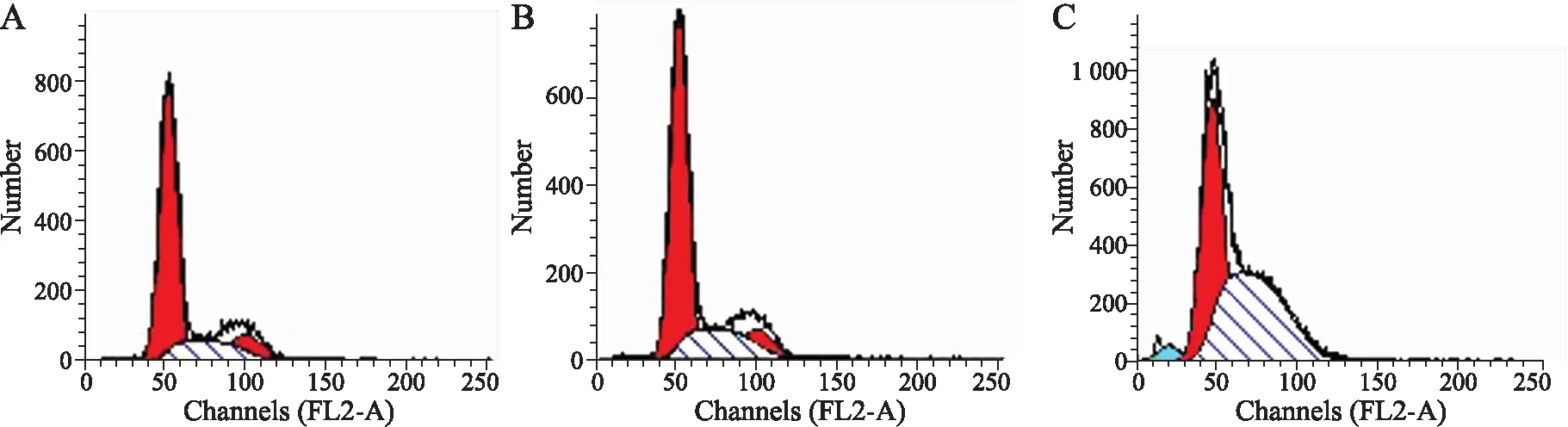
图8pGenesil-erbB2转染后BT325细胞周期的变化
Fig.8 Changes in cell cycle of BT325 cells after the transfection of pGenesil-erbB2
A:BT325细胞组;B:pGenesil-GHK-BT325细胞组;C:pGenesil-erbB2-BT325细胞组。
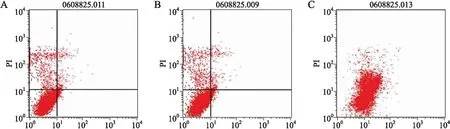
图9pGenesil-erbB2转染对BT325细胞凋亡的影响
Fig.9 Effects of the transfection of pGenesil-erbB2 on apoptosis of BT325 cells
A:BT325细胞组;B:pGenesil-GHK-BT325细胞组;C:pGenesil-erbB2-BT325细胞组。
2.8pGenesil-erbB2转染后BT325细胞对γ射线的敏感性增加集落形成法剂量-细胞存活曲线结果显示,经处理后平均致死剂量(D0)降低,存活曲线肩区(Dq)变小,说明pGenesil-erbB2对脑胶质瘤细胞BT325有放射增敏作用(图10)。
3 讨 论
C-erbB2主要通过影响p53,p38,p27,Bcl-2等基因片段的表达以调控细胞周期和凋亡机制,其中以p53及Bcl-2尤为显著。目前,对于p53的研究发现,野生型P53可控制G1细胞进入S期,故其对于抑制异常细胞增殖和肿瘤的发生具有重要意义[6]。当P53基因突变后不仅会丧失抑癌作用,而且还有促进肿瘤细胞恶性转化的作用[7]。Bcl-2抑癌基因具有抑制细胞丢失、阻止细胞凋亡等功能,对各种原因引起的细胞凋亡均具有抑制作用[8]。
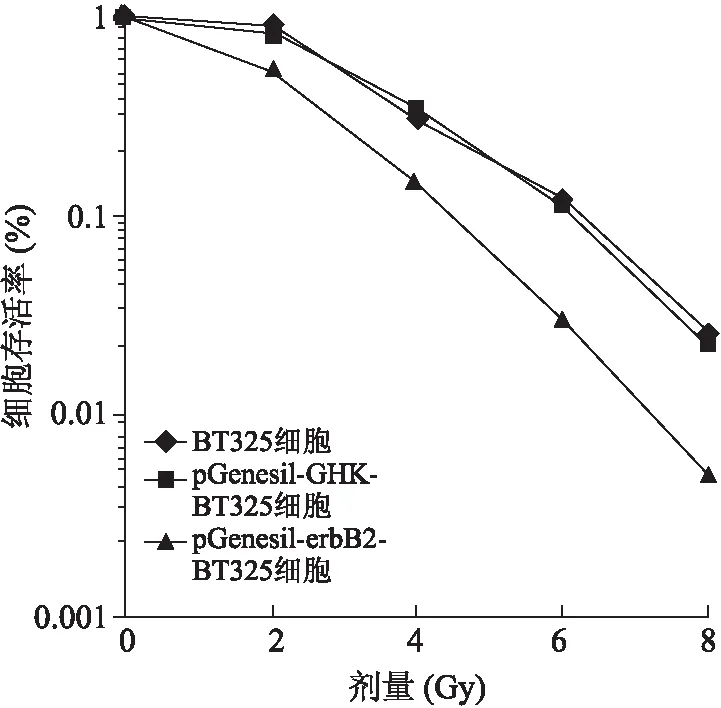
图10pGenesil-erbB2转染后BT325细胞的存活曲线
Fig.10 Survival curve of BT325 cells after the transfection of pGenesil-erbB2
经过前期实验,结果表明C-erbB2在胶质瘤和正常脑组织中差异表达,且筛选出了C-erbB2表达量最高的BT325细胞作为研究的靶细胞,同时成功构建了封闭人C-erbB2基因表达的shRNA表达载体pGenesil-erbB2。本实验在前期实验的基础上,应用C-erbB2 shRNA构建质粒载体并转染筛选出的高表达C-erbB2蛋白的细胞株BT325,经过免疫组化染色、Western blot、RT-PCR及流式细胞仪检测等方法观察抑制C-erbB2基因表达对于胶质瘤细胞生长、凋亡的影响,并联合γ射线照射来探索以C-erbB2作为靶点的抗癌治疗及联合放疗的预期效果。
实验中通过免疫组化形态学观察可见,经转染后大部分肿瘤细胞出现凋亡坏死,细胞形态破损,细胞结构完全破坏。Western blot结果表明细胞内C-erbB2蛋白表达下降后,Bcl-2表达明显下降,p53、p-p53、p-27、p-p38等抑癌基因表达显著增加。RT-PCR结果表明,在细胞内C-erbB2 mRNA表达下降后,Bcl-2 mRNA表达显著减少,而p53和p27 mRNA表达明显上调,这与C-erbB2在胃癌中的相关研究结果相符合[9-10]。而流式细胞仪检测细胞凋亡证明干扰处理组细胞早凋亡细胞是空白对照组(BT325)的15.2倍,晚凋亡是空白对照组的12.7倍,坏死细胞是空白对照组的1.9倍,差异有统计学意义(P<0.05);细胞周期检测证明干扰后G1/G0期和G2/M期细胞明显减少,S期细胞增加了5.8倍,这些与KUMARI N在2012年及AKSU G等人在2011年报道的C-erbB2在胆囊癌及胸部肿瘤中的研究结果相一致[11-12]。因此,研究结果证明构建的载体pGenesil-erbB2通过对Bcl-2 mRNA的干扰作用,有效的降低了Bcl-2的表达,并通过上调p53 mRNA和p27 mRNA,显著增加了p53、p-p53和p-27的表达,加速了肿瘤细胞的凋亡,并减少了其处于分裂期细胞的比例,从而抑制了胶质瘤细胞BT325的生长及分裂,一定程度上减少了肿瘤的发生。
经γ射线照射后BT325细胞的存活率结果表明,经pGenesil-erbB2转染后BT325细胞的平均致死剂量(D0)降低,存活曲线肩区(Dq)变小。进一步证明了在基因层面上通过转染pGenesil-erbB2抑制了C-erbB2的表达后,胶质瘤BT325细胞对γ射线的敏感程度明显上升。因此,pGenesil-erbB2质粒载体转染有明显的放射增敏作用,可显著增加γ射线对胶质瘤细胞的杀伤能力。
综上所述,本研究证明以C-erbB2为靶向的shRNA可以有效的抑制C-erbB2的表达,并可能通过抑制相关癌基因表达和增加抑癌基因的表达来诱导BT325细胞的凋亡;通过分析C-erbB2对胶质瘤细胞增殖的作用,阐明C-erbB2对胶质瘤发生发展的调控机制,为胶质瘤的早期预防和临床治疗提供更充分的理论依据;探讨以C-erbB2作为靶点的抗癌治疗及联合γ射线放疗的效果,可能成为C-erbB2治疗的一个新的突破口,为临床上脑胶质瘤的早期预防和基因治疗开辟一条新的途径,预期具有重要的理论意义和实际应用价值。
参考文献:
[1] BENDARDAF R, LAMLUM H, PYRHONEN S. Prognostic and predictive molecular markers in colorectal carcinoma [J]. Anticancer Res, 2004, 24(4):2519-2530.
[2] AGNANTIS NJ, GOUSSIA AC, STEFANOU D. Tumor markers. An update approach for their prognostic significance. Part I [J]. In Vivo, 2003, 17(6):609-618.
[3] RAMAKRISHNA G, SITHANANDAM G, CHENG RY, et al. K-ras p21 expression and activity in lung and lung tumors [J]. Exp Lung Res, 2000, 26(8):659-671.
[4] NAKOPOULOU L, VOURLAKOU C, ZERVAS A, et al. The prevalence of bcl-2, p53, and Ki-67 immunoreactivity in transitional cell bladder carcinomas and their clinicopathologic correlates [J]. Hum Pathol, 1998, 29(2):146-154.
[5] 孙建国,廖荣侠,陈正堂. RNA干涉分子机制研究进展[J]. 生物化学与生物物理进展, 2005, 29(5):678-672.
[6] TAHARA E. Genetic pathways of two types of gastric cancer [J]. IARC Sci Publ, 2004, (157):327-349.
[7] VET JA, BRINGUIER PP, SCHAAFSMA HE, et al. Comparison of P53 protein overexpression with P53 mutation in bladder cancer: clinical and biologic aspects [J]. Lab Invest, 1995, 73(6):837-843.
[8] MELLON JK, LUNEC J, WRIGHT C, et al. C-erbB-2 in bladder cancer: molecular biology, correlation with epidermal growth factor receptors and prognostic value [J]. J Urol, 1996, 155(1):321-326.
[9] BAYRAK M, OLMEZ OF, KURT E, et al. Prognostic significance of c-erbB2 overexpression in patients with metastatic gastric cancer [J]. Clin Transl Oncol, 2013, 15(4):307-312.
[10] WANG YL, SHEU BS, YANG HB, et al. Overexpression of c-erb-B2 proteins in tumor and non-tumor parts of gastric adenocarcinoma--emphasis on its relation to H. pylori infection and clinicohistological characteristics [J]. Hepatogastroenterology, 2002, 49(46):1172-1176.
[11] KUMARI N, KAPOOR VK, KRISHNANI N, et al. Role of C-erbB2 expression in gallbladder cancer [J]. Indian J Pathol Microbiol, 2012, 55(1):75-79.
[12] AKSU G, DUMAN C, GURBUZ Y, et al. Correlation between c-erbB2 expression, lymphovascular invasion and other biological and clinical prognostic factors and preoperative tumor markers in patients with early-stage and locally advanced breast cancer [J]. J BUON, 2011, 16(1):52-57.
