水生光合生物对茂兰拉桥泉及其下游水化学和d13CDIC昼夜变化的影响
2014-06-26刘再华
陈 波, 杨 睿, 刘再华, 晏 浩, 赵 敏
水生光合生物对茂兰拉桥泉及其下游水化学和13CDIC昼夜变化的影响
陈 波1,2, 杨 睿1,2, 刘再华2*, 晏 浩1,2, 赵 敏2
(1. 中国科学院大学, 北京 100049; 2. 中国科学院 球化学研究所 环境地球化学国家重点实验室, 贵州 贵阳 550002)

岩溶水; 水化学; 碳同位素; 昼夜变化; 水生光合生物; 生物碳泵效应
0 引 言
岩溶作用对气候环境变化具有特殊的敏感性, 表现在岩溶地区的水化学在年际、季节甚至昼夜尺度上都具有明显的动态变化[1], 因而是研究全球气候变化影响的一个很好载体, 这也使得越来越多的研究者关注岩溶地区[1–8]。岩溶地区地表水因为土壤淋滤和碳酸盐岩溶蚀, 水中溶解无机碳(DIC)含量高, 是研究水与外界气体交换、方解石沉积、水生光合生物的光合与呼吸作用的天然系统[9]。随着研究的进一步深入, 刘再华等[10–11]提出了表征碳酸盐风化(含岩溶作用)的水-岩-气-生相互作用新模式, 并特别强调水生光合生物在岩溶作用过程中所发挥的重要作用。而要了解这一过程, 需要获得更多的生物地球化学证据, 特别是水化学昼夜变化的信息。
水生生物光合作用放出氧气, 而其呼吸作用耗氧产生CO2。在岩溶地区, 水生光合作用的碳源是溶解无机碳(DIC), DIC的变化直接影响水的pH的变化。因此, 可以把水中溶解氧(DO)和pH作为衡量水中光合生物新陈代谢作用过程的主要指标。
不同的DIC来源其碳同位素组成不同, 而水中DIC同位素(13CDIC)组成能够直接反映水中物理、化学和生物过程的变化[12]。通过测定地表水中13CDIC值可以了解碳的源、汇以及交换通量[13–17]。
水温的昼夜变化会影响水中其他水化学参数以及水中溶解气体的变化[12], 如pH、(CO2) (二氧化碳分压)和DO (溶解氧)。一般而言, 在白天随温度的升高, 水中(CO2)和DO降低; 在晚上表现相反的规律。而由于岩溶水中(CO2)要远高于大气中的, CO2脱气作用导致水中pH在白天升高, 晚上降低。同时DIC和13CDIC的昼夜变化也受到了水物理特性变化的影响, 如脱气作用导致水中DIC的浓度降低, 而水中的气体交换, 碳酸盐岩的溶解沉淀等也会影响到13CDIC。De Montety.[18]认为: 在昼夜的时间尺度上, 主要控制岩溶水中的溶解氧(DO), 水中可溶性无机碳(DIC)和水中溶解无机碳同位素(13CDIC)变化的因素是水中光合生物的光合作用和呼吸作用, 而水温以及脱气作用可以忽略。这一结果与[19–21]中的认识也相一致。
本研究旨在通过对茂兰拉桥表层岩溶泉及其中游和下游池水进行昼夜(30 h)高分辨率(15 min/次)的动态监测, 获得泉口、中游及下游池水水化学的昼夜变化情况, 同时测定水中溶解无机碳同位素(13CDIC)组成变化, 以揭示水生光合生物对水化学和13CDIC时空变化的影响。通过水面静态箱法监测水面CO2浓度昼夜变化, 以获得水面CO2交换通量。最后, 结合池水出入口DIC的浓度变化, 估算在生长有大量沉水植物的中游池和几乎没有沉水植物的下游池, 因生物碳泵产生的不同的固碳能力。
1 研究区概况
茂兰拉桥表层岩溶泉位于贵州省荔波县国家自然保护区茂兰乡拉桥村(图1), 岩溶峰丛地貌发育, 区内的森林覆盖率达到87.3%。该地区主要分布着碳酸盐岩。研究点的海拔高度为776 m, 年平均气温约15.3 ℃, 全年降水量1752.5 mm, 雨季主要集中在4月到9月。该区具有春秋温暖冬无严寒夏无酷暑, 雨量充沛的中亚热带山地湿润气候特点。茂兰地区的基岩以石炭纪白云质灰岩为主[1,22]。研究区位于拉桥村的东南部, 泉水由顶部有原始森林覆盖的两座山间流出, 流量为0.05~30 L/s, 泉水的方解石饱和指数(SIC)都在0以上, 但没有钙华沉积[1]。本次进行昼夜自动监测的时间为2013年1月27日到28日, 其中1月27日为晴天, 1月28日为阴天。此时正处于干冷的旱季, 泉水流量仅0.585 L/s。人为阻隔将泉水流经的区域分成了泉口、中游池和下游池(图2), 经测量计算得到中游池和下游池的面积分别为283.7 m2和1311.36 m2。泉口可见少许沉水植物; 而中游池生长有大量的沉水植物, 以轮藻()为主, 且水深较浅(平均约20 cm); 下游池沉水植物较少, 但水面大且水较深(平均约80 cm) (图2)。

图1 茂兰拉桥地理位置(根据姜光辉等[22]修改)
2 研究方法
本研究主要采取野外自动监测和样品实验室分析相结合的方法。泉口及中游和下游的自动记录使用德国WTW公司生产的MultilineP3多参数仪350i型, 可以自动记录水温、pH值、电导率(EC)和水中溶解氧(DO), 分辨率分别为0.1 ℃, 0.004 pH单位, 1 μS/cm和0.01 mg/L。对3个监测点的自动记录仪进行统一校正后在同一时间开始进行监测记录, 各个点自动记录读数间隔时间设定为15 min, 监测周期为30 h。仪器在自动记录之前进行校正, 其pH值用4和7两种标准缓冲溶液进行校正, 而仪器的电导率(EC)用1412 μS/cm标准校正液校正, 实验结束后将仪器的pH和电导探头再放入标准液中进行验证, 数据虽然有一定偏差, 但在5%以内。

[Ca2+] = 0.15EC – 0.78,2= 0.94;
[Mg2+] = 0.04EC + 0.22,2= 0.77;


图2 茂兰拉桥泉及其中游和下游池水监测点
二氧化碳分压(CO2)计算公式为:
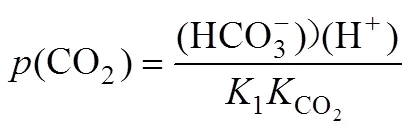

方解石饱和指数(SIC) 则由:
得出, 式中K为方解石平衡常数。
泉口及中游和下游水池的水样白天每隔2 h采一次, 晚上每隔4 h采一次, 采集的水样经过0.45 μm滤膜过滤后装在润洗干净的60 mL高密度聚乙烯瓶中。用于测阴离子的样品直接密封后放于暗箱中保存; 用于测阳离子的样品加超纯HNO3酸化至pH<2后密封放于暗箱中保存。另外用于13CDIC分析的样品加入过饱和HgCl2溶液后密封放于暗箱中保存。所有样品放入4 ℃冰箱保存直至实验室分析。

样品的13CDIC值在中国科学院地球化学研究所环境地球化学国家重点实验室测定(MAT252气体稳定同位素比质谱仪)。碳同位素值为相对于国际通用的V-PDB标准表示(‰), 分析误差小于0.15‰。
静态箱法收集水面CO2气体: 在收集气体前, 先让静态箱与空气中气体平衡, 然后将静态箱罩在水面上进行气体的采集。采集时间间隔分别设置为2 min、2 min、2 min、2 min、10 min和10 min, 在气体的采集过程中确保静态箱密封, 不让外界大气混入箱内。气体样品用气相色谱仪(型号: 安捷伦7890A)进行分析。
3 结果及分析
3.1 茂兰拉桥泉水及中游和下游池水水化学的昼夜变化
3.1.1 泉水的物理-化学昼夜变化

3.1.2 中游池水物理-化学的昼夜变化

同泉口类似, 中游池水化学明显的昼夜变化与水生光合生物的光合呼吸作用过程表现出一致性(由溶解氧的变化体现), 说明中游池水的昼夜变化主要是受光合水生生物的影响。经鉴定, 中游池水生光合生物优势种为沉水植物轮藻(), 其对水中碳的利用存在CO2富集机制(CCM), 与普通的C3植物不同, 即使在很低浓度的CO2条件下, 也能进行光合作用[24–25], 类似于C4植物, 但又不同于C4植物。轮藻的叶子在形态学上不存在陆地C4植物的花环结构, 所以其C4循环和卡尔文循环是独立存在于不同的细胞中[26]。

表1 泉水的水化学参数昼夜变化特征

图3 茂兰拉桥泉水及中游和下游池水的物理-化学参数的昼夜变化
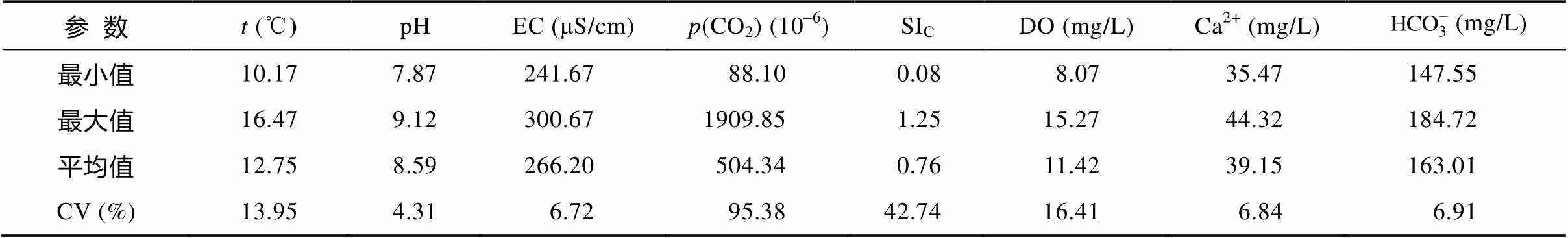
表2 中游池水物理和化学参数的昼夜变化特征
在白天, 水生光合生物消耗DIC, 促进碳酸钙沉积; 在夜间, 水生植物没有光合作用, 主要是呼吸产生CO2, 加速了碳酸钙溶解。此过程中发生了以下反应:
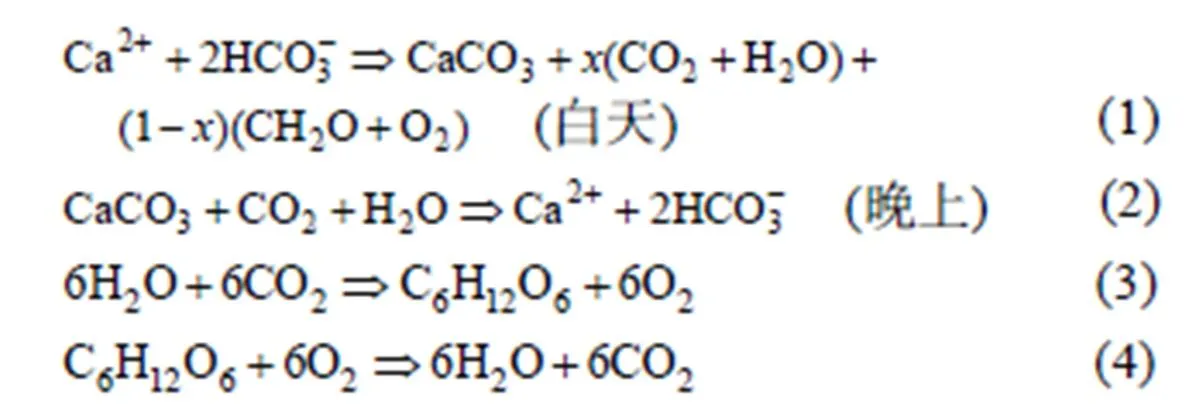

3.1.3 下游池水的物理-化学特征变化
由图3和表3可知, 下游池水的水化学变化明显小于中游池水, 其中pH和EC的变异系数(CV)<1%。虽然下游池水中也生长了少量的沉水植物(轮藻), 但下游池水体积远大于中游池和泉口, 库效应占主导, 调蓄能力强, pH与EC几乎看不出昼夜变化。1月27日光照较强, 白天下游池水温呈现先上升后下降的趋势, 最高温度达到了13.47 ℃, 出现在16: 00左右, 与中游的水温变化相一致, 但变幅较小。而其他的水化学参数, 如(CO2)、SIC与DO的变化也不大, 甚至比泉水的还要小。
3.2 茂兰拉桥泉水及中游和下游池水d13CDIC昼夜变化
泉口13CDIC的变化很小(图4), 仅0.4‰左右, 平均值–11.82‰, 这与其他研究结果[15, 29–32]相似, 反映泉水的DIC主要来自于碳酸盐岩风化和土壤呼吸产生的CO2溶解。

表3 下游池水的物理和化学参数昼夜变化特征
中游池水13CDIC变化范围最大(图4), 达2.61‰, 平均–7.84‰。影响13CDIC变化的因素包括生物过程(光合和呼吸作用)、与大气的气体交换、方解石的沉淀和溶解[9]。沉水植物光合利用DIC使之降低时, 由于优先利用低能量的12C[33–34], 导致池水DIC中13C累积,13CDIC随光合作用的进行逐渐升高[15,17,35]。晚上没有光照不能进行光合作用, 呼吸作用产生CO2, 而其13C与水生生物的13C基本相同, 大约为–22.4‰[36], 这使得水的13CDIC降低。有趣的是, 在1月27日16: 00时所测的13CDIC没有升高反而下降, 这可能是由于水生生物光合作用太强, DIC的强烈消耗使水中CO2<空气CO2, 从而空气中CO2溶解在水中, 发生动力分馏, 据Herczeg.[37]分馏系数甚至可以达到–13‰。1月28日, 中游池水中13CDIC并不像1月27日有明显的周期变化, 分析可能原因是由于与27日不同, 由于光照强度明显减弱, 水生生物光合作用强度明显要弱于前一日, 在水中无机碳同位素的变化上表现就不明显, 如泉水。下游池水13CDIC昼夜变化居中, 约0.6‰, 变化趋势与中游池水相似, 但存在大约2 h的滞后, 这可能是下游水池水体大, 库效应显著的结果[38]。
3.3 茂兰拉桥泉口、中游和下游池水水面CO2通量及生物碳泵效应估算
分别在1月27日中午(12: 00~13: 30)、晚上(18: 00~ 19: 30)和1月28日早上(8: 00~9: 30)测定得到泉口及中、下游水面静态箱内CO2在0.5 h内的浓度变化值, 作图得出变化斜率(CO2浓度变化速率), 利用下面的公式计算得到水面的CO2交换通量:

式中:表示静态箱的体积, 经测量为14 L;表示静态箱的面积, 为0.1256 m2; 44表示CO2的分子量; d/d表示静态箱内CO2浓度的变化速率。
分别计算得到泉口及其中、下游池水水面在早上、中午和晚上的CO2交换通量, 取平均, 得到一天的碳通量值 (表4)。
泉口水面静态箱收集气体的位置位于泉水流出后的一个测量泉流量的小三角堰内, 堰内水中生长着少量的沉水植物, 对水面CO2浓度变化有一定影响, 在早上、中午和晚上三个时间所测定的CO2浓度变化速率并不相同(图5a)。

引起水中DIC变化的原因包括方解石沉积/溶解、与空气中的CO2交换以及沉水植物的新陈代谢(光合作用与呼吸作用)[9]。而从表2至表4可以看出, 泉水从泉口流出经过中游和下游水池, DIC的浓度是逐渐降低的。

表4 茂兰拉桥泉及其中、下游水面CO2通量计算

图5 茂兰拉桥泉口及其中、下游池水水面静态箱内早、中、晚CO2浓度变化
DIC从泉口出来, 除了方解石沉积(以Ca2+减少表征)和与空气中CO2进行交换外, 其余部分以有机碳(OC)形式被固定下来。根据质量守恒定律, 水池中被生物碳泵产生的有机碳计算公式如下:
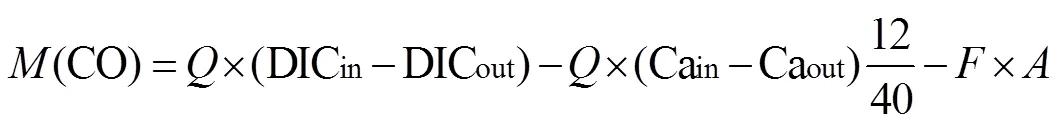
式中: M(OC)表示一天所能固定下来的有机碳(mg/d); Q代表流量(L/d); DICin、DICout分别代表进、出水池的浓度(mg C/L); Cain、Caout分别代表进、出水池的Ca2+的量(mg/L), 12/40是钙换算为碳的因子; F代表与空气交换CO2的通量(mg C/(m2 d)); A表示池水表面的面积。
由此可得中游池产生的有机碳:
(OC)=50544×(39.81–32.07)–50544×(48.53–39.15)×

下游池产生的有机碳:
(OC)=50544×(35.37–32.07)–50544×(43.15–39.15)×

因此, 中游池通过生物碳泵所产生的有机碳通量为920.23 mg/(d·m2), 也即是336 t C/(a·km2), 是海洋“生物碳泵”的51倍[43]。这说明, 岩溶地区光合水生生物对水中溶解无机碳DIC的利用对全球碳汇可能具有重要贡献。
下游池水冬季能产生的有机碳通量为33.53 mg/ (d·m2), 也即是12.24 t C/(a·km2), 与中游相差一个数量级以上。
总之, 生物碳泵作用把DIC转化成有机碳(TOC), 使得碳酸盐风化在长时间尺度上也可能具有碳汇效应[44–45]。但转化为有机碳(TOC)包括了溶解有机碳(DOC)和颗粒有机碳(POC), 其中DOC不稳定, 容易被光辐射和生物降解[46–48], POC沉积下来也会有部分被微生物分解成为CO2和CH4等。因此, 对于真正能够埋藏下来的稳定有机碳(OC)汇的定量分析仍需更多的研究和探索。
4 结 论

从泉口流出的溶解有无机碳(DIC), 经由中游和下游后降低, 减少的DIC一部分转换为碳酸钙沉积, 一部分通过脱气作用以CO2释放到空气中, 还有一部分DIC被水生生物通过光合作用转化为有机碳(OC)。在分布有大量沉水植物(轮藻)的中游池, 即使是在冬季, 在有太阳光照的条件下, 还能从空气中吸收CO2作为碳源进行光合作用固碳, 如在光合作用较强的时间段(1月27日13:00~19:00), 水中(CO2)甚至比空气中(390×10–6)还要低, 大约在88.10×10–6~293.76×10–6之间, 类似于海洋中的“生物碳泵”效应。固碳通量达到了336 t C/(a·km2), 是海洋“生物碳泵”的51倍之多。然而, 被固定下来的内源有机碳(OCau)有多少被稳定埋藏, 还需要以后的工作进一步确定。同时, 由于本文所研究的水域被人为地分为了泉口、中游池和下游池三个部分, 在一定程度上水流受到人为扰动的影响, 类似人工小水库。对于自然无扰动的岩溶区, 当存在富集沉水植物的小湖时, 其生物碳泵效应也应与中游池类似, 而贫沉水植物的小湖则应与下游池类似, 这些还有待实际的验证。
[1] Liu Zaihua, Li Qiang, Sun Hailong, Wang Jinliang. Seasonal diurnal and storm-scale hydrochemical variations of typical epikarst springs in subtropical karst areas of SW China: Soil CO2and dilution effects [J]. J Hydrol, 2007, 337(1): 207–223.
[2] Holloway J M, Dahlgren R A. Seasonal and event-scale variations in solute chemistry for four Sierra Nevada catchments [J]. J Hydrol, 2001, 250(1): 106–121.
[3] Liu Z, Groves C, Yuan D, Meiman J, Jiang G, He S, Li Q. Hydrochemical variations during flood pulses in the south-west China peak cluster karst: Impacts of CaCO3- H2O-CO2interactions [J]. Hydrol Process, 2004, 18(13): 2423–2437.
[4] Liu Z, Li Q, Sun H, Liao C, Li H, Wang J, Wu K. Diurnal variations of hydrochemistry in a travertine-depositing stream at Baishuitai, Yunnan, SW China [J]. Aquat Geochem, 2006, 12(2): 103–121.
[5] Liu Z, Liu X, Liao C. Daytime deposition and nighttime dissolution of calcium carbonate controlled by submerged plants in a karst spring-fed pool: Insights from high time-resolution monitoring of physico-chemistry of water [J]. Environ Geol, 2008, 55(6): 1159–1168.
[6] Zhao M, Zeng C, Liu Z, Wang S. Effect of different land use/land cover on karst hydrogeochemistry: A paired catchment study of Chenqi and Dengzhanhe, Puding, Guizhou, SW China [J]. J Hydrol, 2010, 388(1): 121–130.
[7] Hayashi M, Vogt T, Mächler L, Schirmer M. Diurnal fluctuations of electrical conductivity in a pre-alpine river: Effects of photosynthesis and groundwater exchange [J]. J Hydrol, 2012, 450: 93–104.
[8] Zeng C, Gremaud V, Zeng H, Liu Z, Goldscheider N. Temperature-driven meltwater production and hydrochemical variations at a glaciated alpine karst aquifer: Implication for the atmospheric CO2sink under global warming [J]. Environ Earth Sci, 2012, 65(8): 2285–2297.
[9] Spiro B, Pentecost A. One day in the life of a stream — A diurnal inorganic carbon mass balance for a travertine- depositing stream (waterfall beck, Yorkshire) [J]. Geomicrobiol J, 1991, 9(1): 1–11.
[10] Liu Z, Dreybrodt W, Wang H. A new direction in effective accounting for the atmospheric CO2budget: Considering the combined action of carbonate dissolution, the global water cycle and photosynthetic uptake of DIC by aquatic organisms [J]. Earth Sci Rev, 2010, 99(3): 162–172.
[11] Yang R, Liu Z, Zeng C, Zhao M. Response of epikarst hydrochemical changes to soil CO2and weather conditions at Chenqi, Puding, SW China [J]. J Hydrol, 2012, 468: 151–158.
[12] Han G, Tang Y, Wu Q. Hydrogeochemistry and dissolved inorganic carbon isotopic composition on karst groundwater in Maolan, southwest China [J]. Environ Earth Sci, 2010, 60(4): 893–899.
[13] Buhl D, Neuser R, Richter D, Riedel D, Roberts B, Strauss H, Veizer J. Nature and nurture: Environmental isotope story of the river Rhine [J]. Naturwissenschaften, 1991, 78(8): 337–346.
[14] Aravena R, Schiff S, Trumbore S E, Dillon P, Elgood R. Evaluating dissolved inorganic carbon cycling in a forested lake watershed using carbon isotopes [J]. Radiocarbon, 2006, 34(3): 636–645.
[15] Pawellek F, Veizer J. Carbon cycle in the upper Danube and its tributaries:13CDICconstraints [J]. Isr J Earth Sci, 1994, 43: 187–194.
[16] Taylor C, Fox V. An isotopic study of dissolved inorganic carbon in the catchment of the Waimakariri River and deep ground water of the North Canterbury Plains, New Zealand [J]. J Hydrol, 1996, 186(1): 161–190.
[17] Yang C, Telmer K, Veizer J. Chemical dynamics of the St. Lawrence riverine system:DH2O,18OH2O,13CDIC,34S sulfate, and dissolved87Sr/86Sr [J]. Geochim Cosmochim Acta, 1996. 60: 851–866.
[18] De Montety V, Martin J, Cohen M, Foster C, Kurz M. Influence of diel biogeochemical cycles on carbonate equilibrium in a karst river [J]. Chem Geol, 2011, 283: 31–43.
[19] Finlay J C. Controls of streamwater dissolved inorganic carbon dynamics in a forested watershed [J]. Biogeochemistry, 2003, 62: 231–252.
[20] Drysdale R, Lucas S, Carthew K. The influence of diurnal temperatures on the hydrochemistry of a tufa-depositing stream [J]. Hydrol Process, 2003, 17: 3421–3441.
[21] Parker S R, Gammons C H, Poulson S R, DeGrandpre M D. Diel variations in stream chemistry and isotopic composition of dissolved inorganic carbon, upper Clark Fork River, Montana, USA [J]. Appl Geochem, 2007, 22: 1329–1343.
[22] Jiang G, Guo F, Wu J, Li H, Sun H. The threshold value of epikarst runoff in forest karst mountain area [J]. Environ Geol, 2008, 55(1): 87–93.
[23] Wigley T. WATSPEC: A Computer Program for Determining the Equilibrium Speciation of Aqueous Solutions [M]. [s.l.]: British Geomorphological Research Group, 1977: 48p.
[24] Gattuso J-P, Allemand D, Frankignoulle M. Photosynthesis and calcification at cellular, organismal and community levels in coral reefs: A review on interactions and control by carbonate chemistry [J]. Am Zool, 1999, 39(1): 160–183.
[25] Kufel L, Kufe I. Chara beds acting as nutrient sinks in shallow lakes—A review [J]. Aquat Bot, 2002, 72(3): 249–260.
[26] Bowes G, Salvucci M E. Plasticity in the photosynthetic carbon metabolism of submersed aquatic macrophytes [J]. Aquat Bot, 1989, 34(1): 233–266.
[27] Reiskind J B, Howard Berg R, Salvucci M E, Bowes G. Immunogold localization of primary carboxylases in leaves of aquatic and A C3-C4intermediate species [J]. Plant Sci, 1989, 61(1): 43–52.
[28] Magnin N C, Cooley B A, Reiskind J B, Bowes G. Regulation and localization of key enzymes during the induction of Kranz-less, C4-type photosynthesis in[J]. Plant Physiol, 1997, 115(4): 1681–1689.
[29] Atekwana E, Krishnamurthy R. Seasonal variations of dissolved inorganic carbon and13C of surface waters: Application of a modified gas evolution technique [J]. J Hydrol, 1998, 205(3): 265–278.
[30] Doctor D H, Kendall C, Sebestyen S D, Shanley J B, Ohte N, Boyer E W. Carbon isotope fractionation of dissolved inorganic carbon (DIC) due to outgassing of carbon dioxide from a headwater stream [J]. Hydrol Process, 2008, 22(14): 2410–2423.
[31] De Montety V, Martin J, Cohen M, Foster C, Kurz M. Influence of diel biogeochemical cycles on carbonate equilibrium in a karst river [J]. Chem Geol, 2011, 283(1): 31–43.
[32] Tobias C, Böhlke J K. Biological and geochemical controls on diel dissolved inorganic carbon cycling in a low-order agricultural stream: Implications for reach scales and beyond [J]. Chem Geol, 2011, 283(1): 18–30.
[33] Falkowski P G, Raven J A. Aquatic Photosynthesis [M]. Malden (MA): Blackwell Science, 1997: 375p.
[34] Telmer K, Veizer J. Carbon fluxes, CO2and substrate weathering in a large northern river basin, Canada: Carbon isotope perspectives [J]. Chem Geol, 1999, 159(1): 61–86.
[35] Flintrop C, Hohlmann B, Jasper T. Anatomy of pollution: Rivers of north Rhine-Westphalia, Germany [J]. Am J Sci, 1996, 296: 59–98.
[36] Jiang Y, Hu Y, Schirmer M. Biogeochemical controls on daily cycling of hydrochemistry and13C of dissolved inorganic carbon in a karst spring-fed pool [J]. J Hydrol, 2013, 478: 157–168.
[37] Herczeg A L, Fairbanks R G. Anomalous carbon isotope fractionation between atmospheric CO2and dissolved inorganic carbon induced by intense photosynthesis [J]. Geochim Cosmochim Acta, 1987, 51: 895–899.
[38] Newcombe G, Drikas M, Hayes R. Influence of characterised natural organic material on activated carbon adsorption: II. Effect on pore volume distribution and adsorption of 2-methylisoborneol [J]. Water Res, 1997, 31(5): 1065–1073.
[39] Ducklow H W, Steinberg D K, Buesseler K O. Upper ocean carbon export and the biological pump [J]. Oceanography, 2001, 14(4): 50–58.
[40] Ducklow H W, McCallister S L. The biogeochemistry of carbon dioxide in the coastal oceans [J]. The Sea, 2004, 13: 269–315.
[41] Riebesell U, Schulz K G, Bellerby R, Botros M, Fritsche P, Meyerhöfer M, Neill C, Nondal G, Oschlies A, Wohlers A. Enhanced biological carbon consumption in a high CO2ocean [J]. Nature, 2007, 450(7169): 545–548.
[42] Jiao N, Herndl G J, Hansell D A, Benner R, Kattner G, Wilhelm S W, Kirchman D L, Weinbauer M G, Luo T, Chen F. Microbial production of recalcitrant dissolved organic matter: Long-term carbon storage in the global ocean [J]. Nature Rev Microbiol, 2010, 8(8): 593–599.
[43] Passow U, Carlson C A. The biological pump in a high CO2world [J]. Mar Ecol Prog Ser, 2012, 470: 249–271.
[44] 刘再华. 岩石风化碳汇研究的最新进展和展望[J]. 科学通报, 2012, 57(2): 95–102. Liu Zaihua. New progress and prospects in the study of rock- weathering-related carbon sinks [J]. Chinese Sci Bull (Chin Ver), 2012, 57(2): 95–102 (in Chinese with English abstract).
[45] 刘彦, 张金流, 何媛媛, 孙海龙, 刘再华. 单生卵囊藻对DIC的利用及其对CaCO3沉积影响的研究[J]. 地球化学, 2010, 39(2): 191–196. Liu Yan, Zhang Jin-liu, He Yuan-yuan, Sun Hai-long, Liu Zai-hua. The utilization of dissolved inorganic carbon byand its influence on the precipitation of calcium carbonate [J]. Geochimica, 2010, 39(2): 191–196 (in Chinese with English abstract).
[46] Lindell M J, Granéli W, Tranvik L J. Enhanced bacterial growth in response to photochemical transformation of dissolved organic matter [J]. Limnol Oceanogr, 1995, 40(1): 195–199.
[47] Bushaw K L, Zepp R G, Tarr M A, Schulz-Jander D, Bourbonniere R A, Hodson R E, Miller W L, Bronk D A, Moran M A. Photochemical release of biologically available nitrogen from aquatic dissolved organic matter [J]. Nature, 1996, 381(6581): 404–407.
[48] Lindell M J, Graneli H W, Tranvik L J. Effects of sunlight on bacterial growth in lakes of different humic content [J]. Aquat Microb Ecol, 1996, 11(2): 135–141.
Effects of aquatic phototrophs on diurnal hydrochemical and13CDICvariations in an epikarst spring and two spring-fed ponds of Laqiao, Maolan, SW China
CHEN Bo1,2, YANG Rui1,2, LIU Zai-hua2*, YAN Hao1,2and ZHAO Min2
1. University of Chinese Academy of Sciences, Beijing 100049, China; 2. State Key Laboratory of Environmental Geochemistry, Institute of Geochemistry, Chinese Academy of Sciences, Guiyang 550002, China

karst water; hydrochemistry; stable carbon isotope; diurnal variations; aquatic phototrophs; biological carbon pump effect
P593
A
0379-1726(2014)04-0375-11
2013-09-22;
2013-11-30;
2014-01-02
国家重点基础研究发展计划(2013CB956700); 国家自然科学基金项目(41172232)
陈波(1990–), 男, 硕士研究生, 主要从事生物地球化学研究。E-mail: bobchen1990@gmail.com
LIU Zai-hua, E-mail: liuzaihua@vip.gyig.ac.cn, Tel: +86-851-5895263
